水公牛和荷斯坦奶公牛养分消化、瘤胃发酵及血液生化指标的比较研究
王宇,郑欣怡,古青弘,郑文金,林波,申军士*
(1. 南京农业大学动物科技学院消化道微生物研究室/江苏省消化道营养与动物健康重点实验室/国家动物消化道营养国际联合研究中心,江苏 南京 210095;2. 广西大学动物科学技术学院,广西 南宁 530005)
随着经济快速发展,饮食结构不断改善,人们对牛肉产量与质量有了更高要求,但牛肉供应能力有限,导致牛肉供需差距不断加大。2022年,我国屠宰肉牛约3 010万头,年度牛肉进出口贸易量合计约268.96万吨,比2021年度增加35.70万吨。牛肉净进口量268.95万吨,比2021年增加了35.70万吨[1]。根据国家统计局数据,2021年中国肉类消费中牛肉占比达11.6%,仅次于猪肉和禽肉。水牛具有乳、肉、役多种经济用途,饲养方便,养殖成本低,被国际粮农组织认为是最具有开发潜力和价值的家畜[2],我国存栏量居世界第三[3]。在我国,荷斯坦奶牛及其杂交后代是主要的奶牛品种,约占我国奶牛总数的80%[4],但其奶公牛的资源一直未得到重视,若能将其公牛充分利用,不仅能缓解国际市场上牛肉供应不足的紧张局面,而且可以满足广大消费者对高品质牛肉的需求[5]。国内外对两种牛单独研究居多[6-8],也有Puppo等[9]研究发现,在饲喂精粗比50:50的饲粮情况下,水牛对有机物、中性洗涤纤维物质的消化率显著低于奶牛,粗蛋白消化率相近。王其炎[10]研究表明,在饲喂同种混合青贮饲料的情况下,育成阶段的水牛表现出了耐粗饲的特性,粗蛋白和干物质消化率低于奶牛,两个组总挥发性脂肪酸差异不显著。为进一步探究二者差别,本文通过对水公牛与荷斯坦奶公牛瘤胃发酵参数、养分表观消化率及血液生化指标的比较研究,分析二者在养分摄入、瘤胃发酵环境、消化能力等方面的差异,以期为科学饲养水公牛和荷斯坦奶公牛,提高二者生产性能和经济效益提供理论依据和实践参考。
1 材料与方法
1.1 试验动物及基础设计
试验选取健康状况良好的15月龄(507.6±44.6)kg水公牛和12月龄(477.8±27.3)kg荷斯坦奶公牛各6头,单栏饲养,试验动物均来自于广西泰民兴牧业有限公司。试验牛每日饲喂两次相同日粮。试验预试期16 d,采样期6 d。
1.2 饲养管理及日粮
在整个试验期,饲喂试验牛以象草为粗饲料,精粗比为50∶50的全混合日粮,其日粮组成及营养水平见表1。每天饲喂两次(07:00和17:00),自由采食,记录采食量。全天保证洁净的饮水供给及干净卫生的饲养环境。
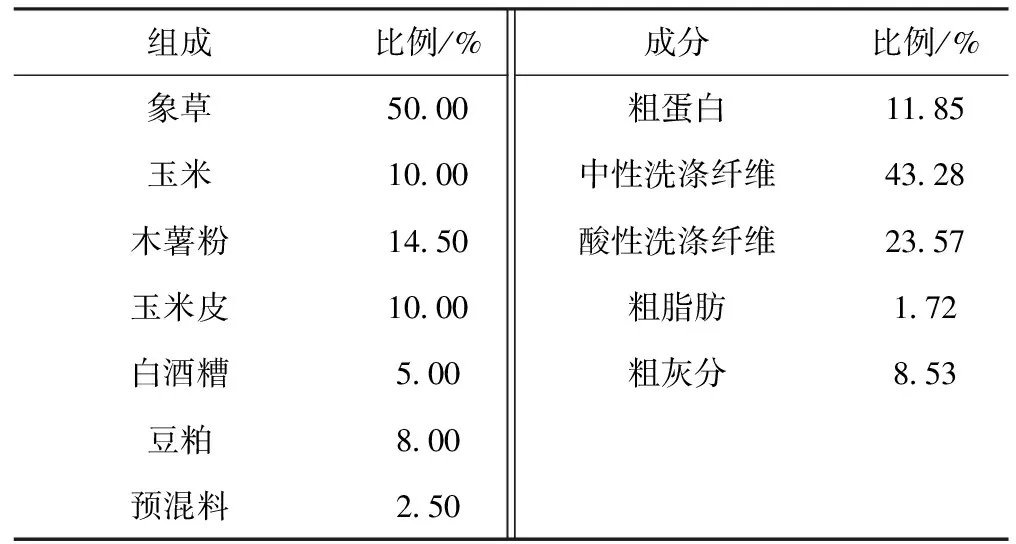
表1 日粮组成及营养成分(干物质基础)
1.3 样品的采集
在采样期最后1 d晨饲前,用瘤胃导管经口腔采集水公牛和荷斯坦奶公牛的瘤胃液,用4层纱布过滤后分装保存,测定瘤胃发酵参数。
试验期间每天记录两组牛饲料的饲喂量及剩料量,根据采食量及饲料中养分含量计算日均养分摄入量。试验结束前连续4 d,采用点收粪法每天收集粪样,混合均匀,按照粪样重的10%加入10%的硫酸固氮混合均匀后65 ℃烘干后粉碎,过40目筛,之后放入自封袋保存,每个自封袋上标注有该头牛的编号。
采集试验牛的血液,测定相关血液生化指标。在试验最后1 d晨饲前用一次性真空采血管对试验牛进行颈静脉采血,各采10 mL,血样静置后3 000 r/min离心15 min,用移液枪移取1 mL血清转移至新的离心管,并在-20 ℃冰箱保存待测。
1.4 指标测定
1.4.1 测定瘤胃发酵参数
获得瘤胃滤液后立即在常温条件下测定不同试验牛瘤胃液pH值,剩余内容物于-20 ℃保存。氨态氮浓度参照Chaney和Marbach[11]的方法,以氯化铵为标准品,用比色法测定;挥发性脂肪酸浓度参考申军士等[12]的气相色谱法测定。
1.4.2 测定养分表观消化率
采用2 mol/L盐酸不溶灰分(AIA)作为内源指示剂测定日粮营养物质表观消化率,测定方法参见GB/T 23742—2009《饲料中盐酸不溶灰分的测定》。采用GB/T 6435—2014《饲料中水分的测定》测定水分,计算干物质含量;根据张丽英[13]的试验方法,测量粗蛋白的含量;采用Van Soest[14]的滤纸袋法测定中性洗涤纤维和酸性洗涤纤维;采用GB/T 6433—2006《饲料中粗脂肪的测定》测定粗脂肪含量。根据饲粮和粪样中AIA含量计算饲料养分表观消化率,公式如下:
1.4.3 测定血液生化指标
血样采用全自动生化分析仪测定,测定指标包括:丙氨酸氨基转移酶、天冬氨酸氨基转移酶、总蛋白、白蛋白、球蛋白、白蛋白/球蛋白、碱性磷酸酶、γ-谷氨酰基转移酶、尿素、血糖、总胆固醇、甘油三酯。
1.5 数据统计与分析
测定的数据先用Excel 2010做成表格,然后再用IBM SPSS Statistics 22对试验数据进行组间差异显著性分析。P<0.01表示差异极显著,P<0.05表示差异显著,0.05≤P<0.10表示有差异显著的趋势。
2 结果与分析
2.1 瘤胃发酵参数
由表2可知,水公牛组瘤胃pH值显著高于荷斯坦奶公牛组(P<0.05),而瘤胃总挥发性脂肪酸、乙酸、丁酸、异戊酸和戊酸浓度显著低于荷斯坦奶公牛组(P<0.05)。两组牛瘤胃液氨态氮、丙酸和异丁酸浓度无显著差异(P>0.05)。
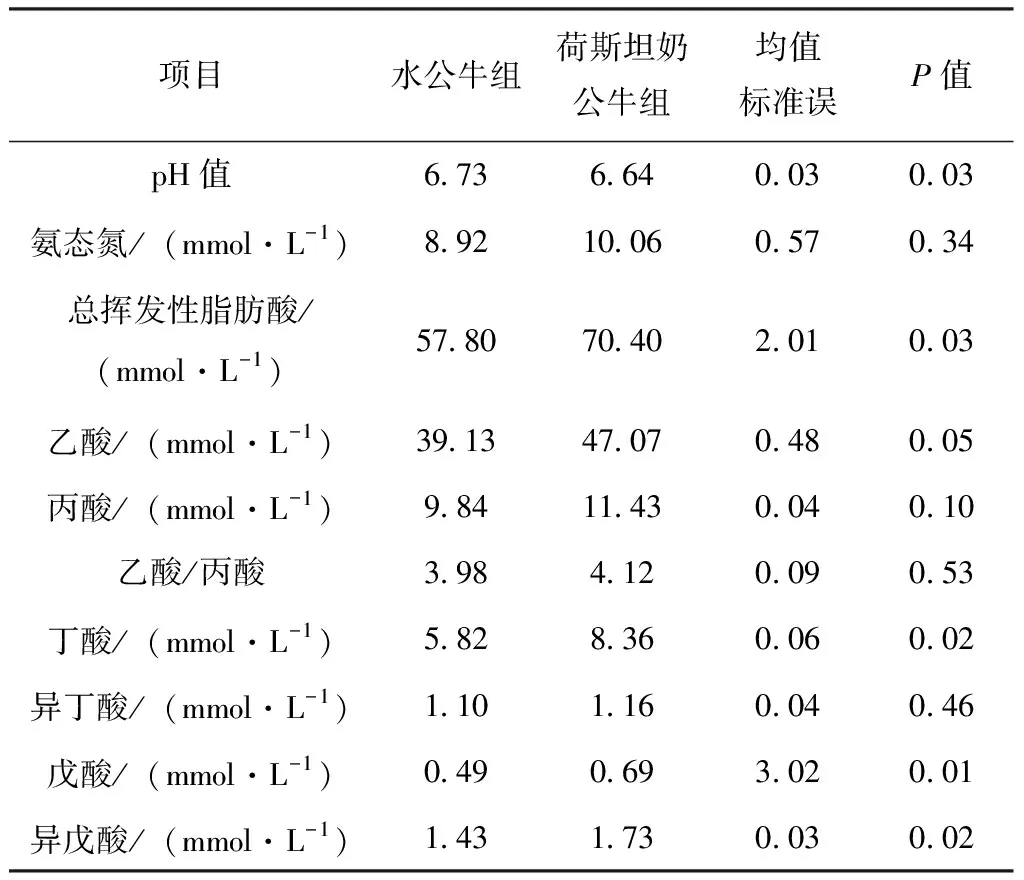
表2 水公牛和荷斯坦奶公牛瘤胃发酵参数
2.2 日粮养分摄入量与表观消化率
由表3可知,荷斯坦奶公牛对饲粮中干物质、有机物、粗蛋白、中性洗涤纤维、酸性洗涤纤维、粗脂肪的养分摄入量都极显著高于水公牛(P<0.01)。在表观消化率方面,水公牛粗蛋白表观消化率显著高于荷斯坦奶公牛(P<0.05),粗脂肪表观消化率有高于荷斯坦奶公牛的趋势(P=0.057),但两组牛干物质、有机物、中性洗涤纤维、酸性洗涤纤维的表观消化率并无显著差异(P>0.05)。

表3 水公牛和荷斯坦奶公牛养分摄入量及全肠道表观消化率
2.3 血液生化指标
由表4可知,水公牛组血液中丙氨酸氨基转移酶、天冬氨酸氨基转移酶、白蛋白、碱性磷酸酶、尿素、甘油三酯浓度和白蛋白/球蛋白均极显著高于荷斯坦奶公牛组(P<0.01);而水公牛组血样中总蛋白、球蛋白、总胆固醇浓度均极显著低于荷斯坦奶公牛组(P<0.01);两组牛血样中γ-谷氨酰基转移酶、血糖浓度差异不显著(P>0.05)。

表4 水公牛组与荷斯坦奶公牛组血液生化指标
3 讨论
3.1 水公牛和荷斯坦奶公牛瘤胃发酵参数比较
瘤胃作为反刍动物特有的消化器官,其内环境的稳态对反刍动物的健康至关重要。瘤胃pH值是衡量瘤胃内环境稳定和反映瘤胃发酵状况的重要指标[15],而瘤胃pH值与采食量、瘤胃中挥发性脂肪酸等因素密切相关[16]。本试验中,与水公牛相比,荷斯坦奶公牛的采食量升高,使其瘤胃中的可发酵碳水化合物增加。更多的发酵活动增加了瘤胃中挥发性脂肪酸的产生和积累[17],这也是荷斯坦奶公牛的瘤胃pH值有所下降的原因之一。此结果与王其炎[10]的研究结果不一致,可能是因为试验用牛生理阶段及日粮组成不同所致。氨态氮是饲粮蛋白质在瘤胃中降解的产物,也是微生物合成微生物蛋白的重要氮源,在一定程度上可以反映瘤胃对含氮物质降解、利用及排出之间所达到的平衡状况[18]。乙酸和丁酸是反刍动物的主要供能物质,通常与机体能量代谢密切相关。瘤胃中乙酸和丁酸含量的增加不仅可以改变瘤胃的发酵模式,用于脂肪酸合成,还能提高反刍动物的能量代谢效率,降低能量损失[19-21]。荷斯坦奶牛的乙酸和丁酸含量显著更高,暗示荷斯坦奶牛的增重潜力高于水公牛。
3.2 水公牛和荷斯坦奶公牛日粮养分摄入及表观消化率比较
反刍动物采食量受年龄、饲料成分及特性等多种因素的影响。在本试验日粮条件下,荷斯坦奶公牛组的养分摄入量显著高于水公牛组,这可能是受到试验条件的限制,没有考虑到两组牛的生理阶段,荷斯坦奶公牛组处于12月龄,而水牛组处于15月龄,荷斯坦奶公牛处于快速生长发育的阶段,因此需要更高的采食量以满足较快的生长发育速度和机体正常的运行。此外,薛白等[22]的研究也表明,荷斯坦奶牛干物质采食量与日粮精粗比成正比,而作为长期役用的水牛,则可能更喜食纤维含量高的饲粮。日粮养分表观消化率能够反映饲料中营养成分被动物机体消化利用的程度,也受多种因素的影响,如日粮成分、瘤胃内微生物种类及动物品种等[23]。本试验表明两组牛在相同饲粮的饲喂条件下,除粗蛋白、粗脂肪外,其余物质的表观消化率两组牛并无显著差异。利用采食量和表观消化率进行计算,可以得到在较高精粗比的日粮条件下,荷斯坦奶公牛对于干物质、有机物、粗蛋白、中性洗涤纤维、酸性洗涤纤维、粗脂肪这些营养物质的消化量大于水公牛。荷斯坦牛环境适应力差,皮毛更薄,需要更多的能量进行维持需要,可能是造成此结果的原因之一[24]。
在瘤胃内,可降解粗蛋白会被微生物蛋白酶降解成氨,一部分用于合成菌体蛋白,一部分则被瘤胃吸收[25]。水公牛粗蛋白的消化率显著高于荷斯坦奶公牛,可能是由于水牛瘤胃内的蛋白分解菌——反刍兽新月牙形单胞菌数量多于奶牛[26],使其能更高效地消化降解粗蛋白。水公牛粗脂肪消化率有高于荷斯坦奶公牛的趋势,可能由于水公牛组厚壁菌与拟杆菌的比值较荷斯坦牛更高[10],其高比值更有利于脂肪的消化累积[27-28]。另外,二酰基甘油酰基转移酶(DGAT)是脂肪合成过程中的重要酶,其类型之一的DGAT1对肠脂肪吸收、脂蛋白集合等过程中发挥重要作用,研究表明[29]水牛血清中DGAT1的活性显著高于荷斯坦奶牛,这与水公牛粗脂肪消化率高也有一定的联系。Shakarami等[30]研究表明水牛瘤胃总微生物体外纤维消化活性高于荷斯坦奶牛,更耐粗饲,但是Puppo等人[9]的研究发现在同样饲喂精粗比50∶50的饲粮时,水牛瘤胃微生物数量多于荷斯坦牛,其对于干物质和纤维素的消化率却不如荷斯坦牛,与本研究结果不一致,可能是由于日粮组成及试验用牛生理阶段差异所致。
3.3 水公牛和荷斯坦奶公牛血液生化指标比较
血液生化指标能直接反映动物机体的生命活动和健康状况。丙氨酸氨基转移酶和天冬氨酸氨基转移酶是动物体内最重要的两种转氨酶,通常在血液中低水平存在,其含量的高低能在一定程度上反映出动物的健康状况[31]。水公牛组谷丙转氨酶、谷草转氨酶含量显著比荷斯坦奶公牛组高,说明在本试验条件下,荷斯坦奶公牛组肝脏状态可能较水公牛组更好,这种差异也可能来自于品种不同。血液中白蛋白、球蛋白、白蛋白/球蛋白的含量则与动物体内的各种免疫密切相关[32],球蛋白含量能反映机体免疫能力和蛋白质代谢能力的强弱,球蛋白含量升高,说明蛋白质代谢能力加强,免疫力得到提高,白蛋白/球蛋白升高说明球蛋白数量下降而降低机体免疫机能,反之则提高免疫系统机能[33]。本试验两组牛,均处于良好健康状态下,白蛋白、球蛋白、白蛋白/球蛋白的含量显著差异,可能由于牛品种本身的影响,也有可能是在相同饲养条件下,荷斯坦奶公牛组的免疫能力稍强于水公牛组。血液中总蛋白能反映动物机体蛋白质代谢情况,总蛋白与动物日粮蛋白质摄入量和内源蛋白质分解代谢有关[34]。本试验中荷斯坦奶公牛对粗蛋白的摄入和消化的量均高于水公牛,血液中总蛋白含量也高于水公牛。尿素则在一定程度上反映出动物体内氮能源物质的沉积与利用[35],动物机体氨基酸平衡时,血液中尿素含量会降低,此时动物体内蛋白质的分解也下降,但对蛋白质的合成和利用更好[36]。结合两组试验牛瘤胃的氨态氮浓度,根据Puppo等[9]的研究,牛瘤胃中氨氮浓度高,氨态氮会被运送到肝脏,导致血氨浓度上升,也会使血液中尿素含量上升。通过对两组试验牛总蛋白和尿素指标的对比,可以分析出荷斯坦奶公牛体内蛋白质含量处于更加平衡的状态。此外,荷斯坦奶公牛组血液中总胆固醇含量高于水公牛组,根据崔秋佳等[37]的研究,说明与水公牛相比,饲料能量在荷斯坦奶公牛体内经过转化后剩余更多,多余的能量转化为脂肪储存起来,脂肪分解导致胆固醇含量增加。
4 结论
在本试验条件下,荷斯坦奶公牛养分摄入量以及瘤胃乙酸、丁酸等挥发性脂肪酸产量大于水公牛,具有较好的增重潜力。若进一步深入研究水公牛和荷斯坦奶公牛瘤胃发酵能力的差异原因,可从水公牛和荷斯坦奶公牛瘤胃微生物菌系方面探究。

