荧光PCR 熔解曲线法在耐多药结核病诊治中的应用及分析
秦 万 王明栋 欧维正 徐 勇
耐多药结核病(multi-drug resistant tuberculosis,MDR-TB)是指同时耐异烟肼和利福平两种以上抗结核药物的结核分枝杆菌引起的结核病[1],其防治已成为结核病防控的重点和难点之一,并引起有关结核防控专家的高度重视。WHO 于2020 年发布的《全球结核病报告》显示,2019 年全球范围内估计有1 000 万例新发结核病患者,约3.3% (46.5 万例)的初治患者和18%的复治患者对利福平耐药,其中MDR-TB 患者约占78%,为 36.3 万例[2]。MDR-TB 患者的治疗时间长达2 年,治疗药品由多种二线抗结核药品组成,副作用强,但治疗成功率仅为54.0%[3-4]。
及时对结核病患者进行药物敏感性试验检测(简称“药敏检测”)能够及早发现耐药,并提高MDR-TB 患者的治疗成功率[5]。目前的药敏检测方案除了“金标准”表型药物敏感性试验(简称“表型药敏”)外,临床中用得较多的便是对耐药基因进行检测的分子生物学试验,该技术在检测时间上比表型药敏更短,可在4~6小时内完成检测并报告结果,为患者及时诊断和制定有效的治疗方案带来了极大的便捷。本研究对新引进的结核分枝杆菌耐药基因检测的PCR 荧光熔解曲线法(简称“熔解曲线法”)在贵阳市的开展情况进行探讨,以期为MDR-TB 的诊断及全新治疗方案的调整提供科学依据。
1 材料与方法
1.1 标本来源与药敏检测 标本来源:收集2021 年1~7 月贵阳市公共卫生救治中心门诊和住院结核患者经罗氏培养为阳性的84 种菌株。使用微孔板药敏检测法(以下简称“微孔板法”)检测上述菌株对RFP、INH、EMB、FQs[包括左氧氟沙星(Lfx)和莫西沙星(Mfx)]的耐药性。参考试剂盒说明书,将待测菌株的菌液稀释到1.5~2.0 麦氏单位后加入液体培养基中,混匀后加样至微孔板中,最后将微孔板放入37℃培养箱中,分别在第7 天、第10 天和第12 天进行结果判读。表型药敏试验符合结核病诊断实验室检验规程[6]。同时微孔板检测的Lfx 和Mfx 作为氟喹诺酮参照药物,两种药物中只要一种药物耐药便可判为氟喹诺酮耐药;微孔板药敏试验为中敏的均按敏感处理;RFP 与INH 组合表示微孔板检测的47 株MDR-TB 中熔解曲线检测的耐药菌株和敏感菌株数。
1.2 微孔板表型药敏法示意图 微孔板药敏测试板提供不同种类及浓度的药物,具体药物浓度见图1。最低抑菌浓度(minimum inhibitory concentration ,MIC)判读:药物浓度单位为μg/mL;当阳性对照孔A2、B2 为阳性时进行结果判读,记录每个药物的MIC 值,MIC 值为无白色沉淀的最低药物浓度孔。将MIC 值记录在结果记录纸上。耐药(drug resistant,R),又称抗药性,耐药性一旦产生,药物的化疗作用就明显下降;敏感(sensitive,S)指某种致病菌对于抗生素的敏感,即应用常规剂量的抗生素就能把致病菌给抑制或者杀死掉。见图1。
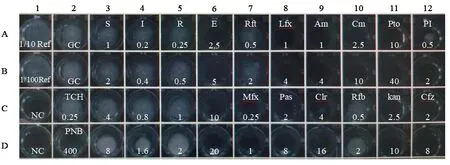
图1 微孔板示意图
1.3 核酸提取 在1.5 mL 离心管中加入500 μL TBDNA 提取液,然后用接种环在罗氏培养基上刮取一小环疑似结核菌株放入上述离心管中,充分振荡后进行灭菌处理(95℃恒温金属浴15 min)。随后,将菌悬液加入核酸自动纯化试剂条的加样孔中,并通过Lab-Aid® 824s 核酸自动提取仪进行核酸提取。最后,将纯化的核酸一次性全部转入1.5 mL 离心管中(大约130 μL)备用。
1.4 荧光PCR 熔解曲线法检测 使用熔解曲线法分别进行RFP、INH、EMB 和FQs 耐药突变检测,严格按照试剂盒说明书操作。溶解曲线检测结果见图2。
1.5 测序验证 对微孔板法和熔解曲线法检测结果不一致的标本进行Sanger 测序(一代)验证,验证区域:利福平rpoB 基因 507~533 共27 个氨基酸密码子区域内(81 bp,利福平耐药决定区);异烟肼ahpC 启动子区(-44~-30 以及-15~3 位点)、inhA 启动子区(-17~-8 位点)、inhA94 密码子和katG315 密码子;乙胺丁醇embB 基因306 位、406 位、497 位密码子;氟喹诺酮gyrA 基因88~94 位密码子(图3);测序引物序列见表1。

表1 测序引物
图3 测序验证图
1.6 试剂与仪器 试剂:分枝杆菌药敏检测试剂盒(培养法)由珠海银科医学提供。结核分枝杆菌利福平、异烟肼、乙胺丁醇和氟喹诺酮耐药突变检测试剂盒(荧光PCR 熔解曲线法)由厦门致善提供。仪器:细菌超声分散计数仪、自动读器仪由广东体必康提供;YK-909 分枝杆菌微孔板药敏判读仪、YK-96 小型全自动移液平台仪均由珠海银科医学提供;Lab-Aid® 824s核酸提取仪、SLAN-96S 全自动PCR 仪由厦门致善提供。
1.7 质量控制
1.7.1 微孔板药敏 本试剂盒对标准减毒株H37Rv(ATCC25277)的检测结果应为阳性,接种到药敏孔经培养后应完全受抑制,药敏测定结果为敏感;对阴性质控品的检测结果应为阴性。
1.7.2 熔解曲线法 应严格按照基因扩增检验的要求进行,耗材使用一次性物品,严格划分区域操作等措施,避免交叉污染;每次试验应设置阴阳性对照,只有当阴阳性对照结果正常方可分析出据报告,否则重复实验。
1.8 统计学方法 采用Epidata 3.1 软件进行数据录入;采用SPSS 21.0 软件对数据进行统计分析;以微孔板法为标准,计算熔解曲线法对RFP、INH、EMB 和FQs 4 种药品的药敏检测符合率、灵敏度、特异度、阳性预测值、阴性预测值和Kappa 值,其中Kappa 值在0.00~0.20 为极低一致性,0.21~0.40 为一般一致性,0.41~0.60 为中等一致性,0.61~0.80 为高度一致性,0.81~1.00 为几乎一致性[7-9]。
2 结果
本研究共纳入47 株MDR-TB 菌株和37 株对照菌株(微孔板药敏检测为全敏感菌株作为对照菌株)。以微孔板法为标准,熔解曲线法对RFP、INH、EMB、FQs的符合率、灵敏度、特异度、阳性预测值、阴性预测值和Kappa 值见表2。两种检测方法不一致的样本经Sanger 测序验证,测序结果均与熔解曲线法的检测结果一致。见表3。
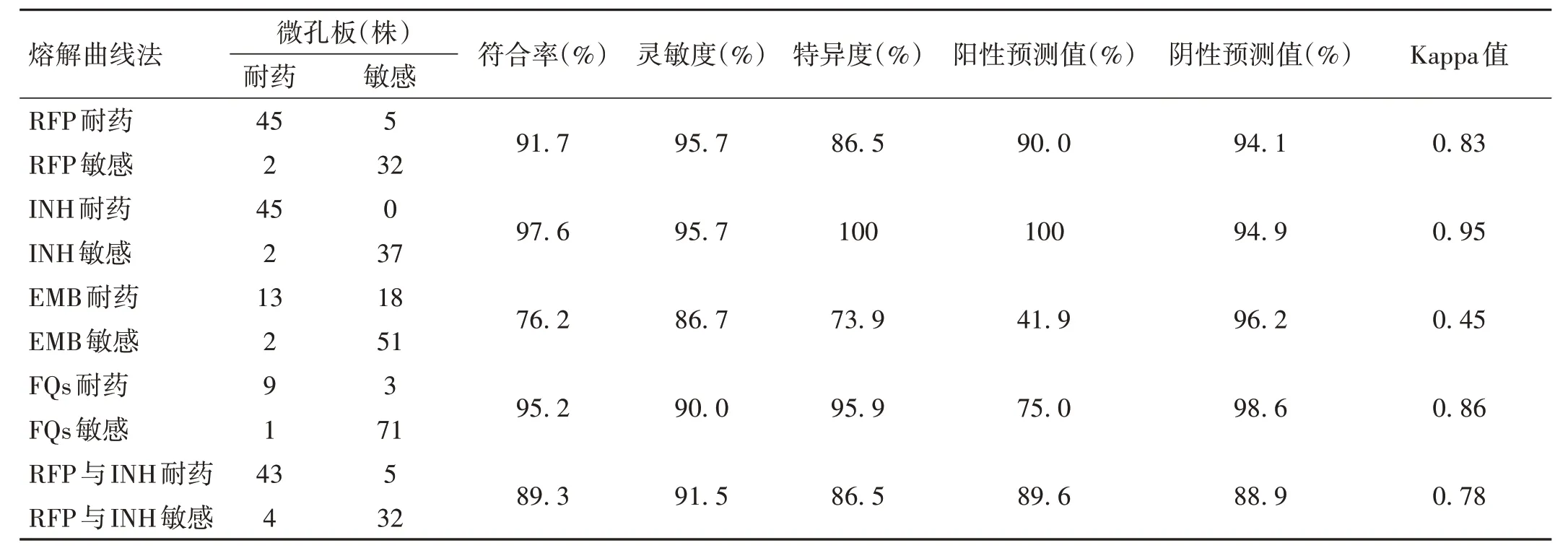
表2 以微孔板法为标准评价熔解曲线法对4种药品耐药性检测的价值
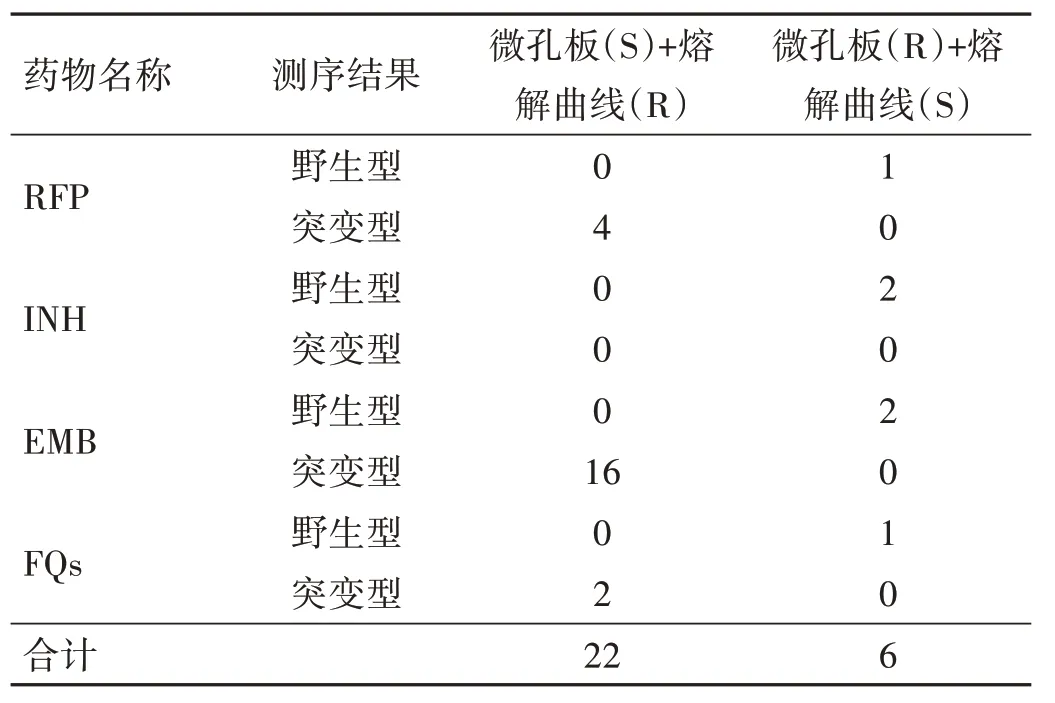
表3 两种药敏试验不一致的结果与测序结果对比分析(株)
3 讨论
导致耐药性出现和迅速蔓延的一个重要因素是缺乏快速诊断,因此,快速诊断耐药结核病获得菌株耐药信息是控制结核病传播和治疗的关键[10]。用药前对患者进行结核分枝杆菌的药敏检测是制定耐药结核病治疗方案的重要依据。目前,罗氏比例法和MGIT960 表型药敏试验仍是WHO 推荐的方法,但总体来说存在操作繁琐且耗时长的缺点,无法及时获得药敏结果来指导患者用药。随着结核分枝杆菌分子耐药机制的深入研究,利用基因型方法快速检测结核分枝杆菌的耐药性在临床逐渐得到广泛应用。荧光PCR 熔解曲线法是国内近期研发的一种新型检测技术,目前已普遍用于国内各结核病传染医院及结核预防控制机构,并获得业内认可。该技术的优点是把扩增和检测两步骤合一,对多种一线及二线抗结核药物进行耐药检测,具有实时扩增实时检测、高效、快捷、简便、经济等优点,可以对结核分枝杆菌耐药相关的多个基因同时检测,特别适用于大批量筛查[11-14]。本研究显示,荧光PCR 熔解曲线法对4 种抗结核药品耐药性检测的灵敏度和特异性除乙胺丁醇外均在89% 以上,Kappa 值除乙胺丁醇外均≥0.78,说明这两种方法检测具有较高一致性。同时对检测中结果不一致的用一代Sanger 测序验证均与溶解性曲线法吻合,这也证明了该技术的可靠性。
化学疗法仍然是结核病最重要的治疗手段[15]。RFP 和INH 为治疗结核病最重要的两种药物,对这两种药物进行及时的药敏检测有利于MDR-TB 患者早期发现。本次研究中有5 株RFP 药敏结果差异,经Sanger 测序rpoB 基因有4 株相关基因位点突变,与溶解曲线结果一致,1 株溶解曲线敏感、微孔板法耐药,经测序未检测出rpoB 基因突变位点;2 株INH 溶解曲线法敏感、微孔板法耐药的菌株经Sanger 测序相关katG 、inhA 、ahpC 基因位点未检出突变;EMB 为另一种治疗结核病的一线药物,但其体外药敏试验可靠性差,需要更加准确、稳定的药敏检测方案为用药提供指导。而本次研究中就有19 株EMB 药敏结果差异,经Sanger 测序相关embB 基因306 位、406 位、497 位有17 株突变,均与溶解曲线法结果一致;2 株EMB 微孔板耐药、溶解曲线敏感的菌株经测序embB 基因未检出突变;WHO 于2018 年制定的《耐多药和耐利福平结核病治疗指南》更新版中将氟喹诺酮(Lfx 和Mfx)作为A类核心药物[16],同时Mfx 在治疗广泛耐药结核病(XDR-TB)时不仅作为首选药物,还需要全程使用[17],由此可见FQs 在耐药结核病治疗中的重要地位。本研究中发现4 株FQs 结果差异,3 株溶解曲线耐药、微孔板法敏感,测序gyrA 基因88~94 位密码子结果均与溶解曲线结果一致;1 株微孔板耐药、溶解曲线敏感,测序gyrA 基因未发现突变位点。本研究结果显示,荧光PCR 熔解曲线法对以上4 种抗结核药品耐药性检测的灵敏度均较高,显示该技术对4 种药品的MTB 耐药相关基因位点覆盖率较高。
据有关文献报道,在临床应用中基因型耐药检测与表型耐药检测存在不一致[18-19],故本研究的主要设想就是利用微孔板法检测三种常用的一线抗痨药物和二线氟喹诺酮类药物并与熔解曲线法进行对比,评估在高发病率、高耐药结核病地区开展该新技术的必要性或重要性。从本研究结果中可以看出,熔解曲线法与微孔板法对MDR-TB、RFP、INH 和FQs 检测结果的一致性较高,而对EMB 则显示出中等一致性。对28份两种检测方法结果不一致的标本使用测序方法予以验证。由本研究结果中可知,尽管两种药敏方法检测结果有差异,但熔解曲线法结果与核酸测序结果完全一致,说明该方法在方法学角度上具有高度的准确性。而分子生物学检测方法与表型药敏检测结果不一致的情况可能有以下原因:①熔解曲线法和Sanger 测序都仅对特定的已知耐药突变区域进行检测,若耐药突变发生在检测区域之外,或由其他耐药机制导致(如药物外排泵),则有可能出现分子生物学检测为敏感而表型结果为耐药的情况;②部分耐药突变仅导致低水平耐药,如rpoB511 和533 密码子突变,其耐药水平小于等于培养基的含药浓度,则有可能出现分子生物学结果为耐药而表型结果为敏感的情况[20];③有关文献报道,表型药敏试验本身存在不稳定性,可能导致不一致结果的出现[21]。
综上所述,分子生物学的耐药性检测由于具有检测的药物种类多且全面、检测报告时间短的优点日益受到广大临床医师和医疗科研工作者的青睐。而溶解曲线法目前正符合此要求,不但在诊断性能方面,与“金标准”比例法具有高度的一致性外,还与测序法具有高度的吻合性。尽管如此,但对部分耐药靶点检测结果与表型药敏试验结果存在不一致,且其能够检测的基因位点有限。因此,可以将两种检测方法综合运用于结核病诊疗中,优势互补[22]。

