肉桂醛调节Shh/Gli1 信号通路对幽门螺旋杆菌胃炎大鼠胃黏膜损伤的影响
黄 方 黄莉璇 吴 彬 李名福 卢长江
幽门螺旋杆菌(Helicobacter pylori,Hp)是一种革兰氏阴性菌,Hp 感染是胃炎的主要原因[1]。Hp 定植在胃黏膜中诱导显著的炎症反应,导致慢性感染和胃黏膜组织的持续损伤[2]。目前,包括甲硝唑、四环素和其他药物在内的三联和四联疗法对90% 以上的患者有效[3-4]。然而,这种抗生素药物联合治疗Hp 感染可能会引起严重的副作用,如腹泻和恶心,并且Hp 经常对药物产生耐受性[5]。因此,亟待需要治疗Hp 诱发胃炎的新药物。肉桂醛是肉桂精油的主要成分,具有显著的抗炎特性[6]。据报道,肉桂醛对Hp 诱导的胃部炎症具有抑制作用[7],但具体机制尚不完全明确。研究显示,抑制音猬因子(sonic hedgehog,Shh)/Gli 家族锌指蛋白1( Gli family zinc finger protein 1,Gli1)通路可减轻慢性萎缩性胃炎大鼠胃黏膜损伤[8]。本研究主要探究肉桂醛对Hp 诱导的胃炎大鼠胃黏膜损伤的影响及其作用机制。
1 材料与方法
1.1 动物及细胞来源 6 周龄,体质量为200~210 g的140 只SPF 级雄性SD 大鼠,购自上海泰楚生物技术有限公司,生产许可证号为SCXK(沪)2023-0001。所有动物实验程序均获得本院实验动物管理委员会的批准。人胃黏膜细胞GES-1 购自通派(上海)生物科技有限公司。
1.2 主要试剂 肉桂醛购自上海远慕生物科技有限公司;Hp 菌株购自美国ATCC 公司;替普瑞酮购自卫材(中国)药业有限公司;Shh 激活剂 Purmorphamine(PUR)购自上海源叶生物科技有限公司;大鼠Hp IgG酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(货号E-EL-R0487)购自上海恪敏生物科技有限公司;大鼠白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒购自上海臻科生物科技有限公司;兔源一抗Shh、Gli1、甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)及辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔二抗均购自英国Abcam 公司。
1.3 方法
1.3.1 动物分组、模型构建及给药 将从140 只大鼠中按照随机数字表法随机选取18 只为对照组(n=18),剩余大鼠为造模组(n=122)。造模组大鼠采用灌胃1 mL Hp(用生理盐水将Hp 调节至1.5×108CFU/mL)构建胃炎大鼠模型,每隔1 d 灌胃1 次,持续8 周[9]。建模末次处理24 h 后,若大鼠的胃黏膜组织出现病理损伤且血清含有Hp IgG 抗体,则表明造模成功[血清Hp IgG 抗体检测:使用毛细管从大鼠眼眶静脉丛采血,离心(3 000 r/min,10 min)分离血清,使用大鼠Hp IgG ELISA 试剂盒检测血清Hp IgG 抗体水平];对照组大鼠以灌胃等量生理盐水代替Hp,其他同造模过程。造模过程中造模组有3 只大鼠死亡,10 只大鼠造模失败,共109 只大鼠造模成功,模型成功率为89.34%。取108只造模成功的大鼠按照随机数字表法分为模型组、肉桂醛低剂量组、肉桂醛中剂量组、肉桂醛高剂量组、替普瑞酮组、肉桂醛高剂量+PUR 组,每组18 只。开始给药处理,肉桂醛低剂量组、肉桂醛中剂量组、肉桂醛高剂量组[10]、替普瑞酮组[11]大鼠分别需灌胃12.5 mg/kg肉桂醛、25 mg/kg 肉桂醛、50 mg/kg 肉桂醛、0.13 g/kg替普瑞酮,且均需腹腔注射等体积的生理盐水;肉桂醛高剂量+PUR 组[12]大鼠需灌胃50 mg/kg 肉桂醛且还需腹腔注射6.67 mg/kg PUR;对照组、模型组大鼠均需灌胃且腹腔注射等体积的生理盐水。每天给药1 次,持续2 周。
1.3.2 标本收集 末次处理24 h 后,每组选取全部大鼠,2% 戊巴比妥钠麻醉并处死大鼠,沿胃大弯剪开胃组织,将大鼠的胃黏膜组织均分为3 部分,每部分包含6 只大鼠的胃黏膜组织,一部分固定于4%多聚甲醛中用于HE 染色,一部分固定于电镜固定液用于透射电镜观察,最后一部分冻存于-80℃冰箱用于ELISA、Western blot 实验。
1.3.3 HE 染色检测大鼠胃黏膜组织病理变化 将固定于4%多聚甲醛中胃黏膜组织进行脱水、透明、石蜡包埋后,切成5 μm 厚的胃黏膜组织石蜡切片。进行HE 染色以检测胃黏膜组织的病理损伤。用光学显微镜观察结果。
1.3.4 透射电镜观察大鼠胃黏膜细胞形态 将用电镜固定液固定4 h 的胃黏膜组织用磷酸盐缓冲液洗涤3 次后,加入1% 锇酸固定2 h,酒精脱水,丙酮和812包埋剂进行渗透处理,60℃烤箱聚合48 h,超薄切片机切成80 nm 超薄切片,对切片进行铀铅双染色,室温干燥后,利用透射电镜观察大鼠胃黏膜细胞形态。
1.3.5 细胞培养及分组 将GES-1 细胞置于RPMI1640 培养基中培养。取对数生长期的GES-1 细胞,分为vitro-对照组、vitro-模型组、vitro-肉桂醛低剂量组、vitro-肉桂醛中剂量组、vitro-肉桂醛高剂量组、vitro-替普瑞酮组、vitro-肉桂醛高剂量+PUR 组。除vitro-对照组外,其他组GES-1 细胞均需被Hp 感染,具体感染过程:将Hp 用RPMI1640 培养基稀释成混悬液,浓度为1.0×107CFU/mL,以100∶1 的感染倍数感染GES-1 细胞24 h[13]。感染结束后,进行给药处理,vitro-肉桂醛低剂量组、vitro-肉桂醛中剂量组、vitro-肉桂醛高剂量组[14]、vitro-替普瑞酮组[15]GES-1 细胞分别用5 μmol/L 肉桂醛、10 μmol/L 肉桂醛、20 μmol/L 肉桂醛、1 μmol/L 替普瑞酮处理24 h;vitro-肉桂醛高剂量+PUR组[16]GES-1 细胞用20 μmol/L 肉桂醛和1 μmol/L PUR共同处理24 h;vitro-对照组、vitro-模型组GES-1 细胞不做任何处理。处理结束后收集各组细胞或细胞上清用于后续实验。
1.3.6 细胞计数试剂盒-8(cell counting kit-8,CCK-8)法检测GES-1 细胞增殖抑制率 调整GES-1 细胞的浓度为1×104/mL,取100 μL 细胞悬液接种于96 孔板中,按照1.3.5 分组进行对应处理后,每孔加入10 μL CCK-8 试剂孵育2 h。利用酶标仪于450 nm 波长处测定每孔的吸光度(OD 值)。并计算细胞生长抑制率,细胞生长抑制率(%)=1-(OD 药物处理组/OD 对照组)×100%。
1.3.7 ELISA 法检测大鼠胃黏膜组织及GES-1 细胞上清中IL-1β、TNF-α 水平 严格按照ELISA 试剂盒说明书检测0.1 g 大鼠胃黏膜组织及500 μL GES-1 细胞上清中IL-1β、TNF-α 水平。
1.3.8 Western blot 检测大鼠胃黏膜组织及GES-1 细胞中Shh、Gli1 蛋白表达 使用RIPA 裂解缓冲液提取0.1 g 大鼠胃黏膜组织匀浆及500 μL GES-1 细胞总蛋白质。2,2-联喹啉-4,4-二甲酸二钠法检测蛋白浓度后,取50 μg 蛋白质进行电泳、转膜、封闭后,在4°C 下将膜与一抗Shh(1∶3 000)、Gli1(1∶2 000)、GAPDH(1∶5 000)孵育过夜,再与二抗(1∶4 000)共同孵育1 h。加入ECL 试剂可视化蛋白,通过Image J 软件评估目的蛋白条带灰度值。
1.4 统计学方法 使用SPSS 29.0 软件进行统计分析,符合正态分布且方差齐性的数据以±s表示,使用单因素方差分析进行组间比较,进一步两两间的比较采用SNK-q检验。P< 0.05 为差异具有统计学意义。
2 结果
2.1 肉桂醛对各组大鼠胃黏膜组织病理变化的影响对照组大鼠胃黏膜组织结构及形态正常;模型组大鼠胃黏膜变薄,黏膜糜烂且血管明显,有大量炎性细胞浸润;与模型组比较,肉桂醛低剂量组、肉桂醛中剂量组、肉桂醛高剂量组、替普瑞酮组大鼠胃黏膜组织病理损伤有所改善;与肉桂醛高剂量组比较,肉桂醛高剂量+PUR 组大鼠胃黏膜组织病理损伤加剧。见图1。

图1 各组大鼠胃黏膜组织病理变化HE染色结果
2.2 肉桂醛对各组大鼠胃黏膜细胞形态的影响 对照组大鼠胃黏膜表面上皮细胞结构及形态正常;模型组大鼠胃黏膜表面上皮细胞固缩,细胞膜破损,细胞器肿胀且空泡化;与模型组比较,肉桂醛低剂量组、肉桂醛中剂量组、肉桂醛高剂量组、替普瑞酮组大鼠胃黏膜表面上皮细胞结构及形态有所改善;与肉桂醛高剂量组比较,肉桂醛高剂量+PUR 组大鼠胃黏膜表面上皮细胞结构及形态破环严重。见图2。

图2 透射电镜观察各组大鼠胃黏膜细胞形态
2.3 肉桂醛对各组大鼠胃黏膜组织中IL-1β、TNF-α水平的影响 与对照组比较,模型组大鼠胃黏膜组织中IL-1β、TNF-α 水平升高(P<0.05);与模型组比较,肉桂醛低剂量组、肉桂醛中剂量组、肉桂醛高剂量组、替普瑞酮组大鼠胃黏膜组织中IL-1β、TNF-α 水平降低(P<0.05);与肉桂醛高剂量组比较,肉桂醛高剂量+PUR 组大鼠胃黏膜组织中IL-1β、TNF-α 水平升高(P<0.05)。见表1。
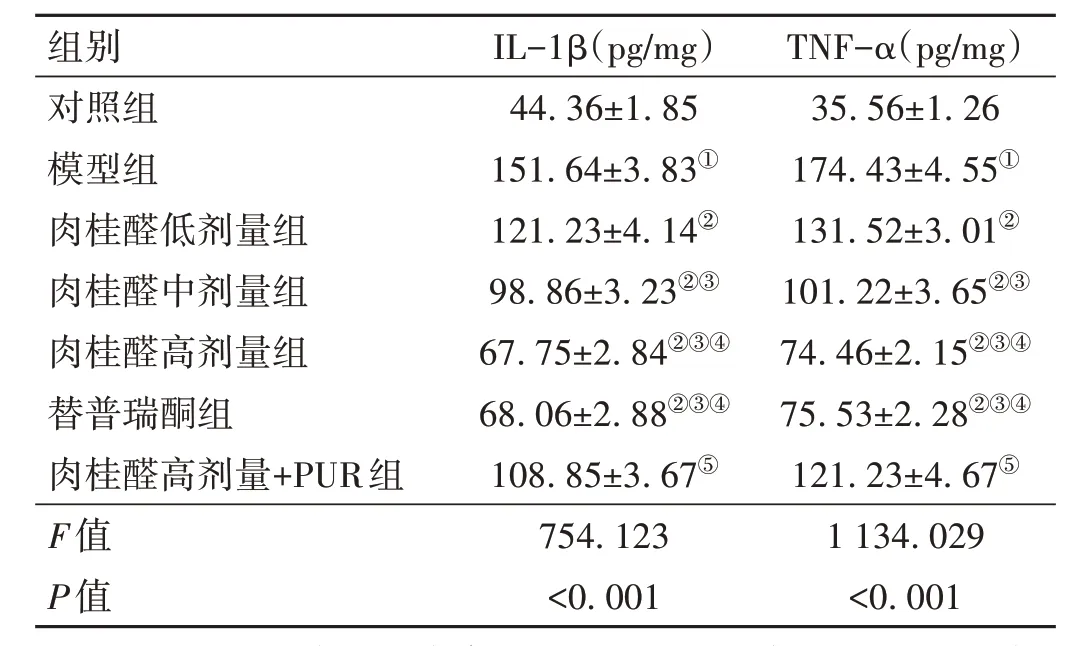
表1 各组大鼠胃黏膜组织中IL-1β、TNF-α水平变化比较(-x±s,n=6)
2.4 肉桂醛对各组大鼠胃黏膜组织中Shh/Gli1信号通路相关蛋白表达的影响 与对照组比较,模型组大鼠胃黏膜组织中Shh、Gli1 蛋白表达升高(P<0.05);与模型组比较,肉桂醛低剂量组、肉桂醛中剂量组、肉桂醛高剂量组、替普瑞酮组大鼠胃黏膜组织中Shh、Gli1 蛋白表达降低(P<0.05);与肉桂醛高剂量组比较,肉桂醛高剂量+PUR 组大鼠胃黏膜组织中Shh、Gli1 蛋白表达升高(P<0.05)。见图3、表2。
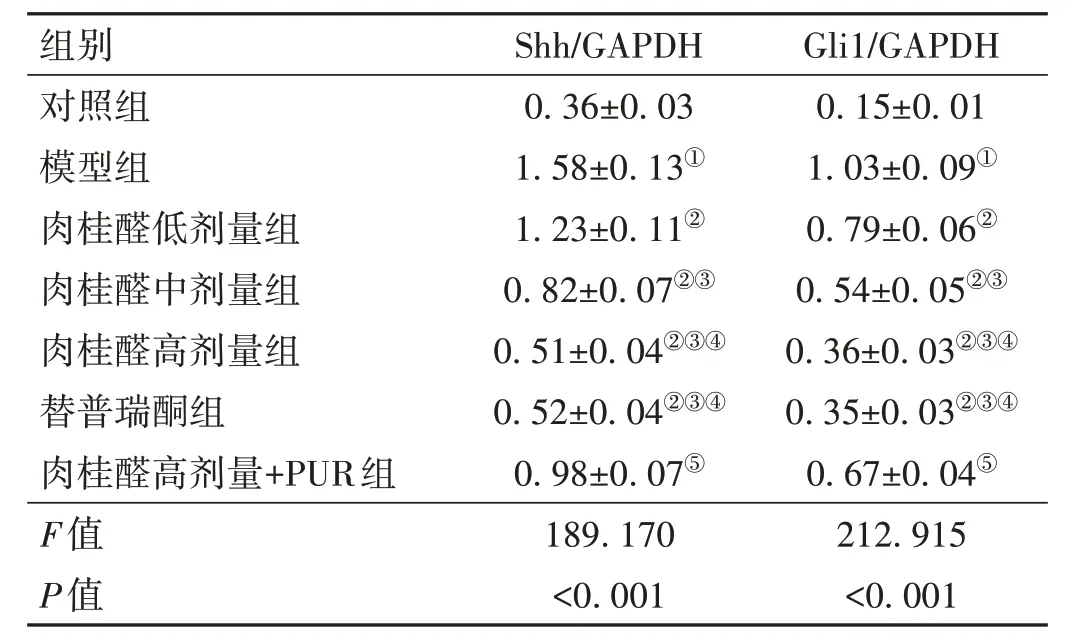
表2 各组大鼠胃黏膜组织中Shh、Gli1蛋白表达变化比较(-x±s,n=6)
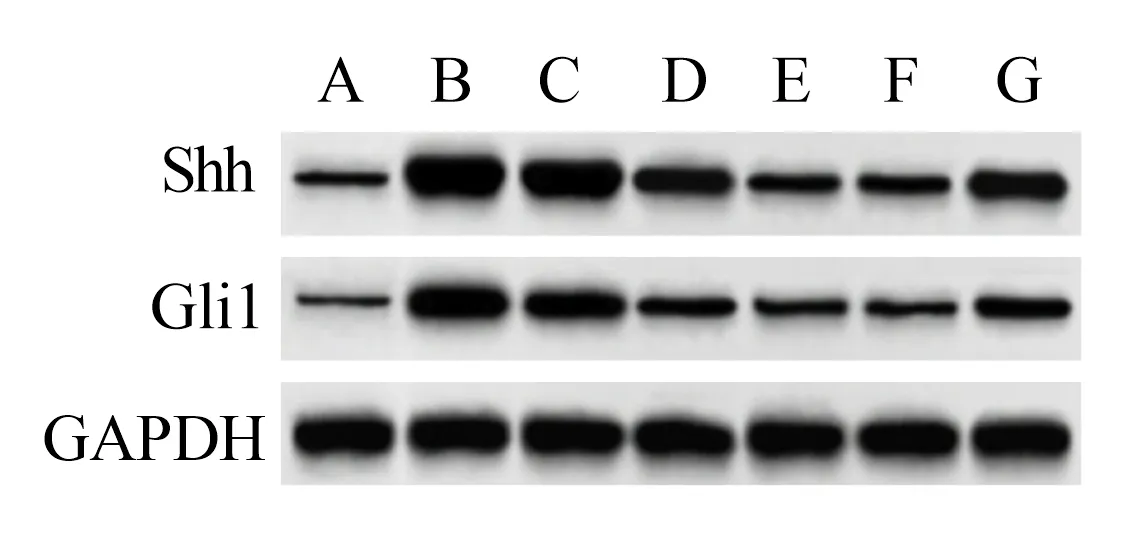
图3 大鼠胃黏膜组织中Shh、Gli1蛋白表达
2.5 肉桂醛对各组GES-1 细胞增殖抑制率的影响与vitro-对照组比较,vitro-模型组GES-1 细胞增殖抑制率升高(P<0.05);与vitro-模型组比较,vitro-肉桂醛低剂量组、vitro-肉桂醛中剂量组、vitro-肉桂醛高剂量组、vitro-替普瑞酮组GES-1 细胞增殖抑制率降低(P<0.05);与vitro-肉桂醛高剂量组比较,vitro-肉桂醛高剂量+PUR 组GES-1 细胞增殖抑制率升高(P<0.05)。见表3。
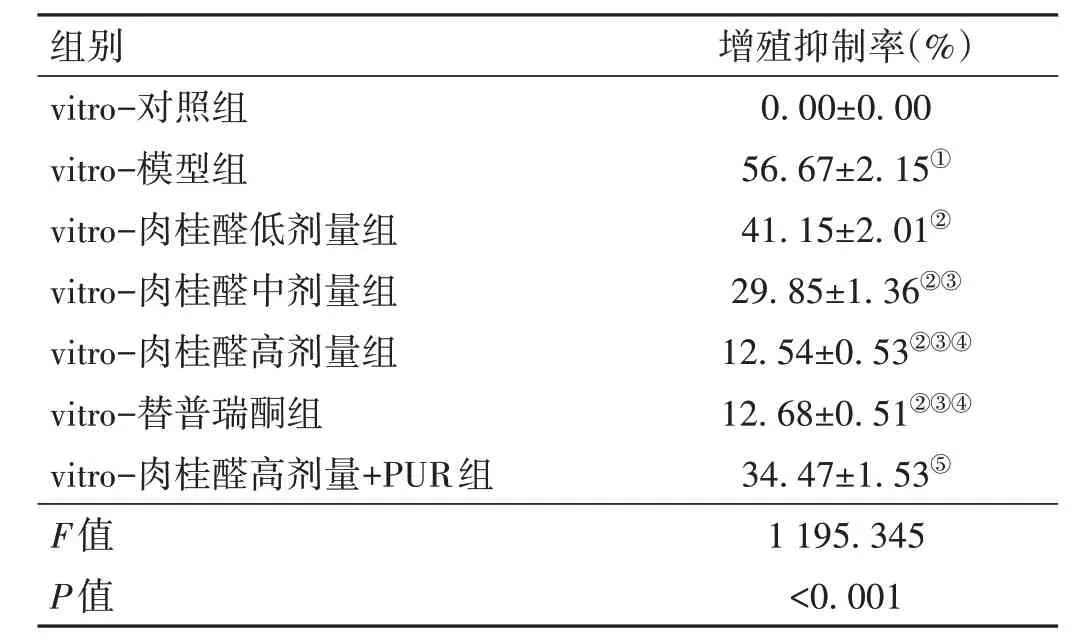
表3 各组GES-1细胞增殖抑制率变化比较(-x±s,n=6)
2.6 肉桂醛对各组GES-1 细胞上清中IL-1β、TNF-α水平的影响 与vitro-对照组比较,vitro-模型组GES-1 细胞上清中IL-1β、TNF-α 水平升高(P<0.05);与vitro-模型组比较,vitro-肉桂醛低剂量组、vitro-肉桂醛中剂量组、vitro-肉桂醛高剂量组、vitro-替普瑞酮组GES-1 细胞上清中IL-1β、TNF-α 水平降低(P<0.05);与vitro-肉桂醛高剂量组比较,vitro-肉桂醛高剂量+PUR 组GES-1 细胞上清中IL-1β、TNF-α 水平升高(P<0.05)。见表4。
2.7 肉桂醛对各组GES-1细胞中Shh/Gli1信号通路相关蛋白表达的影响 与vitro-对照组比较,vitro-模型组GES-1 细胞中Shh、Gli1 蛋白表达升高(P<0.05);与vitro-模型组比较,vitro-肉桂醛低剂量组、vitro-肉桂醛中剂量组、vitro-肉桂醛高剂量组、vitro-替普瑞酮组GES-1 细胞中Shh、Gli1 蛋白表达降低(P<0.05);与vitro-肉桂醛高剂量组比较,vitro-肉桂醛高剂量+PUR 组GES-1 细胞中Shh、Gli1 蛋白表达升高(P<0.05)。见图4、表5。

表5 各组GES-1细胞中Shh、Gli1蛋白表达变化比较(-x±s,n=6)
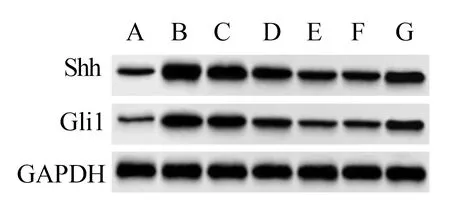
图4 各组GES-1细胞中Shh、Gli1蛋白表达
3 讨论
在Hp 感染期间,宿主产生过度的免疫反应可导致胃黏膜损伤的慢性炎症。Hp 感染引起的炎症是慢性胃炎、胃溃疡和胃癌进展的关键因素[17]。最近的一项研究显示,Hp 刺激炎性细胞因子(尤其是IL-1β 和TNF-α)过量生成,进而诱发慢性胃部炎症[18]。此外,Hp 感染可通过提高促炎细胞因子水平来促进胃黏膜损伤[19-20]。IL-1β、TNF-α 是常见的促炎细胞因子,具有加重机体炎症反应的作用[21]。本研究通过灌胃Hp的方式构建胃炎大鼠模型,结果显示,在体内动物水平上,与对照组比较,模型组大鼠胃黏膜组织中IL-1β、TNF-α 水平升高,胃黏膜表面上皮细胞固缩,细胞膜破损,细胞器肿胀且空泡化,胃黏膜组织病理损伤严重,体外实验结果显示,vitro-模型组GES-1 细胞活力低于vitro-对照组,细胞上清中IL-1β、TNF-α 水平高于vitro-对照组,表明Hp 可通过诱导炎症反应、抑制细胞活力来造成胃黏膜损伤。
肉桂醛是一种传统中药,具有杀菌、抗肿瘤、免疫和抗炎活性[22]。据报道,肉桂醛可通过抑制炎症来缓解大鼠高脂肪饮食引起的动脉粥样硬化[23];肉桂醛可增强IL-1β 刺激的人软骨细胞C28/I2 细胞活力,抑制炎症反应[24]。以上研究表明肉桂醛具有抗炎的作用。本研究显示,在体内动物水平上,肉桂醛可呈剂量依赖性地抑制Hp 诱导的胃炎大鼠炎症反应和胃黏膜损伤;在体外细胞水平上,肉桂醛可呈剂量依赖性地增强Hp诱导的GES-1 细胞活力,抑制炎症反应。此外,替普瑞酮是临床上常用于治疗胃炎的药物[25],本研究选取该药物为阳性药物,结果显示,替普瑞酮与高剂量肉桂醛对Hp 诱导的胃炎大鼠或GES-1 细胞各指标的影响差异无统计学意义,提示肉桂醛可能成为改善Hp 诱导的胃炎胃黏膜损伤的潜在有效药物。
Shh/Gli1 通路在调控炎症性疾病中发挥着重要作用[26]。据报道,Shh 通过活化Gli1 来上调慢性阻塞性肺病小鼠肺组织中IL-1β 和TNF-α 水平,进而加重炎症反应[27];抑制Shh/Gli1 通路可对TNF-α 介导的Ha-CaT 角质形成细胞发挥抗炎活性[28]。本研究显示Shh、Gli1 蛋白在Hp 诱导的胃炎大鼠或GES-1 细胞中均呈高表达,而经肉桂醛干预后,Hp 诱导的胃炎大鼠或GES-1 细胞中Shh、Gli1 蛋白表达降低,且呈剂量依赖性。推测肉桂醛可能通过抑制Shh/Gli1 通路减轻Hp诱导的胃炎大鼠胃黏膜损伤。为了验证该推测,本研究在高剂量肉桂醛作用的基础上再给予Shh 激活剂PUR 来干预Hp 诱导的胃炎大鼠或GES-1 细胞,结果显示,PUR 减弱了高剂量肉桂醛对Hp 诱导的胃炎大鼠炎症反应以及胃黏膜病理损伤的改善作用,也减弱了高剂量肉桂醛对Hp 诱导的GES-1 细胞活力的增强以及炎症反应的抑制作用。证实了猜想的正确性。
综上所述,肉桂醛可能通过抑制Shh/Gli1 通路减轻Hp 诱导的胃炎大鼠胃黏膜损伤。肉桂醛减轻Hp诱导的胃炎大鼠胃黏膜损伤涉及的机制较为复杂,具体通过Shh/Gli1 通路下游的何种因子来发挥作用有待进一步探究。

