竹红素A 联合LED 红光照射通过YAP 途径抑制瘢痕疙瘩成纤维细胞增殖
陈雷刚 任慧敏 吴远慧 安国芝 景晓蕾 赵同心
瘢痕疙瘩是皮肤伤口愈合过程中大量结缔组织基质过度沉积引起的皮肤疾病,其主要病理特征是局部组织中成纤维细胞过度增殖。瘢痕疙瘩有手术、局部药物注射、冷冻治疗和放射治疗等治疗方法,但临床疗效并不令人满意,治疗后的复发率较高。近些年,可见光联合光敏剂的光动力疗法在增生性瘢痕、瘢痕疙瘩中的治疗作用受到广泛关注[1-2]。竹红素A(hypocrellin A,HA)是一种从中草药竹红素中提取得到的光敏剂,在多种恶性肿瘤中发挥抑制癌细胞增殖的抗癌作用[3-4]。红光是波长600~700 nm 的可见光,通过光化学作用在瘢痕、皮炎、皮肤肿瘤等皮肤疾病中发挥治疗价值[4-5]。有研究报道HA 能够增强红光在皮肤肿瘤[4]、瘢痕疙瘩[5]中的治疗作用。Yes 相关蛋白(Yesassociated protein,YAP)是Hippo 信号通路的下游信号分子。研究报道,YAP 在瘢痕疙瘩形成过程中促进成纤维细胞增殖[6-7],HA 的抗癌作用与抑制YAP 通路相关[8]。本研究通过细胞实验对HA 联合LED 红光照射通过YAP 途径抑制瘢痕疙瘩成纤维细胞(keloid fibroblasts,KFs)增殖的生物学作用及机制展开探索,旨在深入认识HA 联合红光在瘢痕疙瘩中的治疗价值及机制。
1 材料与方法
1.1 组织标本 选择6 例因瘢痕疙瘩在河北北方学院附属第一医院接受手术切除的患者,收集瘢痕疙瘩组织。其中男性1 例、女性5 例,年龄24~36 岁、平均(28.82±5.23)岁。本研究获得河北北方学院附属第一医院医学伦理委员会批准(批准号:W2023034),患者签署知情同意书。
1.2 主要试剂及仪器 HA 购自南通飞宇生物科技公司,阴性对照(negative control,NC)质粒、YAP 质粒购自武汉金开瑞生物科技公司,CCK8 细胞增殖检测试剂盒和BrdU 细胞增殖检测试剂盒分别购自上海翌圣生物科技公司和武汉赛培生物科技公司,丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的检测试剂盒购自南京建成研究所,YAP、β-catenin 的一抗购自美国Abcam 公司。细胞培养箱购自美国Thermo 公司,LED 红光光源购自中国科学院电子所北京科电微波电子公司,凝胶成像系统购自上海勤翔仪器公司。
1.3 方法
1.3.1 KFs的原代培养 用磷酸盐缓冲液冲洗瘢痕疙瘩组织,去除表皮、保留真皮,在0.25% 胰蛋白酶中4℃消化10 h,磷酸盐缓冲液漂洗组织、剪为1 mm3的组织块并移入50 mL 离心管,加入30 倍量0.2% IV 型胶原酶并在37℃消化,直至组织成为絮状,消化悬液在200 目筛网过滤,滤液1 000 r/min 离心10 min 后保留沉淀,用含有10%胎牛血清的培养基重悬并调节细胞密度至每毫升2×106个。将细胞接种在培养瓶中,每2天换液,待细胞密度达80%时进行消化传代,收集第3代KFs 进行分组处理。
1.3.2 KFs的分组及处理 第3 代KFs 接种在培养板中,按照下列方法进行分组处理:①对照组:在不含药物的培养基中培养,不进行LED 红光照射;②H 组:在含有1.0 μmol/L Hypocrellin A 的培养基中培养,持续4 h;③L 组:LED 红光照射,辐射剂量3 J/cm2、辐射密度5.68 mW/cm2、距离20 mm、时间9 min;④H+L 组:先给予Hypocrellin A 处理、条件同H 组,而后给予LED 红光照射、条件同L 组;⑤NC 质粒组:转染NC 质粒、质粒终浓度为2.5 μg/mL;⑥NC 质粒+H+L 组:转染NC质粒、质粒终浓度为2.5 μg/mL,同时先给予Hypocrellin A 处理、而后给予LED 红光照射;⑦YAP 质粒+H+L组:转染YAP 质粒、质粒终浓度为2.5 μg/mL,同时先给予Hypocrellin A 处理、而后给予LED 红光照射。
1.3.3 细胞增殖的检测 KFs 接种在96 孔培养板中,培养20 h 后分组处理,而后在每个培养孔内加入10 μL CCK8 检测液,继续培养2 h 后在酶标仪中检测450 nm 波长的吸光度(OD)。
1.3.4 氧化应激指标的检测 KFs 接种在12 孔培养板中,培养20 h 后分组处理,而后检测细胞中MDA、SOD、GSH-Px 的含量,检测操作均按照试剂盒说明书进行。
1.3.5 蛋白表达水平的检测 KFs 接种在12 孔培养板中,培养20 h 后分组处理,而后提取蛋白并进行蛋白定量,根据定量结果将30 μg 蛋白加入聚丙烯酰胺凝胶进行检测,电泳后电转硝酸纤维素膜,5% 脱脂牛奶封闭1 h,4℃孵育YAP 一抗(稀释比例1∶1 000)、β-catenin 一抗(稀释比例1∶500)或β-actin 一抗(稀释比例1∶5 000)过夜。次日室温孵育二抗(稀释比例1∶1 000)1 h。最后在凝胶成像系统中对硝酸纤维素膜中的YAP、β-catenin 及β-actin 进行显影,以β-actin 的条带灰度值为内参、计算YAP、β-catenin 的蛋白表达水平。
1.4 统计学方法 采用SPSS 22.0 进行统计学处理,正态分布计量资料以±s> 表示,组间比较采用单因素方差分析及LSD-t两两比较。P<0.05 为差异有统计学意义。
2 结果
2.1 HA 联合LED 红光照射对KFs 增殖的影响 H 组和L 组KFs 的OD450 水平低于对照组(t=7.032、5.711,P<0.001)、BrdU 阳性率低于对照组(t=6.579、6.041,P<0.001);H+L 组KFs 的OD450 水平及BrdU阳性率低于H 组和L 组(t=11.473、10.280,P<0.001)。见表1。
表1 4组KFs增殖水平的比较(±s)
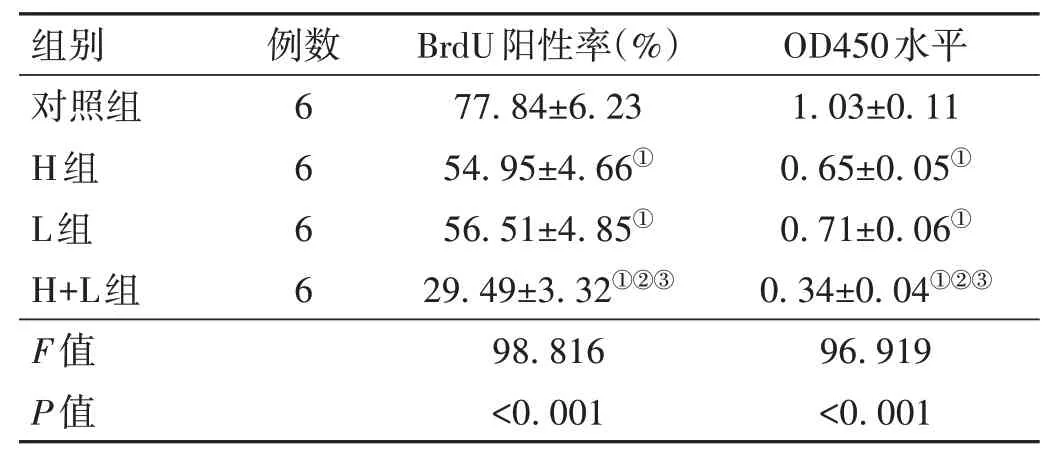
表1 4组KFs增殖水平的比较(±s)
注:与对照组比较,①P<0.05;与H组比较,②P<0.05;与L组比较,③P<0.05。
OD450水平1.03±0.11 0.65±0.05①0.71±0.06①0.34±0.04①②③96.919<0.001组别对照组H组L组H+L组F值P值例数6 6 6 6 BrdU阳性率(%)77.84±6.23 54.95±4.66①56.51±4.85①29.49±3.32①②③98.816<0.001
2.2 Hypocrellin A 联合LED 红光照射对KFs 氧化应激的影响 H 组和L 组KFs 中MDA 的水平高于对照组,SOD、GSH-Px 的水平低于对照组(P<0.05);H+L 组KFs 中MDA 的水平高于H 组和L 组,SOD、GSH-Px 的水平低于H 组和L 组(P<0.05)。见表2。
表2 4组KFs氧化应激水平的比较(±s)
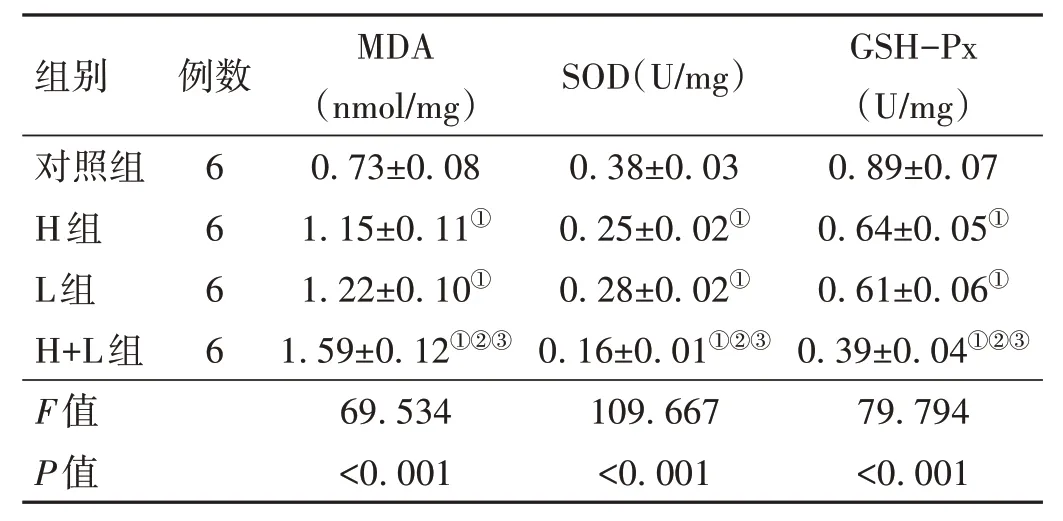
表2 4组KFs氧化应激水平的比较(±s)
注:MDA为丙二醛;SOD为超氧化物歧化酶;GSH-Px为谷胱甘肽过氧化物酶;与对照组比较,①P<0.05;与H组比较,②P<0.05:与L组比较,③P<0.05。
GSH-Px(U/mg)0.89±0.07 0.64±0.05①0.61±0.06①0.39±0.04①②③79.794<0.001组别对照组H组L组H+L组F值P值例数6 6 6 6 MDA(nmol/mg)0.73±0.08 1.15±0.11①1.22±0.10①1.59±0.12①②③69.534<0.001 SOD(U/mg)0.38±0.03 0.25±0.02①0.28±0.02①0.16±0.01①②③109.667<0.001
2.3 Hypocrellin A 联合LED红光照射对KFs中YAP途径的影响 H 组和L 组KFs 中YAP 的表达水平低于对照组(t=8.705、10.446,P<0.001)、β-catenin 的表达水平低于对照组(t=10.608、11.776,P<0.001);H+L 组KFs 中YAP 的表达水平低于H 组和L 组(t=16.432、12.598,P<0.001)、β-catenin 的表达水平低于H 组和L 组(t=13.587、7.668,P<0.05)。见图1、表3。

图1 4组KFs中YAP、β-catenin的表达
表3 4组KFs中YAP、β-catenin表达水平的比较(±s)
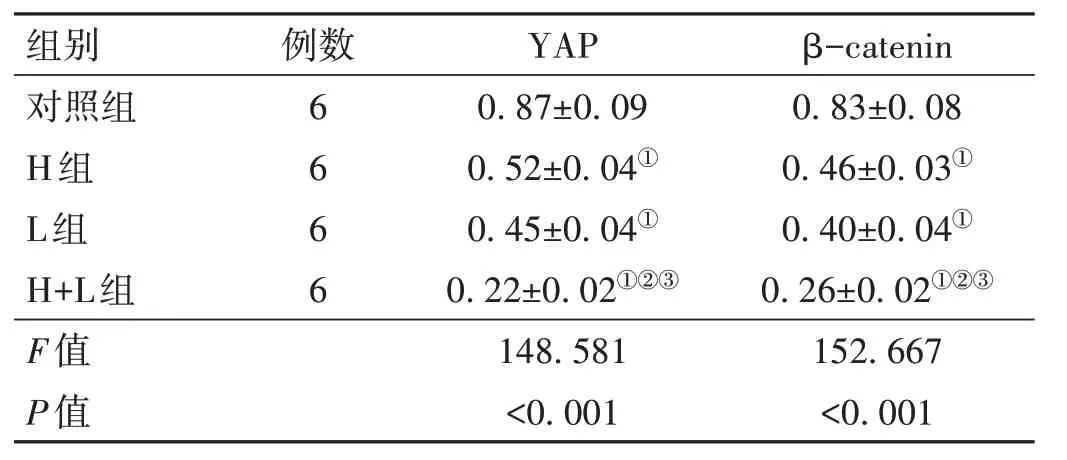
表3 4组KFs中YAP、β-catenin表达水平的比较(±s)
注:YAP为Yes相关蛋白;β-catenin为β-连环蛋白;与对照组比较,①P<0.05;与H组比较,②P<0.05;与L组比较,③P<0.05。
β-catenin 0.83±0.08 0.46±0.03①0.40±0.04①0.26±0.02①②③152.667<0.001组别对照组H组L组H+L组F值P值例数6 6 6 6 YAP 0.87±0.09 0.52±0.04①0.45±0.04①0.22±0.02①②③148.581<0.001
2.4 转染质粒对Hypocrellin A 联合LED 红光照射抑制KFs 中YAP 途径的影响 NC 质粒+H+L 组KFs 中YAP、β-catenin 的表达水平低于NC 质粒(t=13.919、17.557,P<0.001);YAP 质粒+H+L 组KFs 中YAP、β-catenin 的表达水平高于NC 质粒+H+L 组(t=12.736、13.942,P<0.001)。见图2、表4。
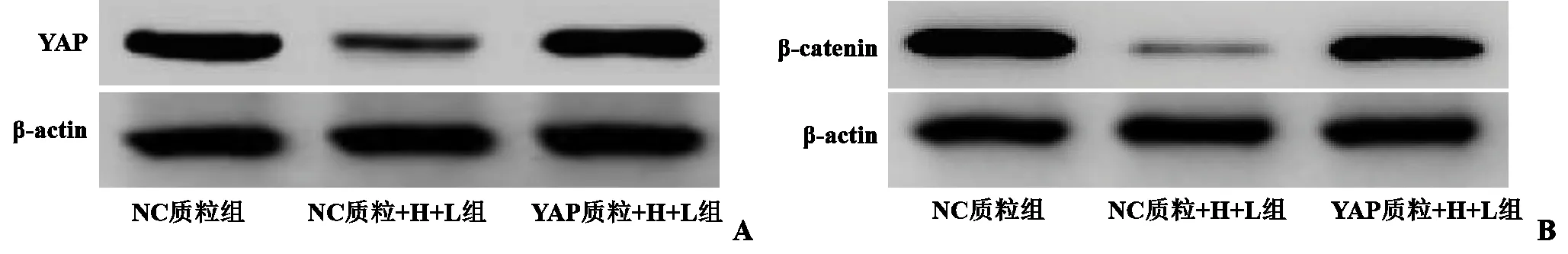
图2 3组KFs中YAP、β-catenin表达水平的比较
表4 3组KFs中YAP、β-catenin表达水平的比较(±s)
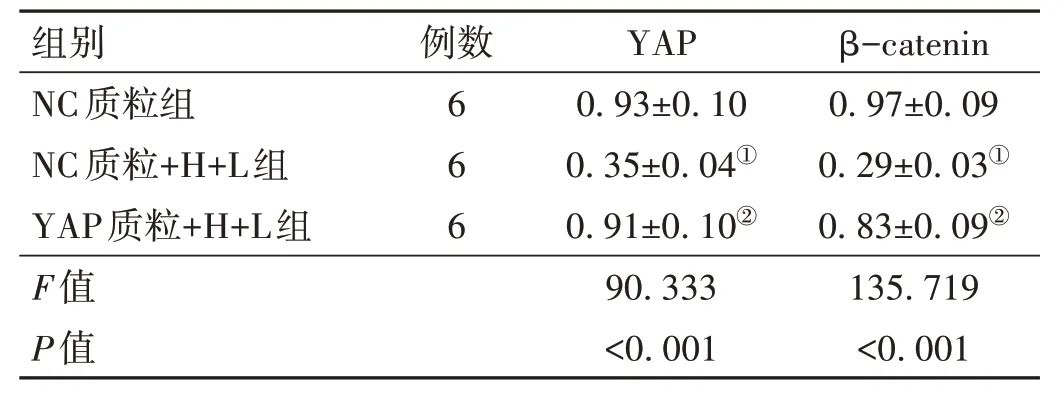
表4 3组KFs中YAP、β-catenin表达水平的比较(±s)
注:YAP为Yes相关蛋白;β-catenin为β-连环蛋白;与NC质粒组比较,①P<0.05;与NC质粒+H+L组比较,②P<0.05。
例数6 6 6 β-catenin 0.97±0.09 0.29±0.03①0.83±0.09②135.719<0.001组别NC质粒组NC质粒+H+L组YAP质粒+H+L组F值P值YAP 0.93±0.10 0.35±0.04①0.91±0.10②90.333<0.001
2.5 上调YAP 对Hypocrellin A 联合LED 红光照射抑制KFs 增殖的影响 NC 质粒+H+L 组KFs 的OD450水平及BrdU 阳性率低于NC 质粒组(t=15.682、14.057,P<0.001);YAP 质粒+H+L 组KFs 的OD450水平及BrdU 阳性率高于NC 质粒+H+L 组(t=13.430、10.991,P<0.001)。见表5。
表5 3组KFs增殖水平的比(±s)

表5 3组KFs增殖水平的比(±s)
注:与NC质粒组比较,①P<0.05;与NC质粒+H+L组比较,②P<0.05。
BrdU阳性率(%)74.59±6.69 28.59±4.41①63.93±6.53②97.671<0.001组别NC质粒组NC质粒+H+L组YAP质粒+H+L组F值P值例数6 6 6 OD450水平1.06±0.10 0.37±0.04①0.91±0.09②120.335<0.001
2.6 上调YAP 对Hypocrellin A 联合LED 红光照射抑制KFs 氧化应激的影响 NC 质粒+H+L 组KFs 中MDA 的水平高于NC 质粒组,SOD、GSH-Px 的水平低于NC 质粒组(P<0.05);YAP 质粒+H+L 组KFs 中MDA 的水平低于NC 质粒+H+L 组,SOD、GSH-Px 的水平高于NC 质粒+H+L 组(P<0.05)。见表6。
表6 3组KFs氧化应激水平的比较(±s)

表6 3组KFs氧化应激水平的比较(±s)
注:MDA为丙二醛;SOD为超氧化物歧化酶;GSH-Px为谷胱甘肽过氧化物酶;与NC质粒组比较,①P<0.05;与NC质粒+H+L组比较,②P<0.05。
GSH-Px 0.81±0.08 0.44±0.05①0.68±0.06②50.736<0.001组别NC质粒组NC质粒+H+L组YAP质粒+H+L组F值P值例数6 6 6 MDA 0.81±0.09 1.67±0.14①1.03±0.11②90.271<0.001 SOD 0.45±0.04 0.19±0.02①0.34±0.03②105.724<0.001
3 讨论
红光联合光敏剂的光动力疗法是治疗瘢痕疙瘩、痤疮、部分皮肤肿瘤、尖锐湿疣等皮肤疾病的常用方法[9-11]。HA 是从真菌竹红菌中提取得到的光敏剂。有研究报道,HA 联合红光对肿瘤细胞的杀伤作用较单用HA 或红光增强[4]。KFs 过度增殖是瘢痕疙瘩形成过程中的关键病理环节[12-13]。相关的临床和基础研究证实,光动力疗法联合氨基酮戊酸对KFs 的增殖及胶原的合成具有抑制作用[14-15]。但目前瘢痕疙瘩的临床治疗效果并不令人满意,治疗后的复发率较高。本研究联合使用光敏剂HA 与红光进行KFs 处理,旨在初步揭示HA 联合红光在瘢痕疙瘩中的治疗价值,通过CCK8 法和Brd 法检测增殖可知:HA 和红光单独或联合处理均抑制KFs 的增殖,HA 对KFs 增殖的作用与其抑制肿瘤细胞增殖的效应一致,红光对KFs 增殖的抑制作用与其他学者报道光动力疗法抑制KFs 增殖的结果吻合[14-15]。本研究中,HA 联合红光对KFs 增殖的抑制作用强于单独处理,表明HA 和红光联用起到互相增强生物学效应的作用。
红光杀伤细胞的光化学作用与增加自由基生成、刺激氧化应激反应相关[16]。HA 作为光敏剂,吸收有效光后能够促进自由基生成并放大氧化应激反应、起到细胞杀伤作用[4]。细胞在自由基作用下发生氧化应激损伤后,脂质过氧化产物MDA 生成增多,同时不断消耗抗氧化物SOD 和GSH-Px、表现为抗氧化物含量降低。本研究中,HA 和红光单独处理KFs 后细胞中MDA 含量增加,SOD 和GSH-Px 含量降低,表明HA 和红光均具有激活KFs 氧化应激反应的作用,进而提示两种治疗方式可能通过激活氧化应激的方式抑制KFs增殖。本研究中,HA 联合红光对KFs 氧化应激的激活作用强于单独处理,这一结果与联合处理抑制细胞增殖作用更强的结果吻合。
细胞增殖及氧化应激受到复杂信号通路的调控,其中Hippo 通路在进化上高度保守且作用广泛。YAP是Hippo 通路下游信号转导途径,目前的多数研究均证实YAP 具有促增殖、抗凋亡、抗氧化的作用[17-18]。在成纤维细胞氧化应激损伤模型中,过表达YAP 减轻细胞损伤及氧化应激反应[19];在恶性肿瘤细胞中,YAP 通过增加β-catenin 表达的方式促进细胞增殖[20]。本研究中,HA 和红光单独及联合处理KFs 后细胞中YAP和β-catenin 的表达均降低,并且联合处理后YAP 和β-catenin 表达降低的效应更显著,提示两种治疗方式均抑制YAP/β-catenin 途径且联合处理的抑制效应更强。为进一步阐明YAP 途径在HA 联合红光抑制KFs 增殖中的作用,本研究设计了转染质粒的逆转实验,HA联合红光处理的同时转染YAP 表达质粒增加YAP 的表达后,细胞增殖减弱、氧化应激增强的作用被逆转,表明HA 联合红光通过抑制YAP 途径抑制KFs 增殖、刺激KFs 氧化应激。
综上所述,HA 和LED 红光照射均显著抑制KFs增殖、激活KFs 氧化应激,两者联合抑制增殖、激活氧化应激的作用强于单一处理,抑制YAP/β-catenin 途径是HA 联合LED 红光照射抑制KFs 增殖、激活KFs 氧化应激的相关分子机制之一。
——记嘉荫县红光乡燎原村党支部

