广藿香60Co-γ射线辐射诱变植株的筛选及评价
巫锴丽 刘键锺 李成梅 曾建荣 庞玉新 严寒静
摘 要:為应对广藿香药材需求量急速增加、无突出优点的品种且品种单一的情况,解决广藿香道地药材缺失及种质退化、种质来源混乱、易遭受病害虫害等问题,本研究通过辐照诱变育种,设置梯度剂量的60Co-γ射线,对愈伤组织、丛生芽、生根苗3种不同生长阶段的广藿香进行辐照处理,观测再生植株外观形态,筛选出变异植株,测量其农艺性状和生理生化指标,采用气相色谱-质谱联用技术(GC-MS)测定其主要挥发性成分广藿香酮及百秋李醇含量。结果表明:愈伤组织和丛生芽对60Co-γ射线较为敏感,死亡率较高,生根苗对60Co-γ射线较为耐受,死亡率较低,最佳诱变育种的方式是采用100 Gy 60Co-γ射线辐照处理生根苗,其诱变率高达10%。本研究最终获得29株广藿香变异植株,分别为三叶轮生、异型叶、深裂叶、狭叶、卷叶、下卷叶和紫色叶7种形态类型植株,通过比较分析渗透调节物质(可溶性糖、可溶性蛋白和游离脯氨酸)、抗氧化物质(丙二醛、过氧化物酶、过氧化氢酶)、广藿香酮和百秋李醇含量,最终筛选得到15株具有潜力植株,分别为:抗逆且高有效成分植株SY7和ZY1;对环境敏感且高有效成分植株SY15、SY18和XY1;抗逆植株SY2、SY6、SY19、YY2、YY9和XJY1;高有效成分植株SY10和SY17;“酮型”广藿香植株SY3和JY1。其中SY7和ZY1为双重优良特性新种质,2株“酮型”广藿香植株对于解决道地药材缺失及其种质退化等问题具有应用价值。本研究采用60Co-γ射线辐照诱变方法选育的广藿香变异植株,具有较强抗逆性、高有效成分等优点,为广藿香诱变育种以及新品种选育提供成熟方法和潜在种质。
关键词:广藿香;60Co-γ射线;生理生化指标;GC-MS;百秋李醇;广藿香酮中图分类号:S567.239 文献标识码:A
Screening and Evaluation of Induced Mutation by 60Co-γ Radiation of Pogostemon cablin (Blanco) Benth.
WU Kaili1, LIU Jianzhong2, LI Chengmei1, ZENG Jianrong3, PANG Yuxin4*, YAN Hanjing1*
1. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou, Guangdong, 510006, China; 2. Baoan Peoples Hospital, Shenzhen, Guangdong 518101, China; 3. Guangdong Chaozhou Health Vocational College, Chaozhou, Guangdong 515632, China; 4. School of Pharmacy, Guizhou University of Traditional Chinese Medicine, Guiyang, Guizhou 550025, China
Abstract: The study was aimed to cope with the rapid increase in demand for patchouli [Pogostemon cablin (Blanco) Benth.] and to solve the problems of lack of patchouli medicinal materials, germplasm degradation, confusion of germplasm sources, and vulnerability to diseases and pests. Callus, cluster buds and rooting seedling of patchouli were irradiated with a gradient dose of 60Co-γ rays. The appearance and morphology of regenerated plants were observed, the mutated plants were screened, the agronomic traits and physiological and biochemical indicators were measured, and the content of pogostone and patchouli alcohol, the main volatile components, were determined by gas chromatography-mass spectrometry (GC-MS). The results showed that calluses and cluster buds were more sensitive to 60Co-γ rays and had higher mortality rate, while rooting seedlings were more tolerant to 60Co-γ rays and had lower mortality. The best way to breed mutagenesis is 60Co-γ treated rooting seedlings with irradiation doses of 100 Gy with a mutagenesis rate of up to 10%. In this experiment, 29 patchouli variant plants were obtained, which were divided into seven morphological types, namely three-leaf whorls, heteromorphic leaves, deep-split leaves, narrow leaves, coiled leaves, undercoiled leaves and purple leaves. The contents of osmotic conditioning substances [soluble sugar, soluble protein and free proline (Pro)], antioxidant substances [malondialdehyde (MDA), peroxidase (POD), catalase (CAT)], pogostone and patchouli alcohol were compared and analyzed. According to the analysis results of the above determination indicators, 15 potential plants were finally screened, namely: stress-resistant plants with high effective components SY7 and ZY1; environmentally sensitive plants with high effective components SY15, SY18 and XY1; stress-resistant plants SY2, SY6, SY19, YY2, YY9 and XJY1; high active ingredient plants SY10 and SY17; “pogostone-type” patchouli plants SY3 and JY1. Among them, SY7 and ZY1 are new germplasms with double excellent characteristics, and the two “pogostone-type” patchouli plants have application value for solving the problems of the lack of authentic medicinal materials and the degradation of germplasm. In this study, patchouli variant plants bred by the 60Co-γ ray irradiation mutagenesis method have the advantages of strong stress resistance and high active ingredients, which would provide mature methods and potential germplasm for patchouli mutagenesis breeding and new variety breeding.
Keywords: Pogostemon cablin (Blanco) Benth.; 60Co-γ ray; physiological and biochemical indicators; GC-MS; patchouli alcohol; pogostone
DOI: 10.3969/j.issn.1000-2561.2024.02.007
广藿香[Pogostemon cablin (Blanco) Benth.]为唇形科刺蕊草属植物,以干燥地上部分入药,具有开胃止呕、芳香化湿、发表解暑等功效[1],是藿香正气水、抗病毒口服液等中成药的主要原料之一,在医药、化妆品等领域有广泛应用[2]。广藿香在防治新型冠状病毒感染中起到了重要的作用,为外用预防方最常用药,内服预防方常用药[3],并且为《新型冠状病毒肺炎诊疗方案(试行第六版)》中推荐使用中药治疗复方的高频使用药[4]。广藿香具有较好的抗病毒抗菌能力,在治疗COVID-19及抗菌方面有很好的发展前景[5-7]。广藿香原产东南亚国家,最早自梁代前传入中国[8],在我国有悠久的栽培历史。广藿香罕见开花,即使偶有开花,也无结实,所以各地栽种的广藿香主要以扦插的方式繁殖[9],因此难以采用传统杂交育种方式获得优良品种。广州石牌一带盛产广藿香,由于其质量优、疗效好,被称为“牌香”道地药材[10],罗集鹏等[11]根据广藿香挥发油成分中的百秋里醇与广藿香酮含量的不同,将不同产地的廣藿香分为2个化学型,石牌及肇庆高要产的为“广藿香酮型”,广东吴川、遂溪、雷州和海南万宁产的为“广藿香醇型”。
目前广藿香道地药材缺失,种源混乱,无抗逆性强、产量高、有效成分含量高等突出优点、性状稳定的品种,优良品质的中药材种子种苗是保障中药材品质的必要条件,是中医药事业发展的物质基础,因此选育广藿香优良品种迫在眉睫。辐照诱变技术具有方法简便、育种周期短、效果好等特点[12],本研究以广藿香为试材,采用60Co-γ射线为辐射源对不同生长阶段的广藿香进行诱变,确定60Co-γ射线的诱变条件,通过植株外观形态、农艺性状初步筛选出变异植株,以生化指标及主要挥发性成分含量对广藿香变异植株进行品质评价,以期获得性状优良的突变植株并为广藿香诱变育种提供参考,后续可对广藿香变异植株的遗传稳定性进一步研究。
1 材料与方法
1.1 材料
1.1.1 植物材料 采用广藿香无菌愈伤组织、丛生芽和生根苗为材料,经广东药科大学中药学院严寒静教授鉴定为广藿香[Pogostemon cablin (Blanco) Benth.],为醇型广藿香。
1.1.2 主要试剂与仪器 主要试剂:脯氨酸(20200906)、蒽酮(20201114)均购自北京博奥拓达科技有限公司;茚三酮(S19209)购自上海源叶生物科技有限公司;考马斯亮蓝法试剂盒(A045-2-1)、丙二醛(MDA)试剂盒(A003-1-2)、过氧化氢酶(CAT)试剂盒(A064-1-1)、过氧化物酶(POD)试剂盒(A084-3-1)均购自南京建成生物工程研究所;十八烷(A13111044)购自上海阿拉丁生化科技股份有限公司;二氯甲烷(分析纯)、正己烷(色谱纯)均购自天津市科密欧化学试剂有限公司;百秋里醇(质量分数>98%,B-037-180122)、广藿香酮(质量分数>98.5%,G-055-180710)对照品均购自成都瑞芬思生物科技有限公司。
仪器:1530酶标仪(赛默飞世尔科技公司);3K15冷冻离心机(SIGMA公司);7890B-7000D型气相色谱-质谱联用仪(Agilent Technologies Inc公司),RE-52A型旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 方法
1.2.1 60Co-γ射线辐照处理及变异植株的筛选 以广藿香愈伤组织、丛生芽及生根苗为60Co-γ射线辐照材料,各组实验个体约100个培养瓶,以未辐照处理的材料为对照(CK)。设计6组梯度辐照剂量组,辐照剂量分别为10、20、40、60、80、100 Gy,剂量率为0.82 Gy/min,60Co-γ射线辐照处理后的愈伤组织团块转移至丛生芽培养基中进行分化培养,辐照处理后的丛芽及CK接种至生根培养基中培育3个月,经水培炼苗,营养土育苗。根据分枝、叶序、叶型及叶色等形态差异,遵循分枝数≥2、三叶轮生叶序、叶型及叶色较大差异者的原则,筛选变异植株,于4月将变异植株定植于花盆内,相同管理措施,11月采收。
1.2.2 农艺性状观测 在广藿香生长茂盛期,观测广藿香株高、地径、分枝数、叶型指数(叶长/叶宽)、叶色、叶型、叶序等农艺性状指标。
1.2.3 生理生化指标测定 (1)采样。取广藿香主枝第2~3对新鲜成熟叶片若干,液氮速冻,置于–80 ℃冰箱保存。
(2)指标测定。参考张志良等[13]的方法测定可溶性糖(soluble sugar, SS)含量和脯氨酸(proline, Pro)含量。可溶性蛋白(soluble protein, SP)含量、MDA含量、CAT活性和POD活性参照考马斯亮兰法试剂盒(A045-2-1)、MDA试剂盒(A003- 1-2)、CAT试剂盒(A064-1-1)、POD试剂盒(A084-3-1)说明书进行测定。
1.2.4 变异植株主要挥发性成分测定 (1)溶液的配制。内标溶液:1 mg/mL正十八烷内标溶液;对照品溶液:2 mg/mL百秋李醇及1 mg/mL广藿香酮对照品溶液。供试品的制备:称取0.3 g广藿
香变异植株地上部分干燥粗粉,置于具塞锥形瓶中,加入二氯甲烷30 mL,超声处理3次,每次20 min,过滤,合并滤液,旋转蒸发仪回收溶剂,稠膏加正己烷溶解后,全量转移至5 mL容量瓶中,定容,测定时按比例稀释,加入内标溶液,用0.45 μm微孔滤膜过滤。
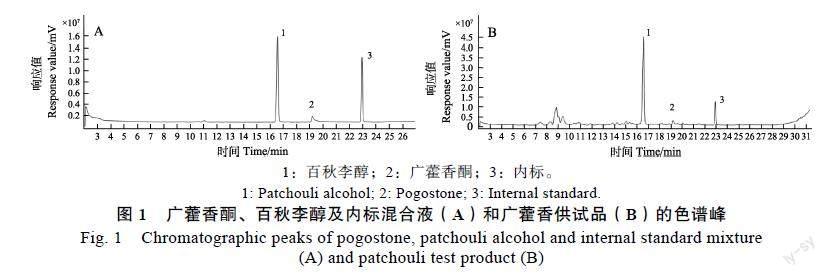
(2)气相色谱-质谱分析条件。参考欧晓华等[14]的方法进行气相色谱-质谱分析。气相条件:色谱柱为DB-5 MS毛细管柱(30 m×0.25 mm, 0.25 μm);初始温度为120 ℃,保持2 min;以2 ℃/min速率升温至160 ℃,保持2 min;以10 ℃/min速率升温至180 ℃,保持2 min;以30 ℃/min速率升温至280 ℃,保持0 min;进样量为1 μL,分流比为30∶1,载气为高纯氦气,柱箱温度为120 ℃,进样口温度为250 ℃,接口温度为250 ℃。质谱条件:EI离子源,离子源温度为200 ℃,电离能量为70 eV,扫描质量范围m/z为50~500,溶剂延迟2 min。标准库NIST14.lib。百秋李醇含量的线性范围为0.01~0.50 mg/mL,回归方程为y=80.5061x+ 0.0197(R?=0.9999),样品精密度r=0.53%,加样回收率为97.02%,重复性r=4.56%;广藿香酮含量的线性范围为0.01~0.10 mg/mL,回归方程为y= 11.892x–0.1135(R?=0.9993),样品精密度r=0.99%,加样回收率为102.9%,重复性r=4.97%,结果重现性好,准确度高(图1)。
1.3 数据处理
采用Excel 2016软件对试验数据进行统计并制图,采用SPSS 24.0软件进行差异显著性分析。
2 结果与分析
2.1 60Co-γ射线辐照处理及广藿香变异植株的筛选
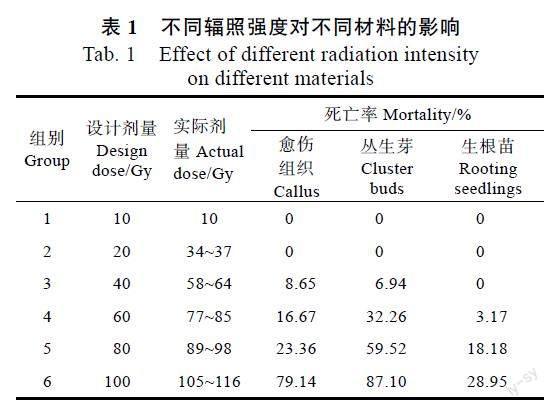
由表1可知,不同材料对辐照的敏感程度不同,实际辐照剂量为58~64 Gy时,愈伤组织最敏感,死亡率为8.65%,丛生芽次之,生根苗死亡率为0;实际辐照剂量为77~116 Gy时,丛生芽死亡率最高,愈伤组织次之,生根苗耐受性较强,死亡率最低。结果表明:广藿香3种辐照材料的死亡率均随辐照剂量的升高而升高,愈伤组织的半致死辐照剂量可能在98~105 Gy之间,丛生芽的半致死辐照剂量约为70 Gy(图2),较高辐照强度对愈伤组织损伤较大,会导致其大量停止生长并死亡;低辐照剂量时,愈伤组织对辐照效应更为敏感;高辐照剂量时,丛生芽对辐照效应更为敏感;总体表现为生根苗对60Co-γ射线较为耐受。
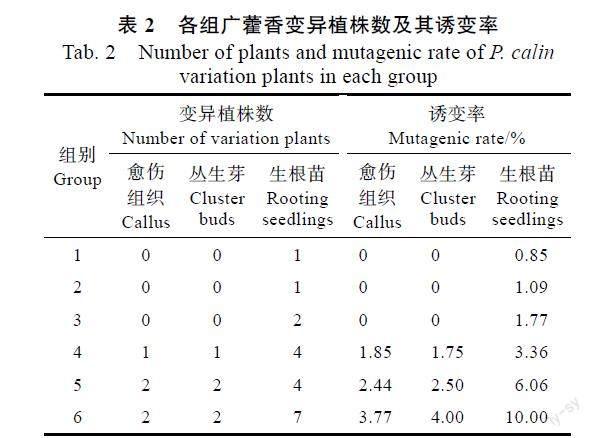
根据变异植株筛选标准,在1299株广藿香辐照处理再生苗中筛选获得29株广藿香变异植株,各组筛选得到的变异植株数及诱变率见表2。结果表明,广藿香3种辐照材料的诱变率均随辐照剂量的升高而升高,当辐照剂量小于77 Gy时,丛生芽和愈伤组织的诱变率均为0,而生根苗在任一辐照剂量中均筛选出变异植株,在辐照剂量为100 Gy时诱变率最高,为10%。
2.2 广藿香变异植株农艺性状指标及分类
根据实验组和变异植株叶的生长情况,制定变异植株的分类标准:叶序=3为三叶轮生植株,叶序=2为正常叶序;叶型指数≤1.00为异型叶,叶型指数≥1.40为狭叶,叶型指数在1.00~1.40之间为正常叶型,叶片卷曲方向向上为卷叶,向下为下卷叶,叶色紫色为紫色叶。
根据以上分类标准将29株变异广藿香分为7個变异类型(表3)。其中,三叶轮生的变异植株株高、地径均显著低于CK,而分支数极显著高于CK;异型叶和深裂叶的变异植株株高、地径均极显著低于CK,异型叶植株的分枝数极显著高于CK;深裂叶植株的分支数显著高于CK,其他变异植株株高、地径均低于CK,而分支数高于CK,说明60Co-γ射线对广藿香株高、地径及分枝数有显著影响,抑制广藿香的生长高度及茎粗,但会使广藿香分枝数变多。
2.3 广藿香变异植株生理生化特性
SS、SP和Pro为植物体内有机渗透调节物质,植物通过积累或分解渗透调节物质来维持细胞内外渗透压的平衡,从而应对干旱、盐碱等不利生境。在不利生境的刺激下,会引起植物体内活性氧的积累,过多的活性氧会破坏细胞膜的完整性,导致细胞死亡,MDA含量是细胞膜受到伤害程度的重要指标[15]。植物体内具有抗氧化酶和还原性物质等保护性物质,这些物质组成了复杂的活性氧清除系统,植物体内的活性氧不断产生,同时也不断被清除,形成了动态平衡[16]。POD和CAT为抗氧化酶,可以根据抗氧化酶活性来体现植株清除活性氧的能力。
29株广藿香变异植株及CK植株中的渗透调节物质、MDA和抗氧化酶活性见表4。有3株变异植株的SS含量与CK呈极显著差异,其中SY6的SS含量最高,为80.9 mg/g;有6株变异植株的SS含量与CK呈显著差异,其中YY8的SS含量最低,为38.0 mg/g。有9株变异植株的SP含量与CK呈极显著差异,其中JY1的SP含量最高,为7.91 mg/g,SY13的SP含量最低,为0.69 mg/g;有5株变异植株的可溶性蛋白含量与CK呈显著差异。SY7和SL3的Pro含量分别比CK高89.79%和101.58%,均呈极显著差异;有4株广藿香变异植株的Pro含量显著低于CK,其余植株与CK无显著差异。有10株变异植株的MDA含量与CK呈极显著差异,其中SY11的MDA含量最高,为30.68 nmol/mg,SY19的MDA含量最低,为1.97 nmol/mg;有6株变异植株的MDA含量与CK呈显著差异。SY13的CAT和POD活性最高,分别为163.59 μmol/mg和265.33 μmol/g,SY11、SY13、SY14、SY15、SY16、SY18和XY1的MDA含量、CAT活性和POD活性均显著高于CK。
综上,变异植株SY6、YY9和XJY1的SS含量显著增加,SY7的SS和Pro含量显著增加。SY2、SY19和YY2的SP含量显著增加,而MDA含量显著降低,说明植株SY2、SY19和YY2体内的活性氧积累较少。ZY1的SP含量显著增加,植株体内含较高有机渗透调节物质可以很好地维持渗透势,上述植株可能具有较强的抗逆性。SY13、SY16和SY18的Pro和SP含量显著降低,同时其MDA含量、CAT和POD活性显著增加,
SY13、SY16和SY18在当前栽培环境下未合成较多的有机渗透调节物质,使活性氧含量积累,破坏其细胞膜完整性,产生大量MDA,从而使植株需要保持较高的抗氧化酶活性以消除活性氧,以维持植株活性氧的动态平衡,说明其对栽培环境较为敏感。SY11、SY14、SY15和XY1除Pro含量无显著差异外,其余指标与SY13、SY16、SY18相同,为环境敏感型植株。
2.4 广藿香变异植株主要挥发性成分测定
广藿香挥发油中的主要化学成分和主要有效成分为百秋李醇与广藿香酮[17]。由图3可知,有8株变异植株的百秋李醇含量极显著高于CK,其中SY12、SY15、XY1和ZY1的百秋李醇含量约为CK的2倍;有2株变异植株的百秋里醇含量显著高于CK;有4株变异植株的百秋李醇含量极显著低于CK;有2株变异植株的百秋李醇含量显著低于CK。由图4可知,有13株变异植株的广藿香酮含量极显著高于CK,其中SY3的广藿香酮含量高达3.883%,约为CK的16倍,含量极高;有2株变异植株的广藿香酮含量显著高于CK。由图5可知,SY1、SY12和YY3的百秋李醇含量与广藿香酮含量的比值均极显著大于CK,SY14的显著高于CK;变异植株SY3、YY8、YY10、SL3和JY1的百秋李醇含量与广藿香酮含量的比值均极显著小于CK,SY6、SY16、YY2、YY7和XJY1的百秋李醇含量与广藿香酮含量的比值均显著小于CK。
CK的百秋李醇含量为0.557%,广藿香酮含量为0.241%,百秋李醇含量与广藿香酮含量的比值为2.58,百秋李醇含量相对较高,属于“醇型”广藿香。而变异植株中SY3和JY1的醇酮比分别为0.013和0.005,醇酮比值较低,广藿香酮相对含量更高,可视为“酮型”广藿香。60Co-γ射线辐照诱变对广藿香主要有效成份含量影响显著,变异植株SY7、SY10、SY15、SY17、SY18、XY1和ZY1的百秋李醇和广藿香酮含量均显著高于CK。综上,本研究获得7株高有效成分含量的广藿香植株以及2株“酮型”广藿香。
2.5 广藿香变异植株的综合评价
结合以上分析结果,根据广藿香变异植株的生理生化指标及挥发性成分含量的分析结果得出以下5种类型植株:(1)抗逆且高有效成分植株SY7和ZY1;(2)环境敏感且高有效成分植株SY15、SY18和XY1;(3)抗逆植株SY2、SY6、SY19、YY2、YY9和XJY1;(4)高有效成分植株SY10和SY17;(5)“酮型”广藿香植株SY3和JY1。
3 讨论
3.1 60Co-γ射线对不同生长阶段广藿香的辐照效应
药用植物辐射诱变育种需要选择适宜的诱变材料和辐照剂量才能获得有效的诱变。低剂量辐照处理条件下,可以获得较多的辐照处理个体但突变频率低,获得的变异个体较少。高剂量辐照处理条件下,辐照处理个体的突变频率高,但死亡率也高,不良突变性状也会随之增加。因此辐照诱变育种研究中多采用半数致死剂量作为辐照试验的最佳剂量[18]。已有研究表明,辐照诱变育种仅依据死亡率来衡量辐照对其的影响是远远不够的,需要综合考察半致死辐照剂量、外植体能否出芽、再生苗能否成活以及移栽后的生长情况来确定最佳輻照剂量[19]。诱变因子在作用于生长旺盛的器官、分生组织和分化程度小的细胞时,其诱变敏感性更强[20],针对以往研究中采用广藿香离体叶片组织等为辐照材料[21-23],辐照明显抑制叶片再生,容易出现褐化、死亡,难以生长出健康的再生芽的现象,本研究比较了3种不同生长阶段广藿香离体组织材料(愈伤组织、丛生芽、生根苗)的辐照效果,以最终的诱变率与存活率为评价指标,得出广藿香的最佳诱变育种方式是以辐照剂量为100 Gy 60Co-γ射线处理生根苗,其诱变率高达10%,此条件下可以获得数量最多、存活率高的变异植株。
3.2 60Co-γ射线对广藿香变异植株的影响
植物在不利的生境条件下,次生代谢产物由活性氧的诱导产生的,次生代谢产物含量的增加可提高植物细胞的适应能力[24]。广藿香酮和百秋李醇均为广藿香植株体内产生的次生代谢产物,对环境敏感且高有效成分植株虽然抗逆性较弱,但在适宜的生长环境下可以种植获得高有效成分含量的广藿香。抗逆且高有效成分植株,具有双重优良特性,不但抗逆性强,适应各种栽培环境,同时也有比母本更高的有效成分含量的特性,这类型的品种为优良品种。
SY3和JY1两株“酮型”广藿香,其母本为“醇型”广藿香,经诱变出现了化学型的变化,对于获得高广藿香酮含量品种具有重要的生产指导意义。由此说明可通过60Co-γ射线辐照诱变育种,获得与道地药材品质相近的广藿香新品种,后续可对变异植株SY3和JY1进行离体快繁,研究其遗传稳定性并获得大量子代植株。通过子代植株和“牌香”的挥发性成分、药理和药效等进行对比,研究其实用性及可替代性。为解决道地药材种质退化、抗逆性弱、产量低等问题提供新思路。姚宇等[22]采用ISSR方法对广藿香诱变体植株进行遗传多样性分析,发现60Co-γ射线可使广藿香发生较大频率的变异。吴立蓉等[23]对广藿香辐照诱变的再生植株进行RAPD分析,发现其在表现型及分子水平出现一定的分离。本研究将进一步使用SRAP分析方法对获得的变异植株进行遗传多样性分析,以研究60Co-γ射线对广藿香变异植株分子水平的影响。
本研究中获得17株三叶轮生植株,其叶片数量和一级分枝数均比正常植株多1/3,可将三叶轮生植株应用于广藿香的种植生产中,这意味着可以获得更高的产量。植物的叶序是由叶片在茎尖分生组织(SAM)中形成时决定的,相关研究表明有规律的叶序类型间的转变是受多基因控制的[25],同时也有学者认为某些植物叶序的发生不仅是受1种机制调控,可能同时受2种或多种机制共同影响,叶序形成由基因控制,也受激素的影响。到目前为止,尚无一种完整模型可以明确地解释叶序的发生机制[26]。后续可以通过对单叶对生和三叶轮生广藿香植株的SAM全基因组重测序或转录组测序分析其差异基因,进而研究植物叶序的发生机制,以期开发成为广藿香定向育种的分子标记。
参考文献
- 国家药典委员会编. 中华人民共和国药典: 2020年版一部[S]. 北京: 中国医药科技出版社, 2020: 46. National Pharmacopoeia Commission. Pharmacopoeia of the Peoples Republic of China: 2020 edition Part 1[S]. Beijing: China Medical Science and Technology Press, 2020: 46. (in Chinese)
- 常怡雪, 甘君妍, 王玮哲, 寇新宇, 冯志攀, 李普旺, 杨子明, 陈煜. 广藿香功效及应用进展[J]. 热带农业科学, 2019, 39(12): 68-74.CHANG Y X, GAN J Y, WANG W Z, KOU X Y, FENG Z P, LI P W, YANG Z M, CHEN Y. The efficacy and application progress of Pogostemon cablin[J]. Chinese Journal of Tropical Agriculture, 2019, 39(12): 68-74. (in Chinese)
[3] 凌曉颖, 姜茗宸, 徐秋月, 武祎文, 袁斌. 基于数据挖掘的中医药防治新型冠状病毒肺炎的用药规律研究[J]. 中药材, 2020, 43(7): 1761-1766.LING X Y, JIANG M C, XU Q Y, WU Y W, YUAN B. Study on medication regularity of traditional Chinese medicine in prevention and treatment of novel coronavirus pneumonia based on data mining[J]. Journal of Chinese Medicinal Materials, 2020, 43(7): 1761-1766. (in Chinese)
[4] 邵仲柏, 朱月霞, 刘书豪, 蒋凯俊, 吴琦, 沈金阳, 刘玮炜. 临床使用治疗新型冠状病毒肺炎中药复方中高频数中药抗病毒研究概述[J]. 中草药, 2020, 51(5): 1153-1158.SHAO Z B, ZHU Y X, LIU S H, JIANG K J, WU Q, SHEN J Y, LIU W W. A review on clinical application of high frequency traditional Chinese medicine in treatment of coronavirus pneumonia 2019[J]. Chinese Traditional and Herbal Drugs, 2020, 51(5): 1153-1158. (in Chinese)
[5] WU X L, JU D H, CHEN J, YU B, LIU K L, HE J X, DAI C Q, WU S, CHANG Z, WANG Y P, CHEN X Y. Immunologic mechanism of patchouli alcohol anti-H1N1 influenza virus may through regulation of the RLH signal pathway in vitro[J]. Current Microbiology, 2013, 67(4): 431-436.
[6] YU Y Y, HE J J, SU J Q, KONG S Z, SU J Y, LI Y C, HUANG S H, LI C W, LAI X P, SU Z R. Synthesis and antimicrobial evaluation of pogostone and its analogues[J]. Fitoterapia, 2013, 38: 135-139.
[7] LIU F, CAO W, DENG C, WU Z Q, ZENG G Y, ZHOU Y J. Polyphenolic glycosides isolated from Pogostemon cablin (Blanco) Benth. as novel influenza neuraminidase inhibitors[J]. Chemistry Central Journal, 2016, 10(1): 51.
[8] 吳友根, 郭巧生, 郑焕强. 广藿香本草及引种历史考证的研究[J]. 中国中药杂志, 2007, 32(20): 2114-2117, 2181.WU Y G, GUO Q S, ZHENG H Q. Textual research on history of introduction and herbal medicine of Pogostemon cablin[J]. China Journal of Chinese Materia Medica, 2007, 32(20): 2114-2117, 2181. (in Chinese)
[9] 欧阳蒲月, 李亚萍, 莫小路. 广藿香资源调查、研究进展与发展趋势[J]. 大众科技, 2019, 21(8): 55-57.OUYANG P Y, LI Y P, MO X L. Resource investigation, research progress and development trend of Pogostemon cablin[J]. Popular Science & Technology, 2019, 21(8): 55-57. (in Chinese)
[10] 罗集鹏, 冯毅凡, 何冰, 郭晓玲, 陈小夏, 曹晖, 刘玉萍. 广藿香的道地性研究[J]. 中药材, 2005, 28(12): 1121-1125.LUO J P, FENG Y F, HE B, GUO X L, CHEN X X, CAO H, LIU Y P. An authentic study of Pogostemon cablin[J]. Journal of Chinese Medicinal Materials, 2005, 28(12): 1121-1125. (in Chinese)
[11] 罗集鹏, 刘玉萍, 冯毅凡, 郭晓玲, 曹晖. 广藿香的两个化学型及产地与采收期对其挥发油成分的影响[J]. 药学学报, 2003, 38(4): 307-310. LUO J P, LIU Y P, FENG Y F, GUO X L, CAO H. Two chemotypes of Pogostemon cablin and influence of region of cultivation and harvesting time on volatile oil composition[J]. Acta Pharmaceutica Sinica, 2003, 38(4): 307-310. (in Chinese)
[12] 屠礼刚, 丁建平, 马忠社, 赵玫, 王礼平, 李四游, 高卿. 荷花辐照育种技术初步研究[J]. 现代园艺, 2016(7): 21-22.TU L G, DING J P, MA Z S, ZHAO M, WANG L P, LI S Y, GAO Q. Preliminary study of lotus irradiation breeding technology[J]. Contemporary Horticulture, 2016(7): 21-22. (in Chinese)
[13] 张志良, 翟伟菁. 植物生理学实验指导[M]. 3版. 北京: 高等教育出版社, 2006: 127-130.ZHANG Z L, QU W J. Experimental guidance of plant physiology[M]. 3rd ed. Beijing: Higher Education Press, 2006: 127-130. (in Chinese)
[14] 欧晓华, 罗可可, 邓文静, 张众生, 刘小华, 严寒静. 广藿香化学型分型及形成时期研究[J]. 中成药, 2022, 44(4): 1209-1213.OU X H, LUO K K, DENG W J, ZHANG Z S, LIU X H, YAN H J. Chemotype classification and formation period of Pogostemon cablin[J]. Chinese Traditional Patent Medicine, 2022, 44(4): 1209-1213. (in Chinese)
[15] CHEN Y E, MAO J J, SUN L Q, HUANG B, DING C B, GU Y, LIAO J Q, HU C, ZHANG Z W, YUAN S, YUAN M. Exogenous melatonin enhances salt stress tolerance in maize seedlings by improving antioxidant and photosynthetic capacity[J]. Physiologia Plantarum, 2018, 164(3): 349-363.
[16] 巖学斌, 袁金海. 盐胁迫对植物生长的影响[J]. 安徽农业科学, 2019, 47(4): 30-33.YAN X B, YUAN J H. Effects of salt stress on plant growth[J]. Journal of Anhui Agricultural Sciences, 2019, 47(4): 30-33. (in Chinese)
[17] 张志军, 张桂芝, 王朋朋. 广藿香挥发油的红外光谱鉴定和气相色谱-质谱分析[J]. 中国医药科学, 2015, 5(1): 86-88, 91.ZHANG Z J, ZHANG G Z, WANG P P. Analysis of essential oils of Pogostemonis Herba by FTIR and GC-MS[J]. China Medicine and Pharmacy, 2015, 5(1): 86-88, 91. (in Chinese)
[18] 刘进平, 郑成木. 诱变结合植物组织培养在植物育种中的应用(综述)[J]. 上海农业学报, 2004, 20(1): 19-22.LIU J P, ZHENG C M. Induced mutation in connection with in vitro culture for crop breening[J]. Acta Agriculturae Shangha, 2004, 20(1): 19-22. (in Chinese)
[19] 吳立蓉, 贺红, 张燕玲, 刘星, 林小桦. 60Co-γ射线辐照对广藿香离体培养的影响[J]. 核农学报, 2008, 22(1): 14-17.WU L R, HE H, ZHANG Y L, LIN X, LIN X H. The effect of 60Co-γ irradiation on culture in vitro of Pogostemon cablin (Blanco) Benth.[J]. Journal of Nuclear Agricultural Sciences, 2008, 22(1): 14-17. (in Chinese)
[20] 赵会芳. 辣椒诱变及其诱变机理的研究[D]. 杨凌: 西北农林科技大学, 2005.ZHAO T F. Study on mutagenic effects mechanism of the treatments with different mutagenic on the pepper (Capsicum annuum L.)[D]. Yangling: Northwest A&F University, 2005. (in Chinese)
[21] 贺红, 许仕仰, 吴立蓉, 张燕玲. 广藿香辐射诱变筛选抗病突变体的研究[J]. 广州中医药大学学报, 2012, 29(2): 185-189.HE H, XU S Y, WU L R, ZHANG Y L. Selection of bacterial-wilt-resistance mutants of Pogostemon cablin (Blanco) Benth. by radiation mutation[J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2012, 29(2): 185-189. (in Chinese)
[22] 姚宇, 李娟玲, 李碧英, 罗志平, 李丽辉, 李文革. 广藿香60Co-γ诱变体植株遗传多样性的ISSR分析[J]. 热带生物学报, 2017, 8(3): 277-283.YAO Y, LI J L, LI B Y, LUO Z P, LI L H, LI W G. ISSR analysis of plant genetic diversity of 60Co-γ induced mutants of Pogostemon cablin[J]. Journal of Tropical Biology, 2017, 8(3): 277-283. (in Chinese)
[23] 吴立蓉, 贺红, 张燕玲, 刘丹, 谢建辉, 柴婷婷. 60Co-γ射线对广藿香的辐照诱变及再生植株的RAPD分析[J]. 激光生物学报, 2010, 19(2): 174-178.WU L R, HE H, ZHANG Y L, LIU D, XIE J H, CHAI T T. 60Co-γ ray radiation mutation of Pogostemon cablin (Blanco) Benth. and the RAPD analysis of the regenerated plant[J]. Acta Laser Biology Sinica, 2010, 19(2): 174-178. (in Chinese)
[24] 孟祥才, 李曉颖, 姚杰, 孔玲, 关瑜. 生态胁迫促进道地药材质量形成机制与质量评价思路[J]. 中草药, 2022, 53(5): 1587-1594.MENG X C, LI X Y, YAO J, KONG L, GUAN Y. Mechanism of ecological stress enhancing quality of genuine medicinal materials and its quality evaluation idea[J]. Chinese Traditional and Herbal Drugs, 2022, 53(5): 1587-1594. (in Chinese)
[25] 刘天宝. 不同叶序植物内源细胞分裂素和生长素差异分析[D]. 合肥: 安徽农业大学, 2010.LIU T B. Variance analysis of endogenous cytokinin and auxin in different phyllotaxis plants[D]. Hefei: Anhui Agricultural University, 2010. (in Chinese)
[26] 谈应权, 孔晶晶, 江海洋. 植物叶序发生的分子机制研究进展[J]. 安徽农业大学学报, 2020, 47(6): 1001-1006.TAN Y Q, KONG J J, JIANG H Y. Advances in molecular mechanism of phyllotaxis development in plants[J]. Journal of Anhui Agricultural University, 2020, 47(6): 1001-1006. (in Chinese)

