不同硅铝比电镀污泥烧制陶粒过程中Zn 和Pb 的挥发特性*
李晶晶,张敏娜,李 媛,唐阵武
(1.中化环境修复(上海)有限公司,上海 200235;2.北京化工大学化学工程学院,北京 100029;3.北京金隅红树林环保技术有限责任公司,北京 102402;4.中央民族大学生命与环境科学学院,北京 100081)
0 引言
工业污泥中通常含有多种污染物[1]。烧制陶粒是工业污泥资源化处置的有效方法,该工艺可将重金属固化在陶粒中[2-3]。陶粒原料中SiO2和Al2O3可使陶粒表面在高温下形成釉质层,增强陶粒的硬度[4-5]。成品陶粒可应用于建筑材料及路基材料等[6-7]。
同时,工业污泥烧制陶粒过程中会有一部分重金属发生迁移转化,进入烟气和飞灰,对末端处置造成较大的压力。许多学者对不同污泥烧制过程中重金属挥发进行了探究,发现烧结温度和停留时间对金属挥发的影响较大[8-9]。Lin 等[10]和魏培涛[11]对不同烧结温度下重金属挥发特性进行探究,发现温度升高促进了印染污泥中Pb 的挥发,但对Zn挥发影响较小;在900 ℃下,随着反应时间延长底渣中的Pb 残留量呈下降趋势,而Zn 残留量随着时间延长而逐渐增加。Nowak 等[12]在对污泥进行热处理时发现,800 ℃下Zn 和Pb 的挥发率在10 min 内可达到最大值。张日旭[13]利用XRF 分析方法对重金属挥发机理进行探究,发现随温度升高,Pb 主要受氯化反应影响,底渣中的分布量逐渐减少;1 000 ℃以上时,Zn 与原料中物质发生反应,生成性质稳定的尖晶石结构,抑制Zn 挥发。
研究者对陶粒烧制过程中重金属的固化机理也进行了探究。有学者对污泥进行热处理研究,当烧结温度为1 000 ℃以上时,Zn 可以转化为性质稳定的尖晶石结构存在于底渣中[14-15]。有研究表明,利用电镀污泥制备烧结砖过程中,原料中SiO2在高温下可与重金属生成性质稳定的硅酸盐物质,增强重金属的固化效果,降低重金属的挥发率,使重金属在烧结砖中的分布量增大[16-18]。
针对固体废物热处理过程中重金属污染物排放控制问题,许多学者对重金属的挥发动力学进行了研究。张海军[19]采用等温动力学分析方法,得出飞灰焚烧过程中Cu、Pb 和Cr 的活化能Ea为130~190 kJ/mol。大部分学者主要对粉煤灰热处置、垃圾焚烧等固体废物处置过程中重金属挥发动力学进行分析[20-21],但对于污泥陶粒烧制过程中重金属挥发动力学的研究较少。
目前,我国每年大约产生1.0×107t 电镀污泥[22]。电镀污泥通常含有大量的有毒有害物质,已被列入《国家危险废物名录》,如果处置不当会对周围环境造成严重污染[23-24]。利用电镀污泥烧制陶粒是一种有效的资源化处置方法[25-27]。与其他工业污泥相比,电镀污泥陶粒烧制过程中产生的重金属污染物较多,并且各生产厂家采取的原料配比不同使原料中硅铝比存在较大差异。而电镀污泥陶粒中SiO2和Al2O3不仅是增强陶粒强度的主要成分,而且对重金属的迁移转化影响较大。但目前大多数学者主要对电镀污泥陶粒成品的浸出毒性进行研究,对于电镀污泥烧制陶粒过程中重金属的迁移转化机理和挥发动力学研究较少,尤其是不同工况下硅铝比对重金属迁移转化的影响鲜有报道,缺少电镀污泥烧制陶粒过程中重金属污染物排放控制的理论依据。因此,本研究在实验室条件下模拟电镀污泥烧制陶粒过程,研究不同工况条件下硅铝比对Zn 和Pb 挥发特性及挥发动力学的影响,并结合陶粒矿相组成和微观形貌分析探究Zn 和Pb 的迁移转化机理,以期为电镀污泥烧制陶粒工艺中重金属污染物控制提供科学依据。
1 材料与方法
1.1 实验材料
本研究选取3 种电镀污泥作为烧制陶粒的原料、选取页岩作为配料以调节原料的硅铝比。电镀污泥原料均取自浙江宁波某电镀生产企业、页岩原料取自广东地区某矿山。4 种原料的组成成分如表1 所示。
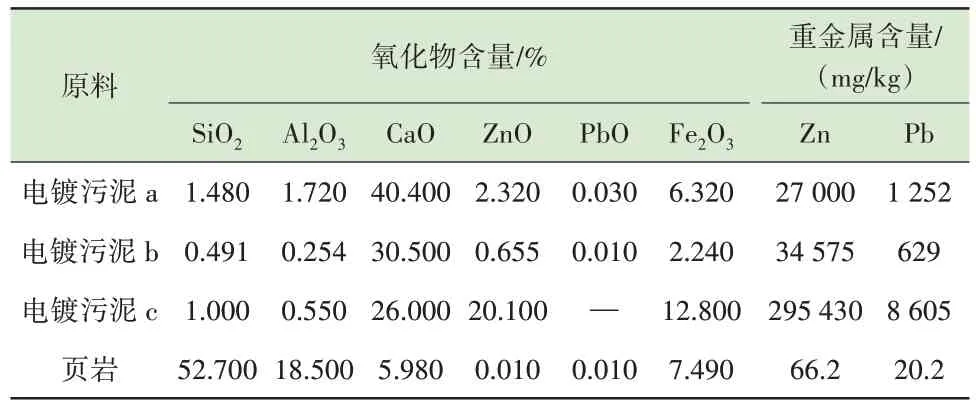
表1 电镀污泥、页岩组成成分分析Table 1 Composition analysis of electroplating sludge and shale
1.2 实验方法
1.2.1 陶粒烧制实验
烧制陶粒所用的实验装置如图1 所示。主要包括供气系统、管式炉加热系统、飞灰过滤系统及尾气收集系统。供气系统是由气罐和转子流量计构成,供应气体为标准合成空气。管式炉加热系统由控温管式炉和刚玉管构成,管式炉温度控制范围为50~1 600 ℃,刚玉管尺寸为φ80 mm×1 200 mm,可耐1 600 ℃高温。飞灰过滤系统由聚四氟乙烯夹具和孔径为0.45 μm 的玻璃纤维滤膜构成。尾气收集系统根据EPA method 29,采用含5%HNO3+10%H2O2的两级吸收液,收集尾气中的气体样品。

图1 实验装置示意Figure 1 Schematic of experimental apparatus
首先将电镀污泥和页岩原料置于105 ℃下烘干24 h,再对原料进行粉磨,过100 目筛。根据3 种电镀污泥和页岩成分分析,将电镀污泥a、b、c 按照质量比为3∶3∶2 混合均匀,再将混合电镀污泥和页岩按照1∶1 进行混合,加入约为混合物质量25% 的去离子水制备低硅铝比生陶粒。将混合电镀污泥、页岩和SiO2按照5∶4∶1 进行混合,加入同样质量的去离子水制备高硅铝比生陶粒。生陶粒粒径为10~20 mm。将陶粒生料置于通风处,风干48 h,使陶粒具有一定的初始强度。每次取20 g 陶粒生料置于瓷舟中,陶粒烧结温度选取700、800、900、1 000、1 150 ℃。待管式炉升温至目标温度后将瓷舟推入恒温区域。连接供气系统,调节转子流量计使气体流量为0.5 L/min。停留时间分别选取8、16、24、32、40 min,烧制完成后将陶粒取出,冷却至室温后密封保存。
1.2.2 重金属含量的测定
原料及陶粒的固体样品经研磨过筛后,称取0.1 g 置于50 mL 的微波消解罐中,再加入8 mL HNO3、2 mL HF 和2 mL H2O2。将消解罐拧紧置于微波消解仪中进行微波消解,升温程序如表2 所示。消解升温程序结束后待冷却至室温,将消解罐取出,置于160 ℃恒温石墨消解仪中赶酸2~3 h。待溶液蒸发至1 mL 左右,将溶液移入100 mL 容量瓶中并用5%HNO3溶液定容。用电感耦合等离子体质谱仪(Agilent 7500a)测定重金属含量。
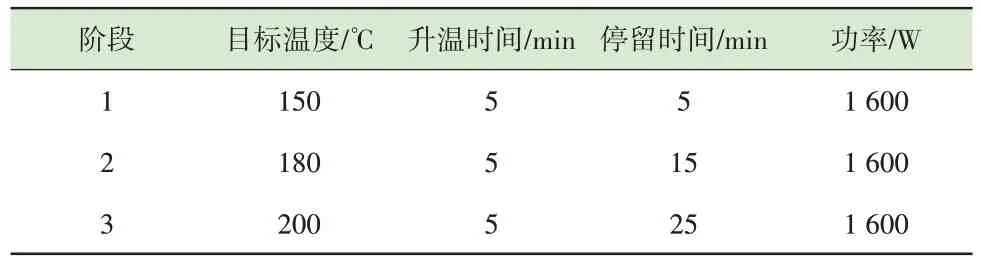
表2 微波消解升温程序Table 2 Microwave digestion temperature program
采用方法空白、重复样和标准物质测定等检验实验测定准确性和精密度。标准物质GBW 07914 中Zn 和Pb 测定的准确率分别为97% 和118%,相对标准偏差分别为10%和8%。Zn 和Pb的检出限分别为0.24 μg/kg 和0.22 μg/kg。
1.3 数据分析
1.3.1 重金属挥发率的计算
测定陶粒烧制前和烧制后重金属含量,由式(1)计算重金属挥发率。
式中:m0为陶粒烧制前的质量,g;c0为陶粒烧制前重金属含量,mg/kg;mt为陶粒经过tmin 烧制后的质量,g;ct为陶粒经过tmin 烧制后的重金属含量,mg/kg。
1.3.2 重金属的挥发动力学
根据Arrhenius 方程式[28],重金属挥发速率可由式(2)计算。

为求得反应级数n、指前因子A和反应活化能Ea,可将式(2)进行求积分,得出式(3),式(3)中G(α)为1/(1-α)n的原函数。选取反应级数n=0、1/2、2/3、1 和2,将G(α)和反应时间t进行线性拟合,可得出不同反应级数下、不同反应温度对应的反应速率常数k。再将反应速率k取对数可得出式(4),将lnk和1/T进行线性拟合,可得出指前因子A和反应活化能Ea。选取线性相关系数最大的拟合方程,确定反应级数n。最终将反应级数n、指前因子A和反应活化能Ea代入式(3)中,即可得出重金属挥发率α关于烧结时间t和烧结温度T的挥发动力学方程。
式中:k为反应速率常数;t为反应时间,min。
2 结果与讨论
2.1 不同硅铝比陶粒中Zn 和Pb 的挥发
本实验设置了两组陶粒原料配比,配比一为电镀污泥∶页岩=1∶1,配比二为电镀污泥∶页岩∶SiO2=5∶4∶1。页岩中SiO2占比为52.7%、Al2O3占比为18.5%,而其他成分含量较少,并且对重金属迁移转化影响较小。因此将配比一称为低硅铝比原料,配比二称为高硅铝比原料。不同硅铝比陶粒烧制过程中Zn 和Pb 的挥发率如图2 所示。
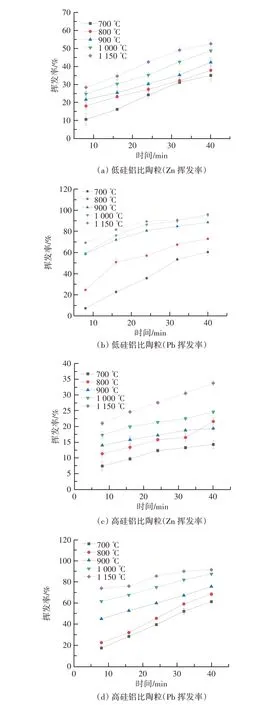
图2 不同硅铝比陶粒烧制过程中Zn 和Pb 的挥发率Figure 2 Volatilization rates of Zn and Pb during sintering of ceramsite with different Si/Al ratios
低硅铝比陶粒烧制过程中,Zn 和Pb 的挥发率随着烧结温度升高和反应时间延长而逐渐增大,如图2(a)和图2(b)所示。当烧结温度为1 150 ℃、停留时间为40 min 时,Zn 和Pb 的挥发率最大,分别为52.62%和95.90%。有研究表明,当温度大于700 ℃时,重金属主要以气态氯化物的形式挥发[29]。温度升高可能促进了Zn 和Pb 与Cl 的结合,从而转化为ZnCl2(g)和PbCl2(g),使Zn 和Pb 的挥发率逐渐增大。有研究发现,700~1 000 ℃下Zn 主要以氧化物形式存在于陶粒中[30],因此Zn 的挥发性较弱。当温度升高至1 150 ℃时,陶粒中含有大量的SiO2和Al2O3可能进一步使部分Zn 和Pb 转化为性质稳定的硅酸盐物质而固化于陶粒中[13]。
高硅铝比陶粒烧制过程中Zn 和Pb 的挥发率如 图2 (c) 和 图2 (d) 所 示。烧 结 温 度 为1 150 ℃、停留时间为40 min 时,Zn 和Pb 的挥发率也最大。相对于低硅铝比,Zn 和Pb 的挥发率分别下降了18.8 个百分点和4.4 个百分点。这主要是由于原料中SiO2占比增大,加强了陶粒中重金属的固化反应,使更多的Zn 和Pb 固化于陶粒中[12]。并且,随着温度升高,SiO2发生熔融现象,产生的玻璃相物质对重金属具有包裹作用,从而抑制了重金属的挥发。其他研究也证实了硅铝比的提高有利于重金属在底渣中的富集[31]。因此,硅铝比提高可明显抑制重金属的挥发。
2.2 Zn 和Pb 的挥发动力学
2.2.1 Zn 挥发动力学
选取5 种常见的反应动力学级数进行拟合,分别为n=0、n=1/2、n=2/3、n=1、n=2。如表3 所示,将不同硅铝比陶粒烧制过程中Zn 在不同温度和不同反应级数下的G(α)和停留时间t代入式(3)中进行线性拟合,得出线性拟合方程和线性相关系数。各拟合方程的线性相关系数均大于0.9,表明拟合效果较好。线性拟合方程中的斜率即为该条件下Zn 的反应动力学常数k,再将不同反应级数下各反应温度T对应的反应动力学常数k代入式(4)中,对lnk和1/T进行线性拟合。低硅铝比下lnk和1/T线性拟合结果表明(表4),反应级数n=2 时,拟合方程的线性相关系数最大。因此,该条件下Zn 的挥发动力学方程符合2 级反应。根据方程中的截距和斜率,可得出lnA=-1.485,Ea/R=2 829.644。经计算可以得出A=0.23 s-1,Ea=23.53 kJ/mol。因此,低硅铝比陶粒烧制过程中Zn 的挥发动力学方程可用式(5)表示。
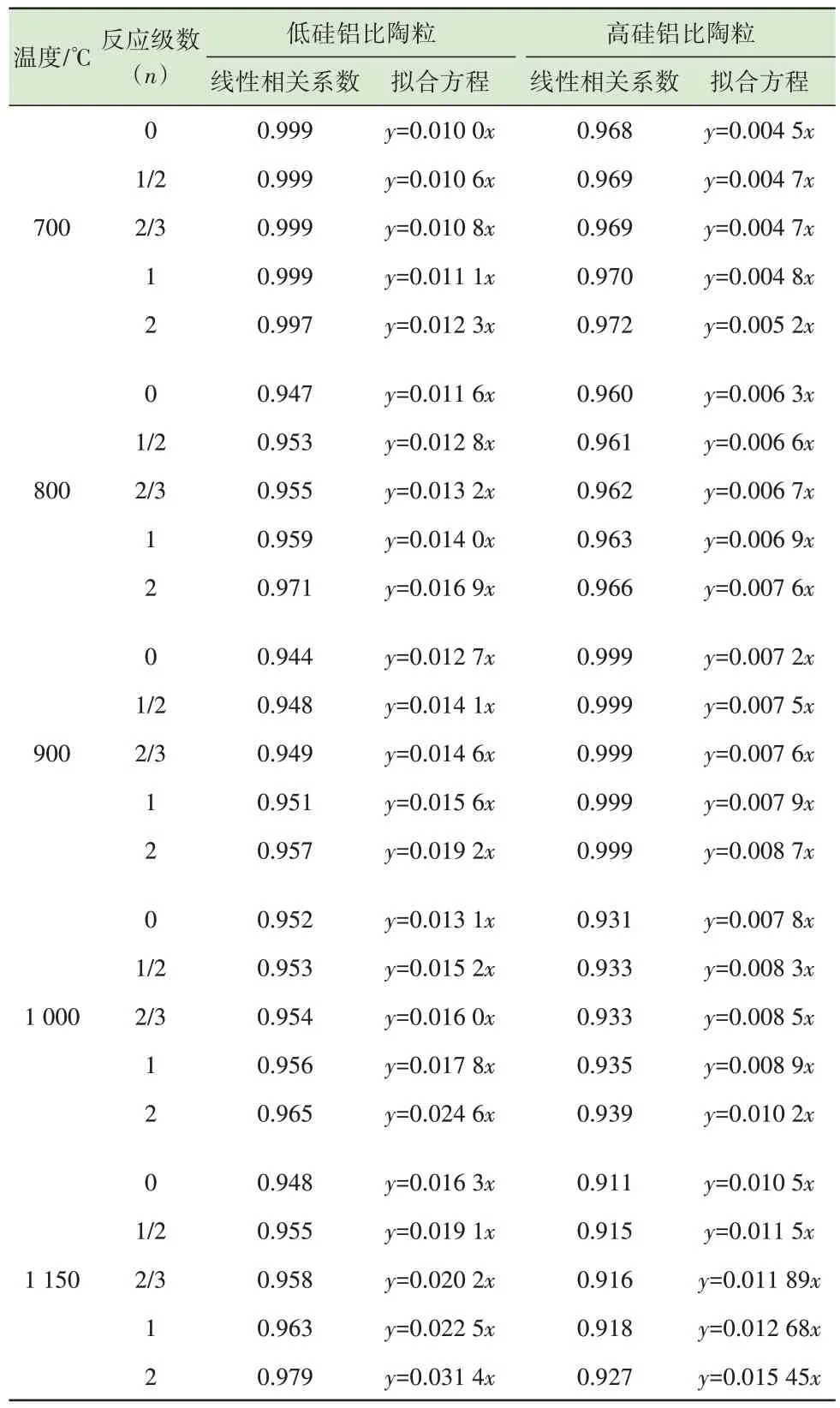
表3 不同硅铝比陶粒烧制过程中Zn 的G(α)与t 线性拟合Table 3 Linear fitting between G(α)and t of Zn during sintering of ceramsite with different Si/Al ratios
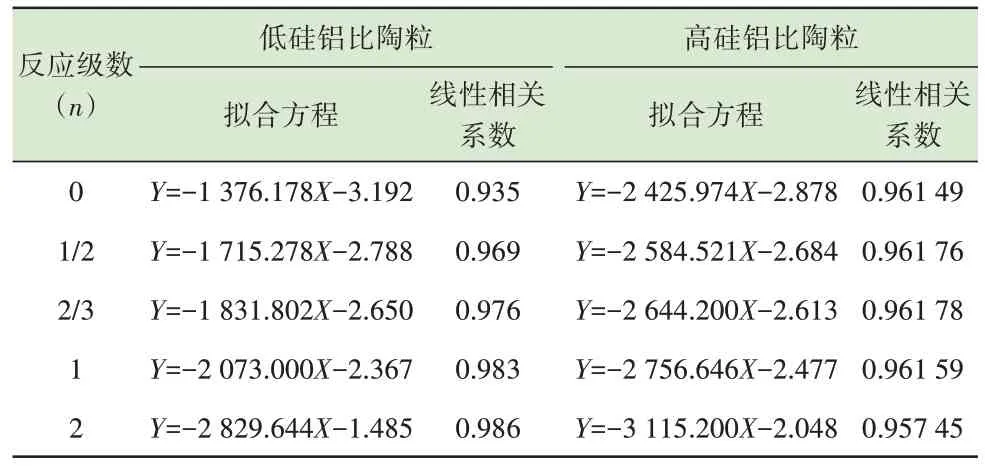
表4 不同硅铝比陶粒烧制过程中Zn 的lnk 与1/T 线性拟合Table 4 Linear fitting between lnk and 1/T of Zn during sintering of ceramsite with different Si/Al ratios
根据高硅铝比时Zn 的lnk与1/T拟合结果可知,反应级数n=2/3 时拟合方程的线性相关系数最大。因此,确定该条件下Zn 的挥发动力学方程符合2/3 级反应。根据拟合方程可计算得出指前因子A=0.07 s-1,反应的活化能Ea=22.0 kJ/mol。因此,高硅铝比陶粒烧制过程中Zn 的挥发动力学方程可用式(6)表示。
根据不同硅铝比下Zn 反应动力学分析结果可知,陶粒原料中硅铝比提高,Zn 挥发动力学分析中反应级数n和反应活化能Ea均下降。
2.2.2 Pb 挥发动力学
将不同硅铝比陶粒烧制过程中不同停留时间下Pb 的挥发率代入式(3)进行线性拟合,结果如表5 所示。由表5 可见,在低硅铝比下,当反应级数为2、烧结温度为700 ℃时,G(α)和t线性拟合的相关系数为0.831。因此,Pb 的反应动力学模型不适合2 级反应。其他拟合方程的线性相关系数均大于0.9,表明拟合效果较好。
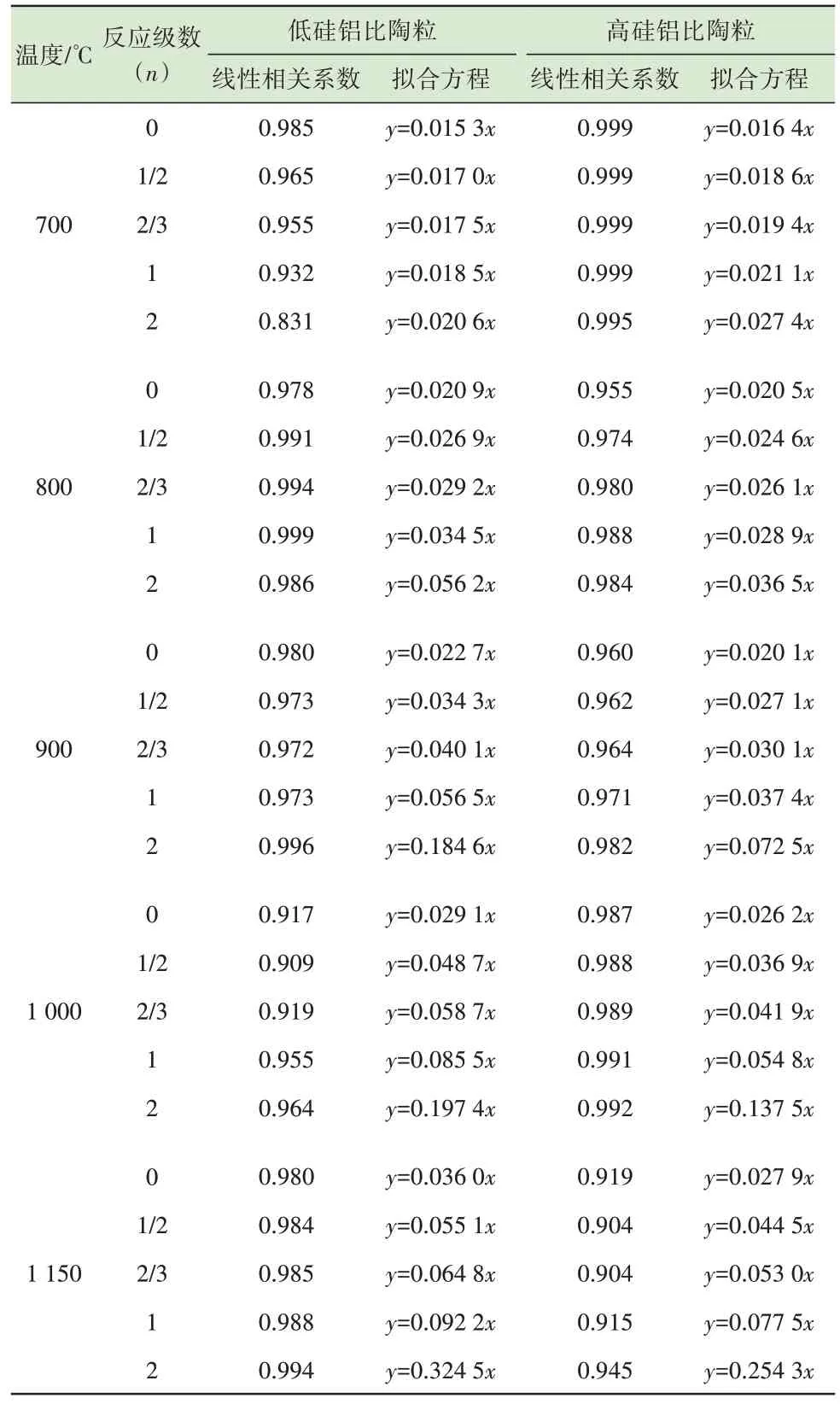
表5 不同硅铝比陶粒烧制过程中Pb 的G(α)与t 线性拟合Table 5 Linear fitting between G(α)and t of Pb during sintering of ceramsite with different Si/Al ratios
再将得出的反应动力学常数k及对应的反应温度T代入式(4)中,对lnk和1/T进行线性拟合。低硅铝比下lnk和1/T线性拟合结果表明(表6),当反应级数n=0 时,线性相关系数最大。因此,可以确定该条件下Pb 的挥发动力学方程符合0 级反应。根据n=0 时得出的拟合方程,经计算得出指前因子A=0.21 s-1,反应的活化能Ea=21.3 kJ/mol。低硅铝比陶粒烧制过程中Pb 的挥发动力学方程可用式(7)表示。
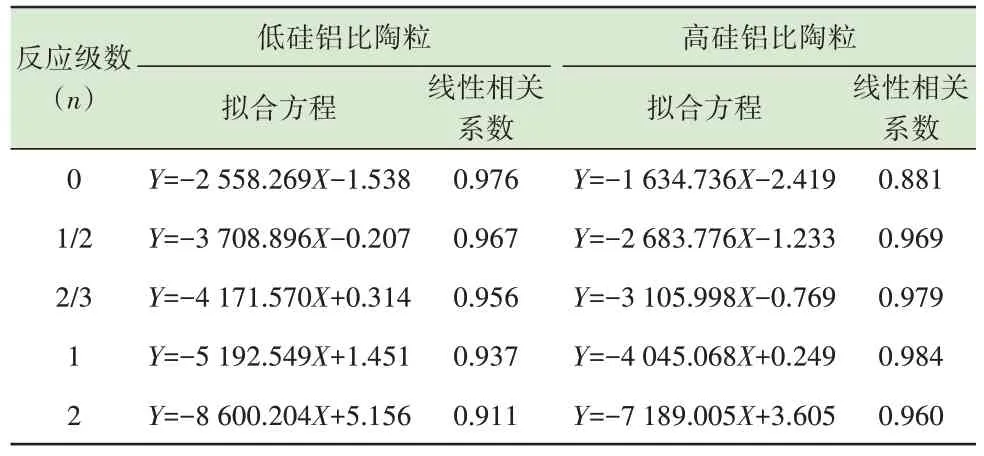
表6 不同硅铝比陶粒烧制过程中Pb 的lnk 与1/T 线性拟合Table 6 Linear fitting between lnk and 1/T of Pb during sintering of ceramsite with different Si/Al ratios
根据高硅铝比时Pb 的lnk与1/T线性拟合结果可知,当反应级数n=1 时,拟合方程的线性相关系数最大。因此,可以确定该条件下Pb 的挥发动力学方程符合1 级反应。根据n=1 时确定的拟合方程,经计算可得出指前因子A=1.23 s-1,反应的活化能Ea=33.63 kJ/mol。高硅铝比陶粒烧制过程中Pb 的挥发动力学方程可用式(8)表示。
根据不同硅铝比下Pb 反应动力学分析结果可知,陶粒原料中硅铝比提高,Pb 挥发动力学分析中反应级数n和反应活化能Ea均提高。
综上,陶粒原料中硅铝比提高,Zn 的反应级数n和反应活化能Ea均下降,Pb 的反应级数n和反应活化能Ea均升高。王昕晔[29]的研究结果表明,活化能Ea主要影响重金属挥发率对温度变化的敏感性。根据Zn 和Pb 反应活化能Ea的大小顺序可知,相较于Zn,在高硅铝比下Pb 的挥发速率对温度变化更敏感。通过对不同硅铝比陶粒烧制过程中重金属挥发动力学进行探究,可得出各重金属挥发动力学方程。根据该方程可为控制电镀污泥烧制陶粒工艺中重金属污染物挥发提供科学指导。
2.3 硅铝比对陶粒微观结构和重金属形态的影响
对烧制前、700 ℃和1 150 ℃下的高硅铝比陶粒和低硅铝比陶粒进行了SEM 分析,结果如图3所示。由图3(a)~图3(c)可知,低硅铝比陶粒在烧制前颗粒呈不规则形状,表面较粗糙,孔隙较小。当温度上升至700 ℃时,颗粒表面出现了熔融现象,颗粒表面变光滑。由于有机物的挥发,孔隙度增加,可能促进了重金属在陶粒内部的扩散。当温度升高至1 150 ℃时,陶粒熔融产生了大量的玻璃相物质,表面非常光滑,颗粒呈规则形状。这与周仕祺等[32]的研究相似。因此,1 150 ℃下陶粒熔融产生的玻璃相物质一方面使陶粒内部孔隙度减小,另一方面对重金属具有包裹作用,能抑制重金属挥发[33-34]。

图3 低硅铝比陶粒和高硅铝比陶粒烧制前、700 ℃、1 150 ℃下的SEM 分析Figure 3 SEM analysis of low Si/Al ratio ceramsite and high Si/Al ratio ceramsite before firing,at 700 ℃and at 1 150 ℃
高硅铝比陶粒的SEM 分析结果如图3(d)~图3(f)所示。陶粒原料硅铝比提高,陶粒烧制前颗粒增多,表面更加粗糙。当烧结温度在700 ℃时,孔隙增大,颗粒物增多,结构松散。当烧结温度为1 150 ℃时,陶粒表面已经完全熔融,非常光滑,颗粒消失。与低硅铝比陶粒相比,高硅铝比陶粒产生的玻璃相物质更多,结构更加紧密。因此,陶粒原料中硅铝比增大,会使陶粒熔融产生的玻璃相物质增多,对重金属的包裹作用增大,减少重金属挥发。
为探究不同硅铝比陶粒烧制过程中重金属的形态转化及挥发机理,对停留时间为40 min、烧结温度分别为700、800、1 150 ℃下烧制的高硅铝比和低硅铝比陶粒进行了XRD 分析,结果如图4所示。
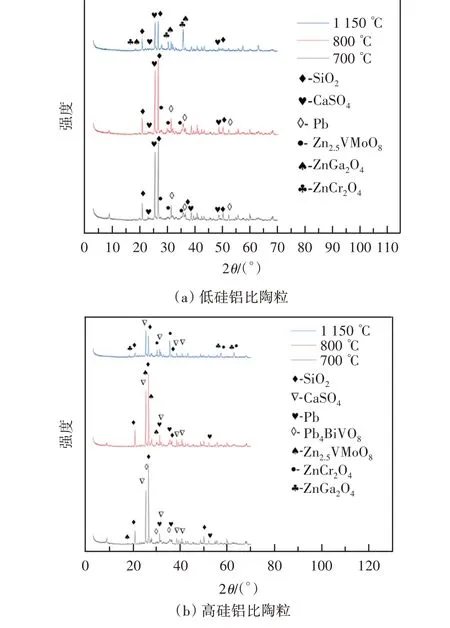
图4 低硅铝比陶粒和高硅铝比陶粒的XRD 分析Figure 4 XRD analysis of low Si/Al ratio ceramsite and high Si/Al ratio ceramsite
低硅铝比陶粒烧制过程中,烧结温度为700 ℃和800 ℃下,Zn 和Pb 主要以Zn2.5VMoO8和Pb 单质存在于陶粒中,如图4(a)所示。可见,700 ℃下一部分重金属转化为性质稳定的氧化物固化于陶粒中,另一部分重金属挥发。当温度由700 ℃上升至800 ℃时,CaSO4和SiO2含量减少。这与王昕晔[29]的热力学计算结果相似。随着温度升高,CaSO4可转化为CaO,SO42+与NaCl 转化为Na2SO4,从而释放出自由氯离子,促进了重金属的挥发。当温度升高至1 150 ℃时,低硅铝比陶粒中物质组成变化较大。Pb 的氧化物和氯化物熔沸点较低,大部分挥发至飞灰和烟气中。然而,Zn 主要以性质较稳定的ZnCr2O4和ZnGa2O4存在于陶粒中,这与汪亚军[35]的研究结果相似。
高硅铝比陶粒烧制过程中,烧结温度为700 ℃和800 ℃时,Zn 和Pb 主要以Zn2.5VMoO8、Pb 单质和Pb4BiVO8存在于陶粒中,如图4(b)所示。当烧结温度升高至1 150 ℃时,未检测到Pb,Zn主要以ZnCr2O4和ZnGa2O4形式固化在陶粒中。与低硅铝比相比,高硅铝比陶粒中重金属形态随温度变化相似。因此,硅铝比提高对重金属的结构转化影响较小。
3 结论
1)电镀污泥陶粒烧制过程中,Zn 和Pb 的挥发率随着温度升高和反应时间延长而逐渐增大,挥发性大小为Pb>Zn。
2)在1 150 ℃下,陶粒中硅铝比增大,陶粒熔融产生的玻璃相物质增多,对重金属的包裹作用增强,能够抑制Pb 和Zn 挥发。此外,陶粒原料中硅铝比对重金属挥发动力学影响较大,硅铝比提高,Zn 挥发动力学分析中反应级数n和反应活化能Ea均下降,Pb 挥发动力学分析中反应级数n和反应活化能Ea均上升。

4)陶粒烧制过程中,随着温度升高,一部分重金属以氧化物的形态存在于陶粒中,另一部分重金属可能与自由氯结合挥发至烟气和飞灰中。由于Pb 的氯化物和氧化物熔沸点较低,高温下陶粒中Pb 分布量较小,而Zn 由于氧化物性质较稳定而在陶粒中分布量较大。

