血清尿酸/白蛋白比值预测ST段抬高型心肌梗死患者PCI术后急性肾损伤的多模型研究
张挺挺 王龙林 王贵平
都昌县人民医院 江西都昌 332600
ST段抬高型心肌梗死(STEMI)已发展为全球心脏病患者病死的主要因素[1]。早期经皮冠状动脉介入治疗(PCI)是临床治疗STEMI的重要手段,可提高患者生存率,降低全因死亡率、复发率。但是因术中造影剂应用、血流动力学恶化等因素,术后常并发急性肾损伤(AKI),可能导致患者短期及长期预后不良[2-4]。因此探讨STEMI患者PCI术后AKI危险因素,尽早识别并给予针对性措施,对患者预后改善至关重要。血清尿酸/白蛋白比值(sUAR)监测可以用来评估机体尿酸代谢状态与肾脏功能,现已被报道为预测AKI的一种新的炎症标志物[5]。高sUAR值可能与高尿酸血症、肾脏疾病等密切相关[6]。然而sUAR对STEMI患者PCI术后并发AKI的预测研究尚不多见。鉴于此,本研究拟通过回顾性收集166例STEMI临床资料,分析患者PCI术后AKI的危险因素,并构建sUAR相关预测模型,旨在为STEMI临床诊疗提供数据支撑。
1 资料与方法
1.1 一般资料
回顾性收集2021年7月—2023年7月都昌县人民医院收治的166例STEMI患者临床资料。纳入标准:①年龄在18岁以上;②符合STEMI临床相关诊断标准[7];③接受PCI术治疗;④基线资料及临床资料完整。排除标准:①错过再灌注时间未行PCI术治疗;②入院24 h内出现死亡;③终末期肾病患者;④伴有恶性肿瘤;⑤严重肝功能不全;⑥临床资料缺失。本研究经医院伦理委员会审核批准。
1.2 急性肾损伤定义
参照KDIGO相关标准[8]:①48 h内血清肌酐发生明显改变,水平升高>26.5 μmol/L;②在已知或推测AKI发生的前7 d内,血清肌酐水平升高较基线值1.5倍以上;③尿量<0.5 mL/(kg·h),持续时间>6 h。3项标准中符合其中任一项即可定义为AKI。根据PCI术后是否发生AKI,将纳入研究的166例对象分为发生组(34例)与未发生组(132例)。分析STEMI患者PCI术后并发AKI危险因素。
1.3 研究方法
收集纳入对象一般资料,包括性别、年龄、BMI、高血压史、糖尿病史、高脂血症史、心肌梗死史、吸烟、饮酒、Killip分级等;实验室指标涵盖NLR(中性粒细胞/淋巴细胞)、血红蛋白、红细胞分布宽度、sUAR、尿素氮、左心室射血分数(LVEF);PCI相关资料包含造影剂剂量及类型、手术时长、多支血管病变等。
1.4 统计学分析
统计分析应用SPSS 26.0。计数资料以例(%)表示,行2检验;符合正态性的计量资料表示为采用t检验,不符合则为M(P25,P75),行非参数Mann-WhitneyU秩和检验;采用单因素Logistic回归、多因素Logistic回归以逐步后退法分析STEMI患者PCI术后并发AKI的独立危险因素。根据危险因素构建风险预测模型,建立ROC曲线分析模型预测STEMI患者PCI术后并发AKI的效能。用rms包绘制列线图模型和校准曲线,利用Rstudio中rmda程序包绘制临床决策曲线。检验水准α=0.05,取双侧。
2 结果
2.1 两组临床相关资料比较
两组对象年龄、高血压、Killip分级、NLR、sUAR、LVEF、造影剂剂量、PCI手术时长、多支血管病变比较,差异有统计学意义(P<0.05),除此外,两组其他资料比较,差异无统计学意义(P>0.05)。见表1。
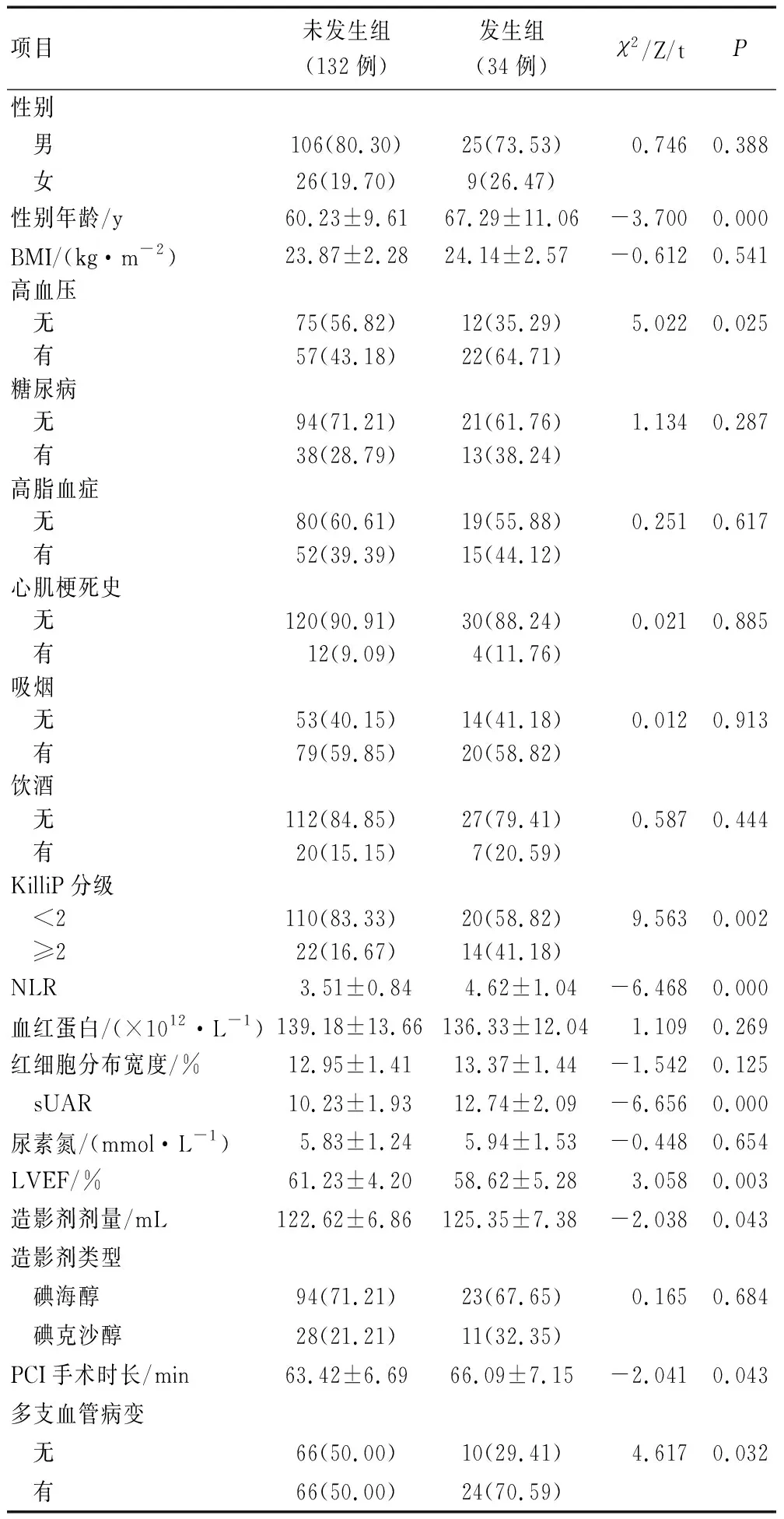
表1 两组临床相关资料比较 [例(%)]
2.2 STEMI患者PCI术后并发AKI的单因素筛选
单因素Logistic回归分析显示,年龄、高血压、Killip分级、NLR、sUAR、LVEF、造影剂剂量、PCI手术时长、多支血管病变为STEMI患者PCI术后并发AKI的相关影响因素(P<0.05),见表2。
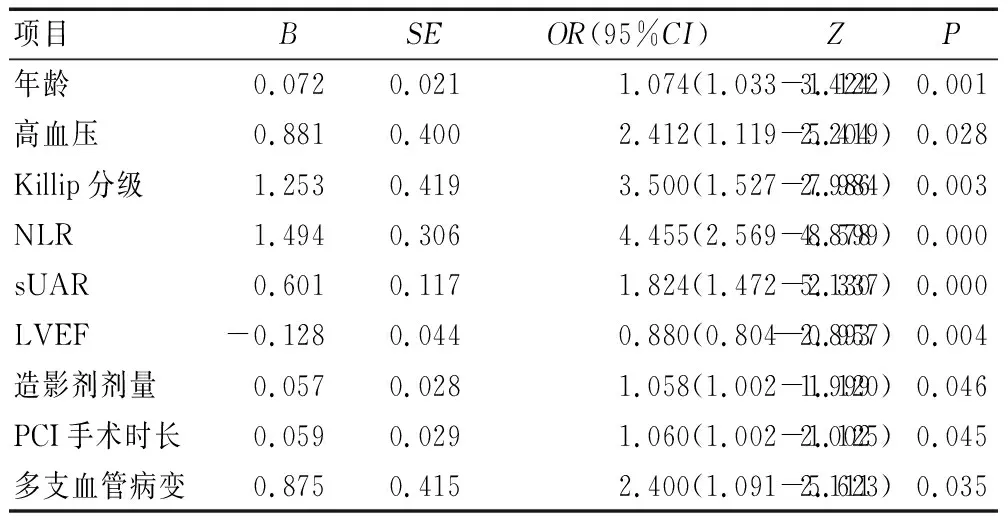
表2 STEMI患者PCI术后并发AKI的单因素Logistic回归分析
2.3 STEMI患者PCI术后并发AKI的多因素Logistic分析
将上述相关因素作为自变量,将组别作为因变量,对变量进行赋值(见表3),纳入多因素Logistic回归模型,分析显示,年龄偏大、Killip分级≥2、NLR升高、sUAR升高、造影剂剂量偏高、PCI手术时长增加为STEMI患者PCI术后并发AKI的独立危险因素(P<0.05)。见表4、图2。
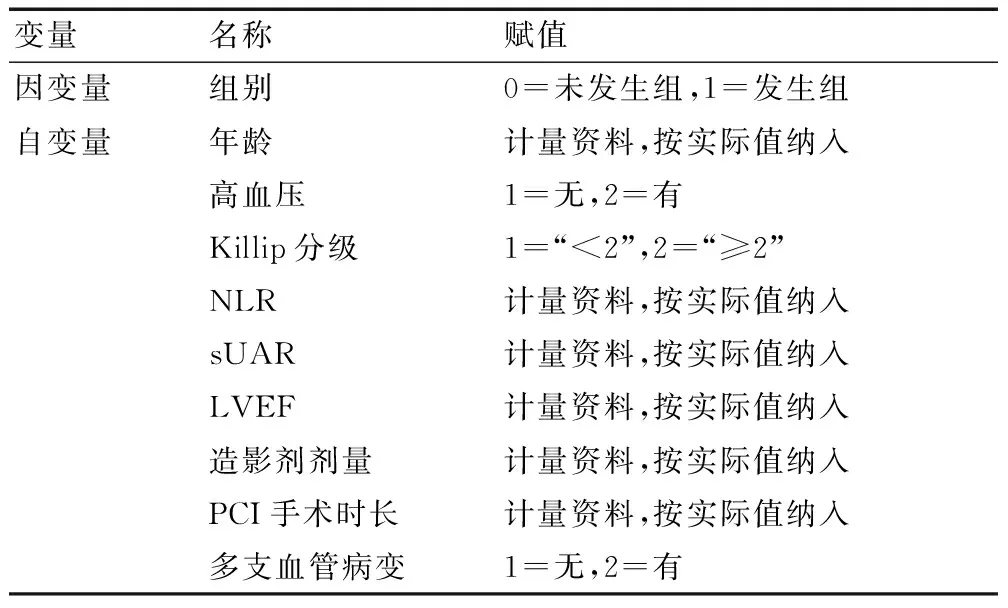
表3 变量赋值

表4 STEMI患者PCI术后并发AKI的多因素Logistic回归分析
2.4 STEMI患者PCI术后并发AKI风险列线图预测模型构建
基于上述多因素Logistic分析结果,依据危险因素构建STEMI患者PCI术后并发AKI风险列线图预测模型,见图1。

图1 STEMI患者PCI术后并发AKI发生风险的列线图
2.5 STEMI患者PCI术后并发AKI风险预测多模型分析
依据列线图风险预测模型得到列线图预测模型指标,分别将NLR、sUAR、“NLR+sUAR”及列线图预测模型指标作为检验变量,并以组别作为状态变量。建立ROC曲线分析各项模型的区分度,结果显示,NLR、sUAR、“NLR+sUAR”及列线图预测模型的AUC分别为0.807(95%CI:0.717~0.897)、0.810(95%CI:0.729~0.892)、0.877(95%CI:0.808~0.946)、0.940(95%CI:0.901~0.979),可知,均对STEMI患者PCI术后并发AKI有较好预测价值。当取cut-off时,各自灵敏度分别为0.853、0.676、0.824、0.882,特异度分别为0.742、0.841、0.811、0.879,见表5与图2。Bootstrap法(B=1 000)对列线图预测模型进行内部验证显示,Bias-corrected预测曲线与Ideal线基本重合,C-index为0.880,该模型预测能力较好,见图3。决策曲线显示,该模型的阈值概率范围为0.01~0.90,其净收益率>0,见图4。

图2 STEMI患者PCI术后并发AKI风险预测多模型ROC曲线
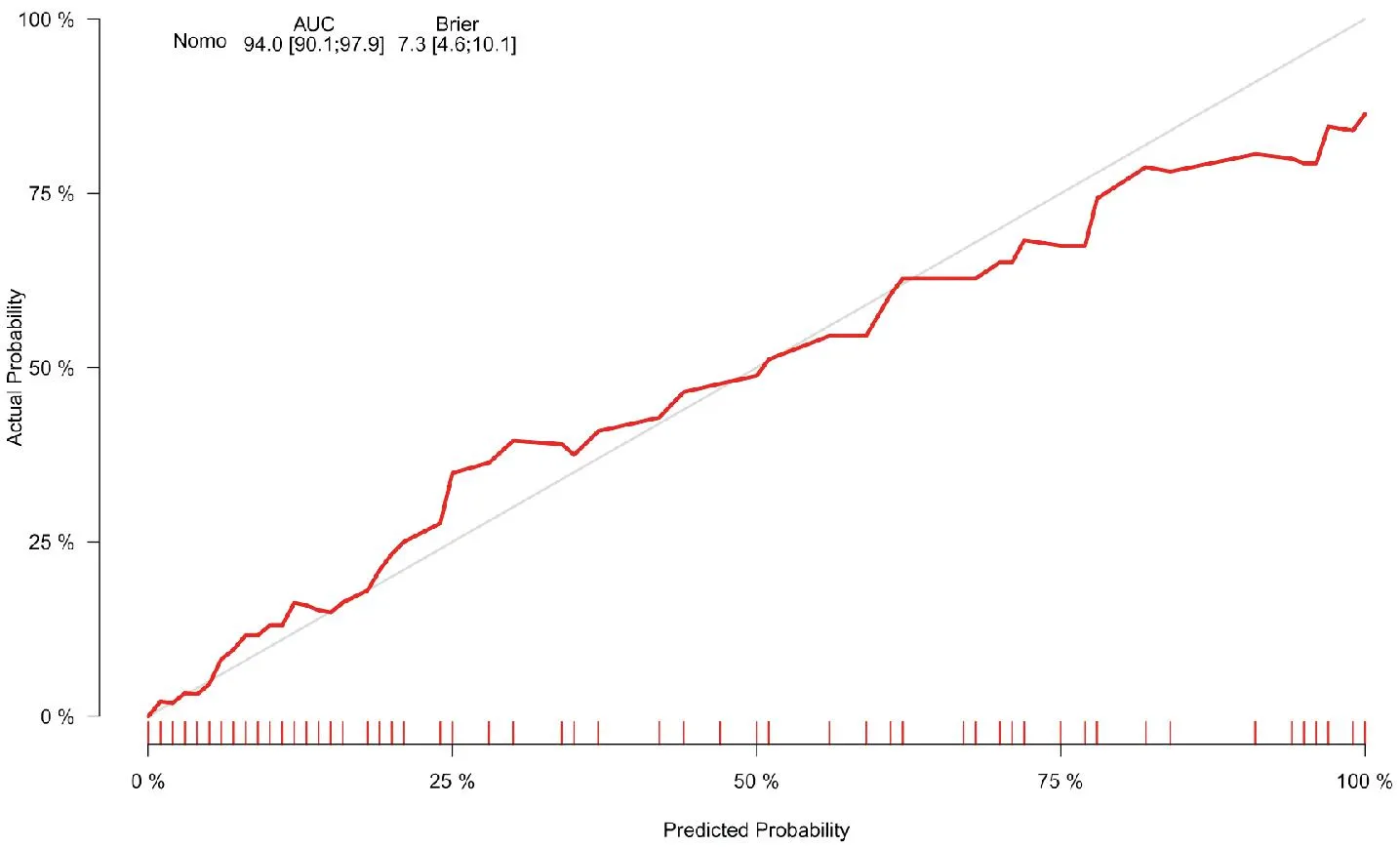
图3 列线图风险预测模型的校准曲线

图4 列线图风险预测模型的决策曲线

表5 STEMI患者PCI术后并发AKI的多因素Logistic回归分析
3 讨论
STEMI是一种临床常见的致死性疾病,多见于老年群体,给患者家庭及社会带来了沉重医疗负担[9]。因此尽早评估、识别STEMI预后不良风险因素,给予针对性措施改善患者预后具有重要临床价值与社会意义。AKI为STEMI患者PCI术常见并发症,使治疗效果受限,近些年如何有效预防PCI术后AKI备受关注[10]。可能由于诊断标准不尽相同,AKI发病率在5%~30%范围[11]。McCoy等[12]研究表明,AKI与患者预后不良以及远期病死率存在关联。本研究发现,166例STEMI患者PCI术后并发AKI有34例,发生率为20.48%,与上述研究发病率范围较为一致。本研究分析STEMI患者PCI术后并发AKI的危险因素发现,年龄偏大、Killip分级≥2、NLR升高、sUAR升高、造影剂剂量偏高、PCI手术时长增加为STEMI患者PCI术后并发AKI的独立危险因素。
随着年龄增长,机体肾脏功能逐渐下降,肾小球滤过率与肾血流量减少,肾小管对药物的排泄能力降低,高龄者更容易发生肾脏损伤。STEMI患者经PCI治疗恢复血流,但年龄偏大者冠状动脉硬化相对更严重,血流恢复不完全,肾脏缺血风险更高[13]。Killip分级≥2提示患者伴有心力衰竭表现。心肾密切相关,存在相互作用,心力衰竭可致心排血量下降,血液到肾脏回流量也减少,引发肾脏灌注不足与肾功能损害[14]。Killip分级≥2患者往往伴有血流动力学不稳定情况,如低血压、低灌注状态等。这些血液动力学改变会导致肾脏灌注不足,降低肾小球滤过率,增加肾脏损伤发生风险,因此Killip分级≥2为STEMI患者PCI术后并发AKI的危险因素。众所周知,炎症反应在STEMI患者PCI术后AKI发生发展中承担着重要作用。NLR(中性粒细胞与淋巴细胞比值)升高是一种炎症指标,与心血管疾病的发展和预后密切相关[15-16]。杨煜华等[2]分析NLR与AMI患者PCI术后对比剂急性肾损伤(CI-AKI)的关系发现,术前较高NLR水平为AMI患者PCI术后CI-AKI的独立危险因素。STEMI患者PCI术后可能引起炎症反应,导致机体炎症介质释放和炎症细胞聚集。NLR升高则反映了中性粒细胞与淋巴细胞比例失衡,中性粒细胞增多提示炎症反应剧烈。也可能会激活氧化应激,引起细胞内氧化损伤,进一步加剧炎症反应,进而增加了AKI发生风险。
sUAR可以反映尿酸排泄情况和肾脏功能。肾功能不全时,尿酸排泄减少,sUAR水平会有明显升高改变。目前未见sUAR预测STEMI患者PCI术后并发AKI的模型研究。血清尿酸作为一种炎症介质,是PCI患者CI-AKI的独立预测因子[17]。血清白蛋白也具备抗氧化特性,可参与炎症反应增加过程,与机体肾功能不全密切相关[18]。zgür等[19]研究表明,sUAR与AKI患者预后相关。Zhang等[20]通过大样本调查2861例接受PCI治疗的STEMI患者发现,CI-AKI发生率与sUAR呈正相关,随着sUAR水平增加而逐步增加,并且sUAR为CI-AKI的独立危险因素。本研究也得到了类似结论,但目前sUAR与STEMI患者PCI术后AKI关联的确切机制尚未明晰,或可从血清尿酸、白蛋白功能角度对这种关联作出解释。①尿酸是嘌呤代谢的最终产物,在生理层面上,其可经抗氧化途径发挥其保护作用,但在某些病理状态下可转化为促氧化剂。既往研究表明,Crawley等[21]人发现尿酸与肾脏疾病患者全因死亡率成U型相关。尿酸水平升高与炎症、内皮功能障碍发生有关[22-23]。②血清白蛋白是一种循环抗氧化蛋白,其合成分泌减少、分解代谢增加均反映了炎症状态。并且,血清白蛋白与血小板活化、聚集的抑制存在关联,这可能增加PCI术后并发AKI风险。③PCI术后并发AKI的病理生理机制是多因素共同作用的过程,其中,骨髓质缺氧、造影剂直接毒性、氧化应激、炎症反应等均在其中承担着重要作用。
造影剂剂量偏高会增加肾脏负担,导致肾小管损伤与肾血流减少。碘负荷会引起肾小管上皮细胞损伤、坏死,导致肾功能下降。高剂量造影剂还会引起肾血流动力学改变,包括肾血流减少与肾血管收缩,进一步加重肾脏损伤,增加AKI发生风险。手术过程过长会导致肾脏缺血再灌注损伤,引起肾功能异常。PCI手术过程中,肾脏血流会受到一定程度中断,这会导致肾脏缺血。当再灌注发生时,肾脏受到氧化应激与炎症反应损伤,致使肾功能恶化。长时间手术过程还会增加术中并发症风险,例如血栓形成和出血等,这些并发症也可能对肾功能产生负面影响。列线图可通过图形化将数字公式呈现,根据每个变量对应点数值求和计算目标事件发生风险。本研究根据上述危险因素构建STEMI患者PCI术后并发AKI风险列线图模型,并建立ROC曲线与NLR、sUAR、“NLR+sUAR”等多项模型进行比较分析,NLR、sUAR、“NLR+sUAR”及列线图预测模型的AUC分别为0.807(95%CI:0.717~0.897)、0.810(95%CI:0.729~0.892)、0.877(95%CI:0.808~0.946)、0.940(95%CI:0.901~0.979),可知列线图预测模型相较于单项对PCI术后AKI有更高预测价值,敏感度与特异度均较高。并且内部验证以及决策分析显示,该模型预测能力较好且收益率较高,这些提示该列线图预测模型良好且稳定的预测效能,适用于接受PCI的STEMI患者。列线图模型因直观、简单显著特征,临床现已广泛应用于患者终点事件发生风险评估与预测。与单一生物标志物相比,同时确定几种快速可用且可靠的生物标志物更具临床意义。临床可借助列线图模型快速、简便地评估AKI发生风险,进行风险分层,针对高风险者尽早给予预防性治疗指导措施,以减少AKI发生。
综上,本研究依据单中心、回顾性病例资料数据,根据危险因素构建了一个风险预测模型并予以验证,用于评估预测接受PCI术的STEMI患者术后AKI发生风险。该列线图应用有助于制定个体化治疗方案,然而在不同地理位置或者医疗机构中,仍有待进一步进行验证、独立评估,以便指导临床管理与实践。

