Fam172a 基因敲除加剧非酒精性脂肪性肝病的机制研究
李梦绮 ,韦何锐 ,安稳 ,罗婧 ,何玲玲 ,杨君茹 ,肖凡,魏红山,Δ
1首都医科大学附属北京地坛医院消化科 北京市,100015
2北京大学地坛医院教学医院消化科 北京市,100015
3首都医科大学附属北京地坛医院传染病研究所,新发突发传染病研究北京市重点实验室 北京市,100015
4北京市感染性疾病研究中心 北京市,100015
5国家传染病医学中心,首都医科大学附属北京地坛医院 北京市,10015
6传染病溯源预警与智能决策全国重点实验室 北京市,100015
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD) 是指从非酒精性脂肪肝(non-alcoholic fatty liver,NAFL) 到非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH) 的一系列肝脏异常[1]。NASH 是NAFLD 严重的临床形式,其特征是肝细胞脂质堆积、炎症、损伤和凋亡,在极端情况下可进展为肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)[1-3]。目前,NAFLD 已是全球最常见的慢性肝病,全球患病率约为25.24 %[4-7]。随着过去二十年间中国居民生活方式的巨大改变,NAFLD 也已成为中国最常见的肝脏疾病,全国患病率约为29.2 %,但却未得到足够的重视[8]。
NAFLD 的发病机制和临床表现均具有高度异质性[9],其致病途径包括: 内质网应激、脂质代谢紊乱、氧化应激、胰岛素抵抗、炎症、纤维化、自噬和细胞凋亡等[10]。目前NAFLD 的发病机制仍未完全阐明,但随着研究的深入,越来越多研究表明内质网应激(endoplasmic reticulum stress,ERS)对NAFLD 的发病与进展至关重要,其可通过诱导肝脏胰岛素抵抗、脂质积累、炎症和肝细胞凋亡来参与NAFLD 的发生发展[11-14]。
Fam172a基因,又名C5orf21,位于染色体5 q15,由李连喜团队首次发现并克隆,该基因在许多组织中正常表达(在脂肪和主动脉组织中的表达量最高)[15-16]。FAM172A 蛋白在小鼠与人类中具有高度同源性,均含有4 个功能区域: Arb2 样结构域(domain homologous to yeast argonaute-binding protein 2,Arb2 like domain)、丝氨酸水解酶基序(esterase-like serine hydrolase motif,Ser hydrolase)、C 端内质网驻留信号肽(endoplasmic reticulum retention signal,ER signal) 和核定位信号肽(nuclear localization signal,NLS)[17]。由 于Fam172a基因是一个新发现的基因,功能尚不明确,因此目前针对该基因的研究主要涉及动脉粥样硬化、肿瘤及基因转录后水平调控等方面[17-19]。本课题组在前期研究中成功制备了Fam172a基因敲除(Fam172a-/-) 小鼠[20],并通过研究发现Fam172a基因敲除可加重内质网应激诱导的NAFLD[21]。然而,Fam172a基因敲除在ESR 诱导的NAFLD 中的作用机制尚未明确,本文通过衣霉素(tunicamycin,TM) 诱导的野生型(wild type,WT) 小鼠和Fam172a基因敲除(Fam172a-/-)小鼠ERS 模型研究了Fam172a基因敲除在ESR 诱导的NAFLD 中潜在的作用机制[21]。
1 材料与方法
1.1 实验动物
野生型(wild type,WT) 小鼠采用购自于北京华阜康生物科技有限公司的C57BL/6J 背景的小鼠。Fam172a基因敲除(Fam172a-/-) 小鼠由中国南京大学动物模型研究中心利用C57BL/6J 背景的小鼠构建,基因敲除方法参照相关文献[20]。选取 6~8 周龄的雄性野生型 (WT) 和Fam172a-/-小鼠进行科学研究。所有小鼠均在标准条件(环境温度20 ℃~25 ℃和环境湿度50 %~60%) 下饲养,自由进食、饮水并定期更换鼠笼和垫料。所有动物实验均由首都医科大学实验动物学系及首都医科大学附属北京地坛医院动物保护与使用委员会批准。
1.2 药物与试剂
衣霉素(tunicamycin,TM)、蛋白酶抑制剂、磷酸酶抑制剂Ⅰ、磷酸酶抑制剂Ⅱ、NF-κB 抑制剂DHMEQ (美国MCE 公司),组织/细胞甘油三酯测定试剂盒、RIPA 裂解液、一抗稀释液(中国普利莱公司),血浆丙氨酸氨基转移酶测定试剂盒、血浆天冬氨酸氨基转移酶测定试剂盒(中国迈克生物有限公司),5 × 蛋白上样缓冲液(含DTT)(北京索莱宝公司美国),PierceTMBCA 蛋白定量试剂盒、PageRulerTM预染蛋白分子量标准、20 ×SDS 电泳缓冲液、蛋白预制胶 (美国Thermo 公司),甘氨酸(中国索莱宝公司),Tween (中国GPC 生物公司),脱脂奶粉(美国BD 公司),β-Actin 抗体、pNF-κB 抗体、NF-κB 抗体 (美国CST 公司),CHOP 抗体、GRP78 抗体(美国Proteintech 公司),山羊抗小鼠IgG 辣根过氧化物酶抗体、山羊抗兔IgG 辣根过氧化物酶抗体(中国中杉金桥公司),化学发光液(中国美仑生物公司),非变性组织/细胞裂解液 (中国索莱宝公司),胎牛血清 (美国Gibco 公司),多聚甲醛(4 %) (中国塞维尔公司),Tris·HCl 粉末牛血清白蛋白(美国Sigma 公司),Protein A/G PLUSAgarose (美国Santa Cruz 公司),NaCl 粉末、无水甲醇(中国普利公司)。
1.3 主要仪器
低温高速离心机、低温梯度离心机、96 孔酶标仪、实时荧光定量PCR 仪(ABI 7500) (Thermo公司),常温高速离心机(艾本德公司),冰冻研磨机(赛维尔公司)、组织脱水机(TP1020)、组织包埋机(EG1160)、石蜡切片机(徕卡公司),倒置显微镜(蔡司公司),Tanon 发光成像工作站(天能科技有限公司),全自动生化检测分析仪(Olympus 公司),超净工作台(苏坤实业有限公司)。
1.4 动物分组与处理
C57BL/6J 雄性小鼠 (8 周龄,体重25.0 ±1.5 g) 20 只,随机分为5 组,每组4 只,分别为WT-Control 组 (WT 小鼠腹腔注射1 mg/kg DMSO)、WT-TM 组 (WT 小鼠腹腔注射1 mg/kg TM)、Fam172a-/--Control 组 (Fam172a-/-小 鼠腹腔注射1 mg/kg 1 × PBS)、Fam172a-/--TM 组(Fam172a-/--小鼠腹腔注射 1 mg/kg TM)、Fam172a-/--TM+NF-κB 抑制剂 DHMEQ 组(Fam172a-/-小鼠同时腹腔注射1 mg/kg TM 和4 mg/kg DHMEQ)。造模24 h 后,麻醉小鼠,球后取血,然后处死小鼠,留取肝脏组织。
1.5 肝脏生物化学指标的检测
使用Olympus AU 2700 全自动生化分析仪和相应的检测试剂盒,检测小鼠血浆的丙氨酸氨基转移酶(alanine aminotransferase,ALT) 和天冬氨酸氨基转移酶(aspartate aminotransferase,AST) 水平。
1.6 肝脏苏木素&伊红染色(hematoxylin-eosin staining,H&E)
将留取的肝左叶固定于4 %多聚甲醛,脱水包埋后,于首都医科大学附属北京地坛医院病理科进行切片(厚度为4 μm) 和HE 染色。
1.7 肝脏油红O 染色
将留取的肝组织固定于4 %多聚甲醛,于北京塞维尔有限公司进行标本包埋和油红O 染色。
1.8 蛋白质印迹实验(Western blotting,WB)
肝组织加入RIPA 裂解液后利用冰冻研磨机充分裂解,将所得组织裂解液离心(4 ℃,12 000 r/min,10 min) 后取上清,上清液即为组织总蛋白原液,测定其蛋白浓度。取40~80 μg 变性总蛋白经预制胶电泳(浓缩胶: 80 V,分离胶: 120 V) 分离目的蛋白,转膜(100 V,90 min) 并封闭(5 %脱脂奶粉,室温1 h)。分别加入一抗GRP78 (1 ∶1 000)、p-NF-κB (1 ∶500)、NF-κB (1 ∶1 000)、CHOP (1∶1 000) 和β-Actin (1∶1 000) 于4 ℃孵育过夜,1 × TBST 洗膜10 min,重复3 次后,分别加入相应二抗(1 ∶5 000) 室温孵育1 h,1 ×TBST 洗膜5 min,重复3 次后,显色曝光。利用Image J 软件对成像条带进行灰度值分析,并利用GraphPad Prism 8.0 软件对结果进行统计学分析并作图。
1.9 统计学分析
所有实验数据采用GraphPad Prism 8.0 软件进行统计分析及绘图,计量资料均采用表示,且均要进行方差齐性检验和非参数检验,两组独立数据之间采用独立样本t检验,3组及以上数据采用单因素方差分析 (one-way ANOVA),P<0.05 表示差异显著具有统计学意义。
2 结果
2.1 Fam172a 基因敲除加重内质网应激诱导的NAFLD
为了对比TM 造模后WT 小鼠和Fam172a-/-小鼠肝功能的情况,我们对小鼠血清ALT 和AST水平进行检测。结果如图1 所示,在WT 小鼠中,与Control 组相比,TM 组小鼠的血清ALT 水平明显升高(P<0.01);在Fam172a-/-小鼠中,Control 组和TM 组小鼠的血清ALT 水平无明显差异;无论是在TM 组还是Control 组,Fam172a-/-小鼠的血清 ALT 水平均较 WT 小鼠明显升高(P<0.01)。在WT 小鼠和Fam172a-/-小鼠中,与Control 组相比,TM 组小鼠的血清AST 水平均明显升高(P<0.05 或P<0.01);无论是在TM 组还是Control 组,Fam172a-/-小鼠的血清AST 水平均较WT 小鼠明显升高(P<0.01)。
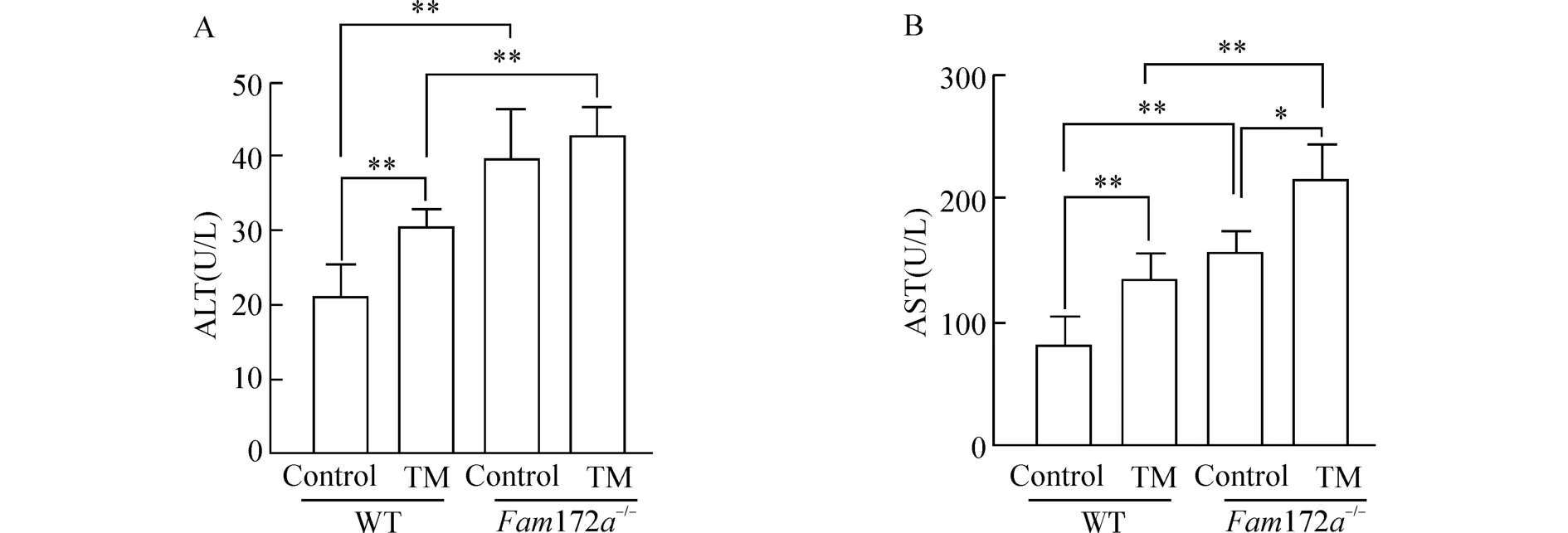
图1 TM 造模后,各组小鼠血浆ALT 和AST 水平
为了进一步了解TM 造模后WT 小鼠和Fam172a-/-小鼠肝脏损伤和脂质堆积水平,我们对小鼠肝脏进行HE 染色、油红O 染色。结果如图2 所示,将WT 小鼠和Fam172a-/-小鼠的TM 组与Control 组两两进行比较,HE 染色结果提示在WT小鼠和Fam172a-/-小鼠中,与Control 组相比,TM 组小鼠肝脏气球样变、坏死和汇管区炎症均明显加重,Fam172a-/--TM 组小鼠较WT-TM 组加重更为显著;肝脏油红O 染色结果提示在WT 小鼠和Fam172a-/-小鼠的肝脏中,TM 组小鼠肝脏脂质堆积均较Control 组更明显,且无论是在TM 组还是Control 组,Fam172a-/-小鼠肝脏脂质堆积均较WT 小鼠更为严重。以上结果表明,Fam172a基因敲除加重ERS 诱导的肝损伤和脂质堆积。
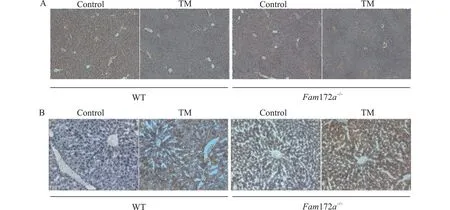
图2 TM 造模后,各组小鼠肝脏炎症和脂质堆积水平
为了研究Fam172a基因敲除影响TM 诱导的小鼠ERS 模型的分子机制,我们利用WB 方法检测WT 和Fam172a-/-小鼠肝脏FAM172A 和ERS通路关键分子(GRP78 和CHOP) 的蛋白质水平。结果如图3 所示,FAM172A 蛋白在Fam172a-/-小鼠肝脏中几乎没有表达,说明Fam172a-/-小鼠已成功敲除Fam172a基因;且在WT 小鼠中,TM 组较Control 组小鼠肝脏中的FAM172A 蛋白表达显著上调(P<0.01)。与Control 组相比,TM 组小鼠肝脏中的GRP78 和CHOP 表达水平均显著上调(P<0.05、P<0.01)。Fam172a-/-小鼠与WT 小鼠相比,Control 组之间GRP78 和CHOP 表达水平无明显差异,而Fam172a-/--TM 组的GRP78 和CHOP表达水平显著高于WT-TM 组 (P<0.05、P<0.01)。以上结果表明,Fam172a基因敲除后会上调ERS 通路的关键分子。
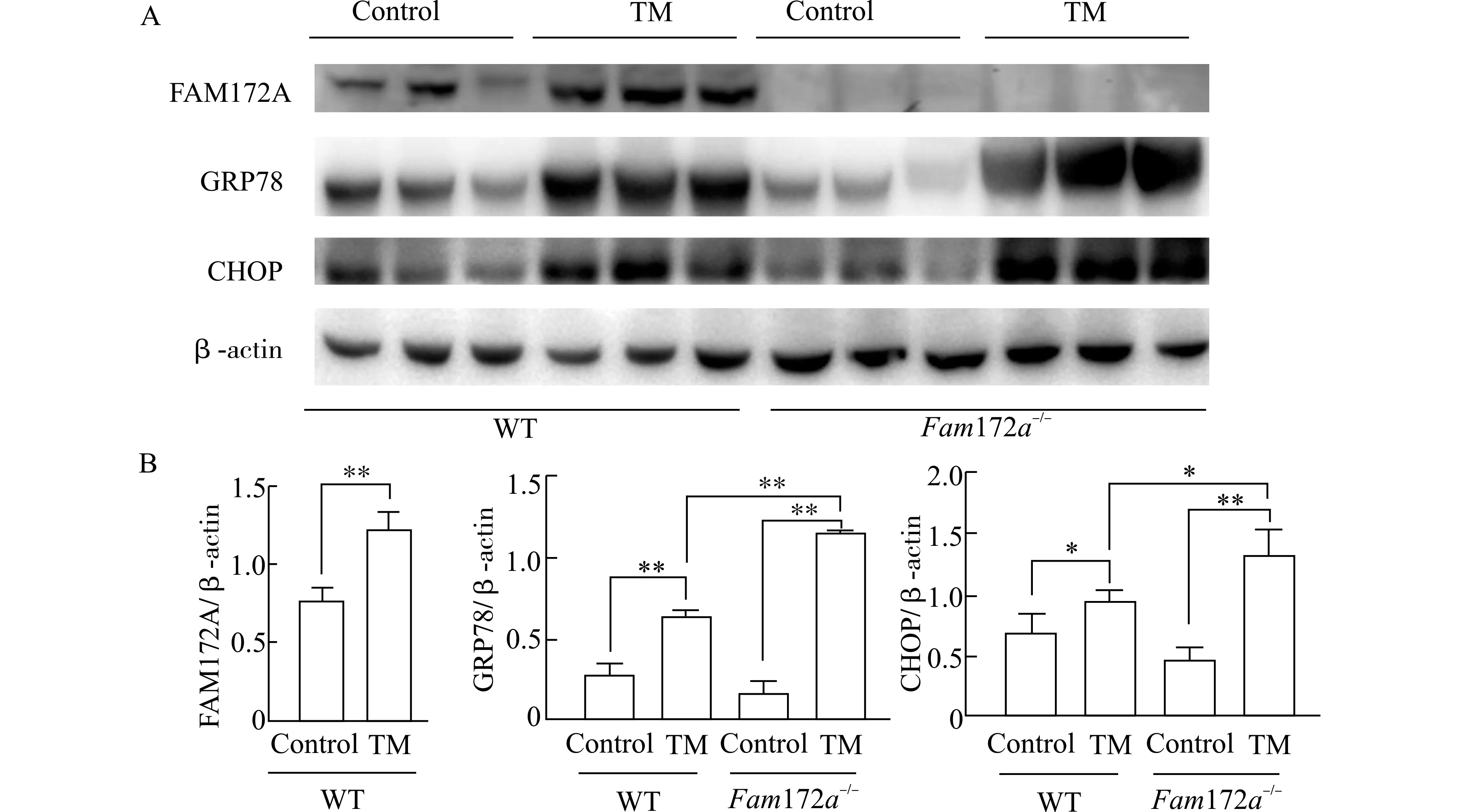
图3 TM 造模后,各组小鼠肝脏中FAM172A、GRP78 和CHOP 的表达情况
2.2 Fam172a 基因敲除活化NF-κB 通路
NAFLD 经典的“二次打击假说” 认为肝脏炎症可导致NAFLD 的进展,而NF-κB 是调节炎症最重要的转录因子[2,22-23]。为了进一步探讨Fam172a基因敲除对NF-κB 的影响,我们利用WB 方法检测WT 和Fam172a-/-小鼠肝脏pNF-κB 和NF-κB的蛋白质水平。
结果如图4 所示,在WT 小鼠中,与Control 组相比,TM 组小鼠肝脏中pNF-κB/NF-κB 的相对水平稍有增加,但无显著性差异。在Fam172a-/-小鼠中,与Control 组相比,TM 组小鼠肝脏中的pNF-κB/NF-κB 的相对水平显著上调(P<0.01)。Fam172a-/-小鼠与WT 小鼠相比,Control 组之间pNF-κB/NF-κB 的相对水平无明显差异,而Fam172a-/--Tm 组的pNF-κB/NF-κB 的相对水平显著高于WT-Tm 组(P<0.01)。
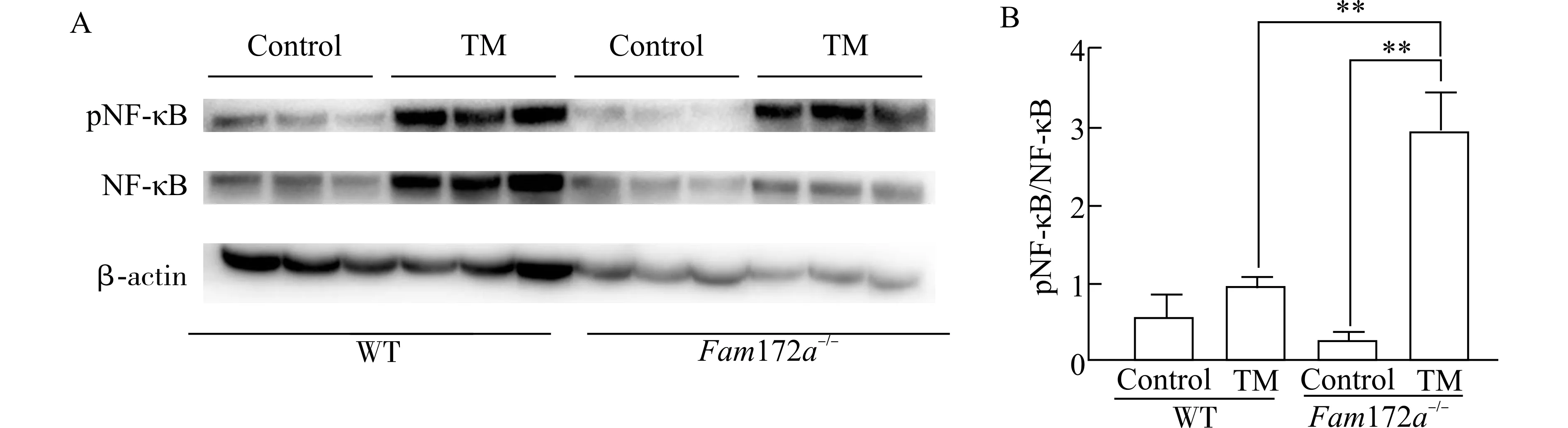
图4 TM 造模后,各组小鼠肝脏中pNF-κB 和NF-κB 的表达情况
2.3 NF-κB 介导Fam172a -/- 小鼠中内质网应激诱导的NAFLD
为了研究Fam172a基因敲除是否通过NF-κB 来介导Fam172a-/-小鼠中内质网应激诱导的NAFLD,我们利用NF-κB 抑制剂DHMEQ 对Fam172a-/-小鼠进行处理,并检测Fam172a-/--TM 组和Fam172a-/--TM+DHMEQ 组小鼠血浆的ALT、AST 水平。结果发现,与Fam172a-/--TM 组相比,Fam172a-/--TM +DHMEQ 组小鼠血浆的ALT 水平显著降低(P<0.05),AST 水平无明显变化(图5)。
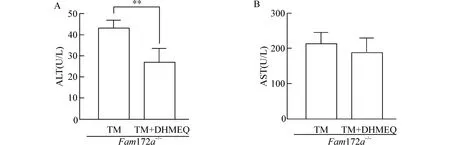
图5 Fam172a -/-小鼠TM 造模后,TM 组和TM+DHMEQ 组小鼠血浆ALT 和AST 水平
为了进一步了解NF-κB 抑制剂DHMEQ 处理对TM 造模后Fam172a-/-小鼠肝脏损伤和脂质堆积水平的影响,我们对Fam172a-/--TM 组和Fam172a-/--TM+DHMEQ 组小鼠肝脏进行H&E染色、油红O 染色和肝脏TG 含量检测。结果如图6 所示,HE 染色结果提示与Fam172a-/--TM 组小鼠相比,Fam172a-/--TM +DHMEQ 组小鼠肝脏气球样变、坏死和汇管区炎症明显减轻;肝脏油红O染色结果提示,Fam172a-/--TM +DHMEQ 组肝脏脂质堆积较Fam172a-/--TM 组改善。以上结果表明,急性ERS 模型中,NF-κB 抑制剂缓解了Fam172a基因敲除引起的肝损伤和脂质堆积的加重。
为了研究NF-κB 影响Fam172a-/-小鼠中ERS模型的分子机制,我们利用WB 方法分别检测Fam172a-/--TM 组和Fam172a-/--TM+DHMEQ组小鼠肝脏ERS 通路关键分子(GRP78 和CHOP)的蛋白质水平。
结果如图7 所示,与Fam172a-/--TM 组相比,Fam172a-/--TM+DHMEQ 组小鼠肝脏中的GRP78和CHOP 表达水平均显著降低(P<0.01),即NFκB 抑制剂可逆转Fam172a基因敲除引起的ERS 通路关键分子的上调。
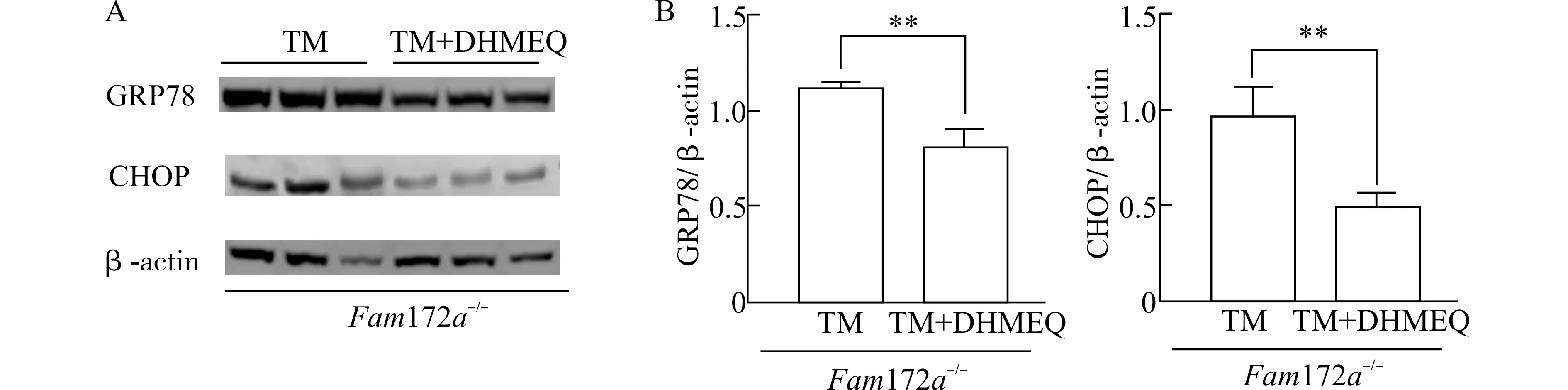
图7 Fam172a -/-小鼠TM 造模后,肝脏中GRP78 和CHOP 的表达情况
3 讨论
NAFLD 的发病机制复杂,经典的“二次打击假说” 和“多重打击假说” 体现了肝脏炎症和内质网应激在NAFLD 发生发展中的重要作用[2,22,24]。近年来也有文献报道了抑制肝脏炎症和内质网应激可能是治疗NAFLD 的有效策略[24-25]。本研究探讨了Fam172a基因敲除在ESR 诱导的NAFLD 中的潜在作用机制。实验结果发现抑制NF-κB 通路可以通过减轻内质网应激来改善Fam172a基因敲除小鼠的NAFLD。
在本研究中,我们通过给小鼠腹腔注射TM 建立了ERS 模型。实验结果发现TM 诱导的ERS 模型小鼠的肝脏中FAM172A 和ERS 通路关键分子(GRP78 和CHOP) 的蛋白表达水平均显著升高,且在Fam172a-/-小鼠中升高更为明显,因此Fam172a基因是ERS 诱导的NAFLD 损伤的负反馈调节因子,与本课题组前期结果一致[21]。
NF-κB 是一种与炎症、自身免疫性疾病、细胞凋亡和肿瘤发生等过程有关的转录因子,在许多细胞中均有表达[23,25]。许多研究表明NF-κB 可通过调控肝脏炎症促进NAFLD 的进展[2,25-27]。由于Fam172a基因敲除和NF-κB 均可促进NAFLD 的进展,我们推测Fam172a基因和NF-κB 之间可能存在某种联系。有文献报道ERS 可以通过多种机制激活NF-κB 通路引起炎症反应,且ERS 可以通过激活NF-κB 通路来影响NAFLD 的进展[12,24,28]。因此本研究假设Fam172a基因敲除通过活化NF-κB通路加重ERS 诱导的NAFLD。为了探究Fam172a基因敲除对NF-κB 的影响,我们利用WB 方法检测WT 和Fam172a-/-小鼠肝脏pNF-κB 和NF-κB的蛋白质水平。实验结果显示,在Fam172a-/-小鼠中,TM 诱导的ERS 模型小鼠肝脏中pNF-κB/NF-κB 的相对水平显著升高。该实验结果表明,NF-κB 是Fam172a 的下游靶分子。2022 年明 少雄[29]报道了草酸盐可通过ERS-ROS-NF-κB 信号通路诱导肾小管上皮细胞凋亡,且NF-κB 信号通路被抑制时,ERS-ROS 通路也被抑制,说明ERS 通路和NF-κB 通路之间存在正反馈循环。董晓飞[30]同样报道了NF-κB 抑制剂QNZ 可以抑制ERS 和NF-κB信号转导。由此看来,抑制NF-κB 通路能够有效地抑制ERS。由此本研究进一步假设抑制NF-κB 通路可以减轻ERS 诱导的NAFLD。为了验证这一猜想,本研究利用NF-κB 抑制剂DHMEQ 处理Fam172a-/-小鼠,实验结果显示在Fam172a-/-小鼠中,经DHMEQ 处理后的TM 造模小鼠肝脏的NAFLD 相关表型显著改善,ERS 通路关键分子(GRP78 和CHOP) 的表达水平也显著降低。以上结果证实,抑制NF-κB通路可以减轻Fam172a基因敲除诱导的NAFLD,其机制主要是抑制ERS。
本课题组前期研究发现,Fam172a基因敲除可加重ERS 诱导的NAFLD,而本文则重点研究了Fam172a基因敲除在ESR 诱导的NAFLD 中的潜在作用机制。本文首次证明了NF-κB 是Fam172a基因的下游靶分子,并通过NF-κB 将肝脏炎症和ERS 这两个NAFLD 关键发病机制结合在一起。
本研究发现Fam172a基因可以调控NF-κB 通路,但其具体的调控机制还未明确,我们将在下一步的实验中继续完善该机制的研究。此外,Fam172a基因除了调控ERS 通路外是否还会对其他NF-κB 下游通路造成影响也是我们需要进一步探究的问题。
综上,本文的研究结果表明Fam172a基因敲除可通过活化NF-κB 通路来加重ESR 诱导的NAFLD。本文只在动物水平研究了Fam172a基因敲除在ESR 诱导的NAFLD 中的作用机制,后续我们还将利用TM 建立HepG2 细胞系(Fam172a基因高表达和低表达) 的ERS 模型,在细胞水平进一步验证Fam172a基因敲除在ESR 诱导的NAFLD中的作用机制。

