HMGB1 中和抗体抑制细胞焦亡改善系统性红斑狼疮小鼠肺损伤的机制研究
李鸣远 ,孟岩 ,武云
新疆医科大学第一附属医院1全科医学科,2风湿免疫科 乌鲁木齐市,830054
系统性红斑狼疮 (systemic lupus erythematosus,SLE) 是一种累及多个脏器的自身免疫性疾病,其特征在于自身免疫系统过度激活,先天性和适应性免疫细胞功能异常,并产生大量针对核酸和核酸结合蛋白的自身抗体[1]。鉴于SLE 的高度复杂性和异质性,该疾病的发病机制仍不完全清楚,研究认为其涉及遗传因素和环境因素两大方面。肺部受累在SLE 中普遍存在,大约50 %~70 %的SLE 患者存在肺损伤,临床表现为胸膜受累、急性肺炎、间质性肺疾病和弥漫性肺泡出血等[2-3],对人类健康造成了巨大威胁。
高迁移率族蛋白1 (high-mobility group box 1,HMGB1) 是高迁移率组蛋白家族的成员。在细胞核中,HMGB1 通过弯曲DNA 螺旋结构来稳定染色质结构并调节基因转录。HMGB1 还可以从受损细胞或活化的免疫细胞中释放出来作为细胞外的损伤相关分子模式,通过与细胞表面受体如晚期糖基化终产物受体 (receptor of advanced glycation end products,RAGE) 结合参与下游促炎细胞因子的分泌,从而促进多种炎症性疾病和自身免疫性疾病的发生和发展[4-5]。HMGB1 的促炎和免疫刺激功能表明其与自身免疫性疾病相关,此外,已在SLE 患者血清中检测到HMGB1 水平显著升高,并被确定为含DNA 的免疫复合物中增强促炎细胞因子产生的成分之一[6]。由此说明,HMGB1 可能作为SLE中一种新的炎症相关因子,然而,其在SLE 发病肺损伤期间的确切作用及机制尚不清楚。本研究拟采用HMGB1 中和抗体作用MRL/lpr 小鼠以探究其对SLE 肺损伤的影响及其可能的作用机制,为今后治疗SLE 合并肺损伤提供实验依据。
1 材料与方法
1.1 实验动物
健康C57BL/6 小鼠和MRL/lpr 小鼠(该小鼠为研究狼疮发病的代表性动物,能自发产生与人类疾病类似的狼疮症状),均为雌性,6~8 周龄,体质量20~24 g。小鼠饲养于室温22 ℃~24 ℃、相对湿度50 %~60 %、12 h/12 h 光暗交替的标准环境中,期间自由饮水、进食。适应饲养1 周后进行实验,本动物实验研究获得我院动物伦理委员会批准审核。
1.2 主要试剂
HMGB1 中和抗体购于购于沈阳万类生物科技有限公司,NLRP3 炎症小体抑制剂MCC950 购于美国Selleck 公司,HE 染色液购于上海源叶生物科技有限公司,Masson 染色试剂盒购于上海翌圣生物科技股份有限公司,IL-1β、IL-6、IL-18、TNF-α的ELISA 检测试剂盒购于上海酶研生物科技有限公司,Triton X-100 购于北京伊塔生物科技有限公司,DAPI 核酸染料购于北京康瑞纳生物科技有限公司,牛血清白蛋白购于北京百奥创新科技有限公司,蛋白裂解液和BCA 蛋白浓度测定试剂盒购于上海碧云天生物研究所,PVDF 膜购于美国Millipore 公司,兔抗HMGB1、NLRP3、ASC、Caspase-1、GSDMD、GAPDH 一抗、Alexa Fluor 488 偶联的二抗以及辣根过氧化物酶偶联的二抗均购于英国Abcam 公司。
1.3 方法
1.3.1 实验分组与处理 将30 只MRL/lpr 小鼠随机分为MRL/lpr 组、MRL/lpr+anti-HMGB1 组、MRL/lpr+MCC950 组,每组10 只,另取10 只野生型C57BL/6 小鼠作为对照组。MRL/lpr+anti-HMGB1 组参考文献[7] 给药方式和剂量,通过小鼠尾静脉注射HMGB1 中和抗体(1 mg/kg),每周注射2 次,2 次注射间隔3 d,持续4 周;MRL/lpr+MCC950 组参考文献[8] 给药方式和剂量,通过小鼠灌胃NLRP3 炎性小体抑制剂MCC950(10 mg/kg),每日1 次,持续4 周。对照组和MRL/lpr 组同时注射相应体积的生理盐水。
1.3.2 HE 染色观察肺组织病理学变化 给药结束后,处死小鼠解剖取肺组织,用4 %多聚甲醛固定过夜,乙醇脱水,石蜡包埋并制备切片。切片通过常规二甲苯透明,乙醇脱蜡水化,进行HE 染色,结束后用中性树胶封固切片,晾干,于光镜下进行组织病理学变化观察并收集图像。
1.3.3 Masson 染色检测肺组织胶原纤维沉积 小鼠肺组织切片进行常规脱蜡水化,Weigert 氏铁苏木素染色5 min,流水冲洗,通过丽春红酸性品红浸泡,磷钼酸水处理5 min,苯胺蓝染色3 min,1 %冰醋酸浸洗后,脱水、透明,中性树胶封固切片,晾干,于光镜下观察组织染色情况并收集图像,蓝染代表胶原纤维沉积,用Image J 软件分析胶原纤维沉积。
1.3.4 ELISA 法检测肺泡灌洗液中IL-1β、IL-6、IL-18 及TNF-α 含量 小鼠开胸后充分暴露支气管,注射器抽取0.5 mL 预冷的无菌生理盐水灌洗小鼠左肺,轻柔按摩胸腔后,缓慢回吸灌洗液,再次注入左肺按摩、回吸,重复该操作3 次,收集灌洗液,于4 ℃、4 000 r/min 离心5 min,取上清液并保存于-20 ℃备用。参照试剂盒说明书,采用ELISA 法检测小鼠肺泡灌洗液中炎性因子IL-1β、IL-6、IL-18 及TNF-α 含量。
1.3.5 免疫荧光染色检测肺组织内NLRP3 荧光表达 将小鼠肺组织制备冰冻切片,复温后浸入冰丙酮中固定,0.1 %Triton X-100 透化15 min,5 %牛血清白孵育30 min,滴加兔抗NLRP3 一抗(1∶200) 覆盖切片,4 ℃孵育过夜。洗涤后滴加对应Alexa Fluor 488 二抗(1 ∶500),室温孵育1 h,并采用DAPI 染核,抗荧光淬灭封片剂封固,洗涤、晾干后,在荧光显微镜激发光下观察小鼠肺组织NLRP3 表达并收集图像,用Image J 软件分析平均荧光强度。
1.3.6 蛋白质印迹测定肺组织中HMGB1 及焦亡相关蛋白表达 将小鼠肺组织剪碎制备匀浆液,加入预冷的裂解液提取总蛋白,使用BCA 法测定组织蛋白浓度,蛋白经高温煮沸变性后,取等量样品行10 % SDS-PAGE 电泳分离并转印至PVDF 膜。5 %脱脂奶粉室温封闭膜2 h,分别与兔抗HMGB1、NLRP3、ASC、Caspase-1、GSDMD 一抗(1∶1 000)置于4 ℃孵育过夜。膜经TBST 漂洗后,再与对应辣根过氧化物酶偶联的二抗(1∶5 000) 室温孵育1 h,TBST 漂洗,增强化学发光法ECL 显影后,放入成像系统中采集图片信息,用Image J 软件分析蛋白条带灰度值,GAPDH 作为内参,以目的蛋白与GAPDH 的灰度值比值来表示目的蛋白相对表达量。
1.4 统计学分析
本研究应用GraphPad Prism 8.0.1 软件进行统计学分析,数据以均数±标准差() 表示。多组间数据分析采用单因素方差分析法,两两数据比较采用LSD-t检验。P<0.05 认为差异具有统计学意义。
2 结果
2.1 各组小鼠肺组织病理学变化比较
HE 染色观察各组小鼠肺组织病理学变化情况,结果如图1 所示。对照组小鼠肺组织结构和形态正常;MRL/lpr 组小鼠肺组织呈现严重病理损伤症状,内有炎症细胞浸润,动脉管腔严重变形,肺间质水肿,肺泡出现塌陷、破裂;与MRL/lpr 组比较,MRL/lpr+anti-HMGB1 组和MRL/lpr +MCC950 组小鼠肺组织炎性细胞浸润、动脉腔变形、肺间质水肿及肺泡变形塌陷等现象均得到明显改善。

图1 各组小鼠肺组织病理学变化比较(HE 染色,×100)
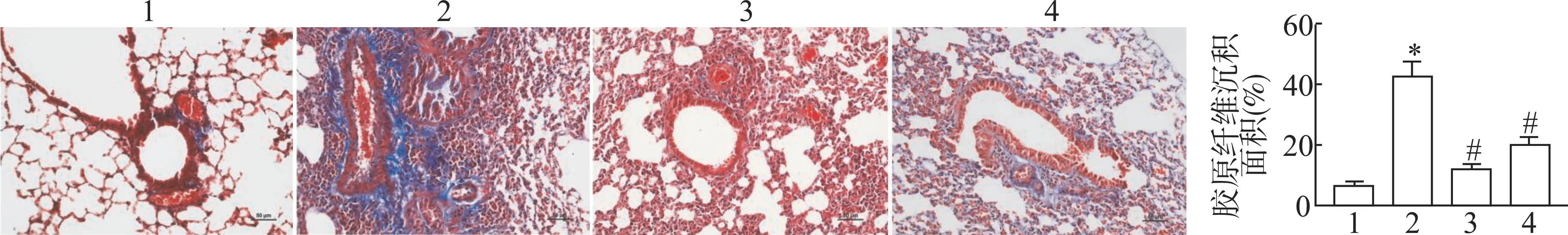
图2 各组小鼠肺组织胶原纤维沉积情况比较(Masson 染色,×100)
2.2 各组小鼠肺泡灌洗液中炎性因子含量比较
ELISA 测定结果显示,与对照组比较,MRL/lpr 组小鼠肺泡灌洗液中IL-1β、IL-6、IL-18 及TNF-α 含量显著升高(P<0.05);与MRL/lpr 组比较,MRL/lpr+anti-HMGB1 组和 MRL/lpr +MCC950 组小鼠肺泡灌洗液中IL-1β、IL-6、IL-18及TNF-α 含量显著降低(P<0.05) (图3)。

图3 各组小鼠肺泡灌洗液中IL-1β、IL-6、IL-18 及TNF-α 含量比较
Masson 染色观察各组小鼠肺组织内胶原纤维沉积现象,结果如图2 所示。对照组小鼠肺组织内未见明显的蓝染胶原纤维沉积;与对照组比较,MRL/lpr 组小鼠肺组织内有大量蓝染区域,胶原纤维沉积面积显著增加(P<0.05);与MRL/lpr 组比较,MRL/lpr+anti-HMGB1 组和 MRL/lpr +MCC950 组小鼠肺组织内蓝染的胶原纤维沉积面积显著减少(P<0.05)。
2.3 各组小鼠肺组织内NLRP3 荧光表达情况比较
通过免疫荧光染色观察各组小鼠肺组织内NLRP3 荧光表达,与对照组相比较,MRL/lpr 组小鼠肺组织内NLRP3 平均荧光强度显著性增加(P<0.05)。
与MRL/lpr 组相比较,MRL/lpr +anti-HMGB1组和MRL/lpr+MCC950 组小鼠肺组织内NLRP3 平均荧光强度显著性减小(P<0.05) (图4)。
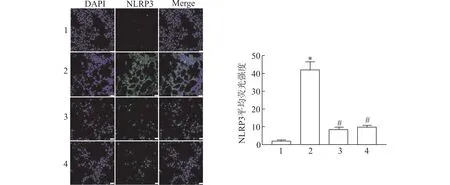
图4 各组小鼠肺组织NLRP3 表达比较(免疫荧光染色,×100)
2.4 各组小鼠肺组织中HMGB1 及焦亡相关蛋白表达比较
蛋白质印迹检测结果显示,MRL/lpr 组小鼠肺组织中HMGB1 蛋白相对表达量及NLRP3、ASC、Caspase-1、GSDMD 蛋白相对表达量均显著高于对照组(P<0.05)。
与MRL/lpr 组相比较,MRL/lpr +anti-HMGB1组和MRL/lpr+MCC950 组小鼠肺组织中HMGB1蛋白的相对表达量及NLRP3、ASC、Caspase-1、GSDMD 蛋白的相对表达量显著性下调(P<0.05)(图5)。

图5 各组小鼠肺组织HMGB1 及焦亡相关蛋白表达比较
3 结论
SLE 常引起肾脏、心脏、肺、关节等多个器官的慢性炎症,肺部病变是SLE 严重的表现之一,属于一种致命性并发症,及时发现、及时治疗肺损伤是拯救SLE 患者生命的重要措施。越来越多的证据表明,TNF-α 和IL-6 等促炎细胞因子的产生与失调可能在SLE 的免疫功能障碍中起关键作用,并介导肺组织炎症及损伤。TNF-α 水平显著升高与SLE 疾病活动度相关,降低TNF-α 水平可降低临床患者的疾病活动度[9]。此外,IL-6 在SLE 患者血清中升高,且能促进SLE 患者和小鼠自身抗体的产生[10]。因此,了解涉及炎症反应的详细机制将有助于探究针对SLE 的有效疗法。本研究检测结果显示,MRL/lpr 小鼠肺组织内有大量炎症细胞浸润,肺间质水肿以及肺泡塌陷、破裂,胶原纤维沉积面积增加,肺泡灌洗液中IL-6 和TNF-α 含量也升高,以上结果表明,MRL/lpr 小鼠表现为明显的肺部炎症反应及组织纤维化,说明SLE 引起了肺损伤。
HMGB1 作为促炎介质有助于多种慢性炎症和自身免疫性疾病的发病机制,包括SLE。细胞凋亡清除缺陷是SLE 发病机制的一个重要方面,当凋亡细胞不能有效清除时,会引发继发性坏死,释放细胞内容物,在此过程中SLE 患者受累组织中单核巨噬细胞、中性粒细胞、浆细胞样树突状细胞等细胞异常活化并释放HMGB1,释放到胞外的HMGB1 以RAGE 依赖性方式介导炎症反应,从而促进SLE 进展[11-12]。此外,HMGB1 与多种肺部疾病的发生也密切相关。例如,HMGB1 通过激活巨噬细胞中的黑色素瘤缺乏因子2 (absent in melanoma 2,AIM2) 炎症小体以及通过Toll 样受体1(toll-like receptor 1,TLR1)、TLR2 和RAGE/核因子-κB (nuclear factor-κB,NF-κB) 信号通路诱导M1 型巨噬细胞极化来参与脂多糖诱导的急性肺损伤过程[13];HMGB1 介导的RAGE 激活不仅诱导肺组织损伤,而且还阻碍肺泡上皮细胞损伤后的修复反应,降低了肺组织再生能力[14];HMGB1 通过促进中性粒细胞浸润、促炎细胞因子及趋化因子的表达来增加细胞凋亡,促进肺缺血再灌注损伤[15]。由此可见,HMGB1 可能是肺部相关疾病的独立生物标志物和治疗靶点,使用HMGB1 抗体、抑制剂、炎症抑制剂以及对HMGB 进行靶向干预将成为肺部疾病的新型治疗方法。本研究使用HMGB1中和抗体作用MRL/lpr 小鼠后,经检测发现小鼠肺组织炎症细胞浸润、肺间质水肿、肺泡变形塌陷以及胶原纤维沉积均得到明显改善,肺泡灌洗液中IL-6 和TNF-α 含量也降低,这说明HMGB1 中和抗体能够减轻SLE 小鼠肺部炎症反应及组织纤维化,改善SLE 肺损伤。
程序性细胞死亡在体内平衡中起重要作用,细胞凋亡与焦亡是程序性细胞死亡的两种不同方式。细胞凋亡是非炎症性程序性细胞死亡的一种形式,涉及细胞器、细胞膜和细胞核变化的过程,经常发生在单个细胞中,以避免炎症的发生。而焦亡是由各种危险信号诱导的程序性细胞死亡的溶解性和炎症性形式,其特征是细胞膜上的孔形成、细胞肿胀以及细胞裂解后细胞内容物和促炎细胞因子的释放,这种过度活跃的炎症程序性细胞死亡会破坏免疫系统稳态并促进自身免疫反应[16]。IL-1β 和IL-18 是焦亡细胞释放的两种重要炎症细胞因子,可引发邻近细胞的继发性炎症反应[17-18]。除了释放炎症细胞因子外,焦亡细胞还能释放HMGB1 并作为一种损伤相关分子模式诱导促炎细胞因子的产生,促进树突状细胞的成熟和迁移以及B 细胞的活化,还可以触发巨噬细胞的焦亡[19]。NLRP3 炎症小体是介导焦亡的炎症小体传感器之一,现已发现其在SLE 患者中过度激活[20]。NLRP3 炎症小体通过与ASC 结合后激活Caspase-1 并切割GSDMD产生GSDMD N 结构域,从而诱导细胞焦亡[21]。本研究检测结果显示,经过HMGB1 中和抗体作用的MRL/lpr 小鼠肺泡灌洗液中IL-1β 和IL-18 含量降低,肺组织NLRP3、ASC、Caspase-1 及GSDMD 蛋白表达水平也下调,由此推断,HMGB1 中和抗体减轻SLE 肺损伤的作用可能与其抑制细胞焦亡有关。基于此,本研究应用NLRP3 炎症小体抑制剂MCC950 作用MRL/lpr 小鼠后,其作用效果与HMGB1 中和抗体一致,且MCC950 明显抑制了MRL/lpr 小鼠肺组织内HMGB1 表达的升高,该结果进一步表明,HMGB1 中和抗体通过抑制NLRP3炎症小体介导的细胞焦亡途径来减轻SLE 肺损伤。
综上所述,HMGB1 参与SLE 中肺损伤发病机制,采用HMGB1 中和抗体能够改善SLE 小鼠肺部炎症细胞浸润与组织纤维化,减少促炎因子的产生,对肺组织起到保护作用,并发现该作用与其抑制NLRP3 炎症小体介导的细胞焦亡途径有关。本研究为SLE 诱导肺损伤的治疗提供了新靶点和新方向。然而,是否还有其他通路参与HMGB1 中和抗体改善SLE 肺损伤尚不明确,后续将针对此问题开展相关研究,以充分阐明HMGB1 调节SLE 肺损伤的具体机制。

