宁夏枸杞雄性不育花药中胼胝质动态变化特征
周 婷 ,魏雅茹 ,孙旭冉 ,管翠萍 ,梁文裕 ,杨淑娟*
(1 宁夏大学 生命科学学院,银川 750021;2 西部特色生物资源保护与利用教育部重点实验室,银川 750021)
植物雄性不育的主要特征是雄蕊发育不正常,不能产生有正常功能的花粉,但其雌蕊发育正常,能够接受正常花粉而受精结实[1]。花粉发育从孢原细胞的分化开始,历经母细胞减数分裂、花粉壁形成、绒毡层退化、花粉有丝分裂等过程,最后花药开裂释放成熟花粉粒[2],无论哪个过程受阻,都将导致花粉败育。有关花粉败育的机制非常复杂,目前认为其与绒毡层细胞程序化死亡、胼胝质沉积、能量及物质代谢等因素相关[3]。其中胼胝质壁作为影响植物雄性不育的一个重要因素,是研究这一领域的一个重要内容和热点。胼胝质是一种以β-1,3键结合的葡聚糖,可以迅速聚合和解聚,其合成与降解的过程分别由胼胝质合成酶(callose synthase,CALS)和β-1,3-葡聚糖酶(β-1,3-glucanase)家族催化完成,是组成细胞壁的成分之一[4]。胼胝质壁在配子体发育过程中呈现有规律的变化,这种规律在兰科植物胚珠发现以来,在被子植物16 科39 属中已被证实[5]。多数植物的小孢子母细胞进入减数分裂时都要形成胼胝质壁,胼胝质首先在小孢子母细胞角隅处的初生壁和质膜之间沉积,胼胝质沉积可能与细胞内的粗糙型内质网和高尔基体活动有关[2],胼胝质壁可能在维持小孢子母细胞形态和保护小孢子母细胞免受周围环境影响方面发挥作用,同时能阻止小孢子母细胞融合和凝聚。减数分裂晚期胼胝质壁的及时降解有助于从四分体中释放出小孢子[6]。胼胝质的积累和降解在植物生命过程中有着多重作用,调控胼胝质降解的分子机制目前仍不清楚。胼胝质在花粉发育过程中会动态沉积和降解,是花粉发育过程中形成花粉外壁、保持花粉育性和活力所必需的[7-9]。胼胝质沉积异常,如过多沉积或沉积量不足、提前降解或延迟降解都会导致花粉败育,造成植物雄性不育[2]。胼胝质在沉积的过程中受到众多因素调控,包括组织创伤、病原体感染、脱落酸以及生物胁迫等[6],当其中某些因素发生变化就会引起胼胝质的沉积发生异常,导致花粉败育。Pu等[10]研究表明四分体阶段的胼胝质延迟降解可能是‘10L03’大白菜小孢子败育的主要原因。小孢子母细胞胼胝质壁的过早降解导致烟草雄性不育[11]。毛白杨小孢子母细胞无明显胼胝质合成,四分体时期主要沉积在四分孢子间,四分孢子外围分布量减少,导致花粉败育[12]。徐青等[13]在宁夏枸杞不育系与可育系花药发育的细胞学研究中发现不育系四分体小孢子败育发生在胼胝质壁中,表明宁夏枸杞不育系胼胝质壁未及时降解,影响了小孢子发育,导致花粉败育。目前已对拟南芥、大豆、玉米等多种植物花粉发育过程中胼胝质的沉积动态变化有较详细研究[14-16],但对枸杞花药发育过程中胼胝质沉积动态规律的研究较少。
宁夏枸杞(Lycium barbarumL.)是茄科(Solanaceae)枸杞属(Lycium)植物,其雄性不育系‘宁杞5号’解决了困扰枸杞育种必须去雄的难题,缩短了育种周期[17]。枸杞雄性不育在杂种优势利用上具有重要价值。目前宁夏枸杞雄性不育机理还未明确,胼胝质分布动态研究对解析植物雄性不育的机理具有重要意义,但对胼胝质在宁夏枸杞生殖发育中的确切动态变化了解有限。因此,本研究通过半薄切片技术,利用苯胺蓝和PAS反应2种染色方法充分了解可育及不育花药发育过程中胼胝质壁的动态变化特征,比较胼胝质沉积差异,以期揭示不育花药发育过程中胼胝质异常沉积动态,阐明胼胝质对宁夏枸杞不育的影响,并为后续研究提供一定的理论基础。
1 材料和方法
1.1 试验材料
试验材料为可育系宁夏枸杞(‘宁杞1号’)及不育系宁夏枸杞(‘宁杞5号’)不同发育时期的花药。
1.2 试验方法
1.2.1 制备半薄切片
通过压片法确定花药发育时期,每个时期选取10~15个花药快速置于含2.5%戊二醛和50 mmol/L磷酸缓冲液(p H 7.0)的前固定液,室温固定5 h;然后用50 mmo L/L 磷酸缓冲液(p H 7.0)清洗3次,每次30 min;再于1%锇酸和50 mmol/L磷酸缓冲液(p H 7.0)的后固定液4℃冰箱过夜。次日用相同洗涤液洗涤3次,每次30 min。梯度系列丙酮脱水后,Epon812 树脂包埋。用Leica Ultracut R 型超薄切片机制作半薄切片,厚度1μm。
1.2.2 高碘酸-希夫反应标记胼胝质
将切好的半薄切片,捞片烘干后,参照胡适宜和徐丽云[18]的方法,用高碘酸-希夫反应(periodic acid-schiff stain,PAS)标记细胞中的多糖类物质,胼胝质染色后呈红色。
1.2.3 苯胺蓝染色标记胼胝质
将半薄切片按照蒋海鹰等[19]的方法脱树脂,脱脂后切片用1%(水溶)苯胺蓝染色液染色15 min,OLYMPUS IX73显微镜下胼胝质呈蓝色荧光。
2 结果与分析
2.1 ‘宁杞1号’可育系花药发育中胼胝质沉积动态变化
2.1.1 小孢子母细胞时期
花药壁由外向内可清晰看到表皮(1层)、药室内壁(1层)、中层(2层)和绒毡层(1层)。其中绒毡层细胞体积较大,细胞质浓厚,呈四边形且规则排列,细胞质内含物丰富。花药壁中有一些多糖性质的淀粉粒被染成红色,细胞壁PAS反应呈红色。花粉囊中充满小孢子母细胞,此时仅在母细胞角隅处积累一些多糖性质的胼胝质,细胞壁呈不均匀增厚(图1,A)。同时,在荧光显微镜下也可见母细胞外局部沉积的胼胝质被苯胺蓝染色呈特异性蓝色荧光,此时胼胝质壁不连续,厚薄不均(图1,B)。2种染色方法结果一致。
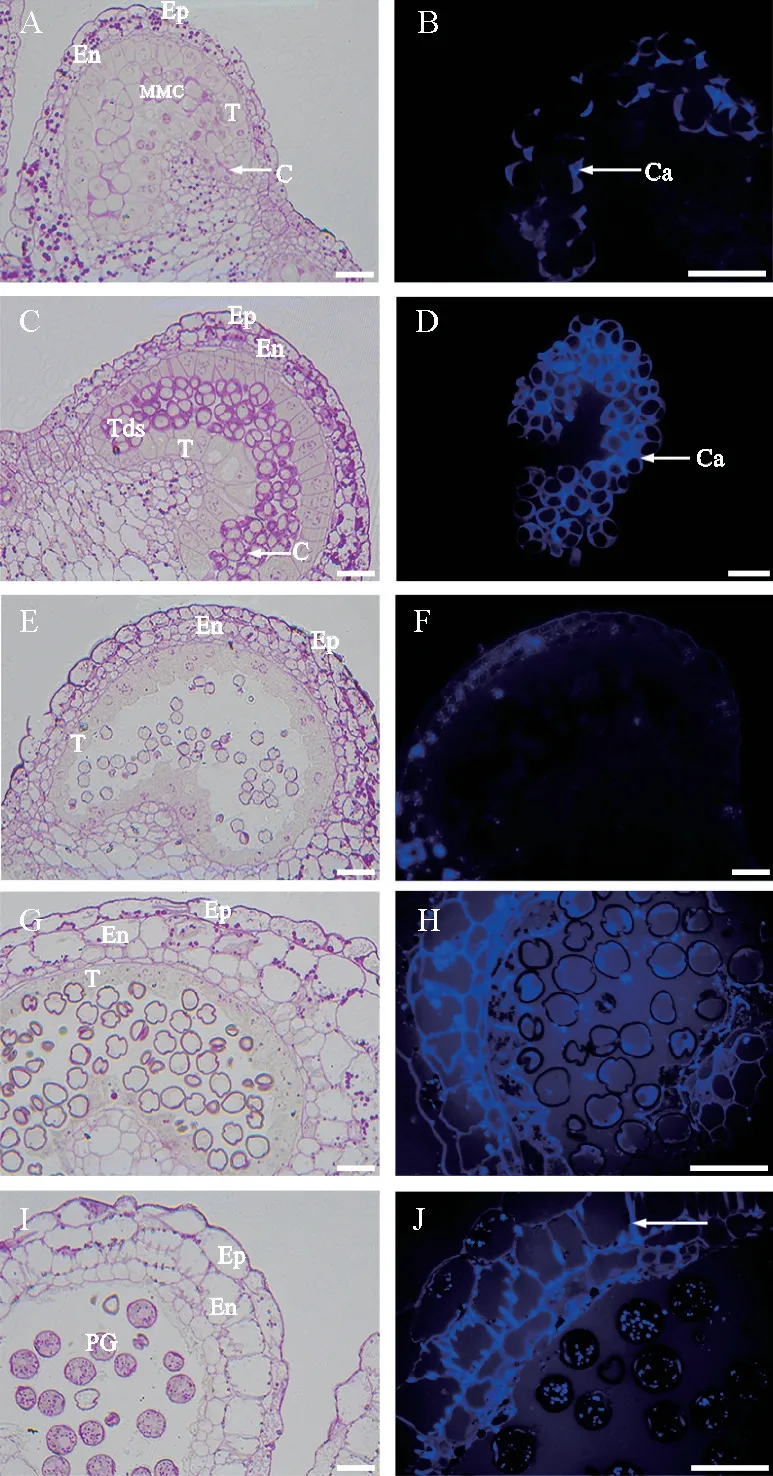
A-B.小孢子母细胞时期,小孢子母细胞周围胼胝质厚薄不均(箭头所示);C-D.四分体时期,四分体外及四分孢子之间出现胼胝质壁(箭头所示);E-F.单核时期,小孢子游离于药室中,周围无胼胝质存在;G-H.大液泡时期,花粉粒周围未见有胼胝质壁;I-J.成熟花粉时期,纤维化加厚的细胞壁及花粉粒中的淀粉粒也呈现出很明显的蓝色荧光(箭头所示)。Ep.表皮;En.药室内壁;T.绒毡层;MMC.小孢子母细胞;Tds.四分体;PG.花粉粒;Ca.胼胝质。标尺均为20μm。图1 ‘宁杞1号’花药发育过程中胼胝质分布情况A-B.In microspore mother cell stage,the thickness of the callose around the mother cell is uneven (shown by the arrows).C-D.In tetrad stage,callose wall appear outside the tetrad and between the quartet (shown by the arrows).E-F.In mononuclear stage,the microspores are free from the drug pollen chamber,without the surrounding callose wall.G-H.In large vacuole stage,the callose wall is absent around the pollen grains.I-J.In pollen grains mature stage,the fibrotic thickened cell wall also has obvious blue fluorescence(shown by the arrows).Ep,epidermis.En,endothecium wall.T,tapetum.MMC,microspore mother cell.Tds,tetrad.PG,pollen grains.Ca,callose.Scale both 20μm.Fig.1 Distribution of callose during the anther development of ‘Ningqi 1’
2.1.2 四分体时期
小孢子母细胞进一步发育,经减数分裂后形成四分体,在此过程中,胼胝质进一步积累并向四分体中央及四周延伸,使得四分孢子外及小孢子之间的胼胝质壁逐渐加厚,此时期绒毡层细胞体积变大,规则紧密排列(图1,C)。荧光显微镜下也看到四分体外及四分孢子之间明显的蓝色荧光,即为胼胝质壁(图1,D)。
2.1.3 小孢子早期
随着花药进一步发育,位于花药壁最内层的绒毡层细胞在原本位置逐渐解体,细胞发生皱缩,形状不规则,体积减小。此时,包裹在四分体外的胼胝质在相应的胼胝质酶作用下逐渐降解消失,4个小孢子随之分开并游离到药室中成为单核小孢子(图1,E)。此时,荧光显微镜下也看不到蓝色荧光,显示无胼胝质壁存在(图1,F)。
2.1.4 大液泡时期
此时期绒毡层细胞加剧解体,体积进一步缩小。单核花粉粒因吸收绒毡层内所含营养和水分,体积增大,小孢子细胞质出现明显液泡化并逐渐形成1个大液泡,细胞质及核被挤压成紧贴细胞壁的薄层,此时进入小孢子晚期,也称为单核靠边期(图1,G)。同时,来自绒毡层的孢粉素作为主要花粉壁组成物质在花粉表面大量积累。在荧光显微镜下花粉粒周围未见蓝色荧光的胼胝质壁(图1,H)。
2.1.5 成熟花粉粒时期
成熟花粉粒呈圆形,含有大量内含物且可被Schiff染液染为红色,即成熟花粉粒中含有大量多糖性质的淀粉粒(图1,I)。此时,荧光显微镜下孢粉素性质的花粉外壁未出现蓝色荧光。另外,构成花药壁的几层细胞中,尤其药室内壁纤维化加厚的细胞壁和成熟花粉粒中的淀粉粒也呈现出明显的蓝色荧光(图1,J)。
2.2 ‘宁杞5号’不育系花药中胼胝质沉积动态变化
2.2.1 小孢子母细胞时期
此时期不育花药发育特点及胼胝质沉积特点与可育系相同。小孢子母细胞呈圆形或椭圆形,其周围有增厚的红色胼胝质不均匀分布。除绒毡层以外的其他花药壁中也含有大量呈红色的淀粉粒(图2,A)。荧光显微镜下可见母细胞外围有少量不均匀分布的蓝色荧光,显示正在积累胼胝质(图2,B)。

A-B.小孢子母细胞时期,小孢子母细胞周围胼胝质一边薄一边厚(箭头所示);C-D.四分体早期,四分孢子被胼胝质壁包围(箭头所示);E-F.四分体中期,胼胝质壁变薄,但仍包裹着小孢子,未发生解体(箭头所示);G-H.四分体末期,药室内存在严重变形解体的四分体残迹,周围仍有胼胝质分布(箭头所示)。Ep.表皮;En.药室内壁;T.绒毡层;Tds.四分体;Ca.胼胝质。标尺均为20μm。图2 ‘宁杞5号’花药发育过程中胼胝质分布情况A-B.In microspore mother cell stage,the callose around the mother cell is thin and thick (shown by the arrows).C-D.In the early tetrad,the quartet are surrounded by the callose wall(shown by the arrows).E-F.In the middle tetrad,the callose wall becomes thin,but still covers the microspores without disintegration (shown by the arrows).G-H.At the end of the tetrad,severe deformation of the tetrad remains in the pollen chamber,with callose distribution (shown by the arrows).Ep,epidermis.En.Endothecium wall.T,tapetum.Tds,tetrad.Ca,callose.Scale both 20μm.Fig.2 Callose distribution during the anther development of‘Ningqi 5’
2.2.2 四分体早期
不育花药药室中的四分体与可育花药相比数量较少,此时期小孢子发育特点及胼胝质沉积特点与可育四分体时期相同,绒毡层细胞体积也较大,还未发生解体,胼胝质进一步积累,包裹小孢子形成胼胝质壁,且胼胝质向四分体中心部位延伸将4个小孢子隔开形成等四面体的四分体结构(图2,C)。荧光显微镜下可见包裹四分体的蓝色荧光明显增多,右上角为放大的几个四分体(图2,D)。这与可育花药中四分体胼胝质壁特征(图1,D)相似。
2.2.3 四分体中期
随着花药进一步发育,四分体整体及内部的各个小孢子开始变形,有些小孢子出现空泡,被染成红色的胼胝质壁变薄,但仍包裹着小孢子。四分体中的小孢子被胼胝质包裹无法释放进入下一发育时期,花药囊内无游离小孢子。此时绒毡层细胞液泡化增加,充满了大量不同大小的液泡,同时细胞质凝缩,染色质聚集,出现程序性死亡细胞特征(图2,E)。荧光显微镜下可见四分孢子周围仍存在胼胝质壁,但相比四分体早期(图2,D),胼胝质沉积量减少,胼胝质壁变薄,四分体外仍有少量蓝色荧光,右上角为放大的几个四分体(图2,F)。
2.2.4 四分体晚期
花药在接近开花时期,药室内壁细胞的切向壁上有许多纤维素性质的加厚突起,绒毡层细胞完全解体。
药室内仍有一些严重变形的四分体残迹,胼胝质的量进一步减少但未完全消失(图2,G)。相应地,荧光显微镜下可见药室内壁细胞的细胞壁和四分体残迹中的胼胝质被特异性标记呈蓝色荧光,显示出败育四分体周围的胼胝质仍有少量分布(图2,H)。
3 讨论
多数植物花药发育过程中,胼胝质在减数分裂过程中合成并沉积在质膜外,形成一个临时层分隔药室中的各个小孢子母细胞。胼胝质不断沉积最后在四分体周围形成厚厚的胼胝质壁,并在四分体后期降解从而释放出游离小孢子,最终小孢子各自独立发育形成二胞或三胞花粉[20-22]。但各植物因品种差异,其胼胝质沉积规律略有不同,如番荔枝在小孢子发育时期胼胝质降解特点表现为四分体外围的胼胝质不完全解体[23],铁皮石斛小孢子母细胞进入减数分裂时花粉块表面及内部的小孢子母细胞无胼胝质壁[24]。本研究在可育系花药胼胝质分布变化的观察中发现,小孢子母细胞时期胼胝质厚薄不均(图1,B),分布不规则;四分体时期的四分体外包裹着一层非常厚的胼胝质(图1,D),随着四分体不断发育,绒毡层分泌胼胝质酶,降解胼胝质壁释放出单个小孢子。在单核时期至成熟花粉粒形成之后未见胼胝质,此结果与多数植物花药发育过程中胼胝质沉积规律相同。
胼胝质的合成与降解是一个严密的调控过程,分别受胼胝质合成酶和β-1,3-葡聚糖酶的直接调控[4]。胼胝质合成酶又称葡聚糖合成酶类似物(glucan syinthase like,GSL),是控制胼胝质合成的关键酶,如基因发生突变则使酶控制的胼胝质壁的合成及降解发生改变,影响花粉育性[22]。β-1,3-葡聚糖酶对四分体发育过程中的胼胝质壁及时降解有关,其沉默表达会导致水稻花粉不育[26]。胼胝质沉积还受其他众多调控基因的间接调控,如棉花发育过程中花粉特异性蛋白通过抑制转录因子WRKY15的作用来调节胼胝质沉积[7]。本研究通过2种染色方法分析得出的结论一致,结果显示枸杞不育花药四分体后期胼胝质壁的降解异常,至开花时期,胼胝质壁一直包裹着四分体,胼胝质壁延迟及不完全降解使小孢子无法释放,造成花粉发育异常最终败育。这一异常现象与李彦龙等[25]发现雄性不育枸杞胼胝质酶基因没有按时表达导致四分体外壁胼胝质无法分解,最终造成花粉不育的结果一致。
花粉发育过程中绒毡层细胞和小孢子是相互依赖的。绒毡层提供降解胼胝质的酶和花粉壁形成的原料及花粉发育的养分等,在花药发育中发挥重要作用[27-28]。拟南芥TDF1基因在花药绒毡层、小孢子母细胞以及小孢子中高表达,其突变体会导致绒毡层液泡化及胼胝质壁的延迟降解,最终导致小孢子无法形成可育花粉[29]。油菜热敏基因(TGMS)雄性不育突变体在小孢子母细胞减数分裂阶段会形成极度增大的脂肪绒毡层,胼胝质积累异常、四分体胼胝质壁延迟降解和花粉内壁缺失,最终导致花粉败育[30]。辣椒msc-3突变体由于绒毡层退化延迟,使四分体胼胝质壁不退化,导致花粉败育[31]。拟南芥NPU突变体由于胼胝质合成和孢粉素沉积缺陷,导致雄性不育[32]。这些研究报告表明绒毡层的正常发育对胼胝质合成与降解具有重要作用。徐青[33]和曹君迈等[34]研究发现宁夏枸杞不育花药绒毡层细胞异常增大、高度液泡化,不能适时合成和分泌胼胝质酶,使得胼胝质壁一直存在,并认为异常增大的绒毡层细胞会侵占药室而挤压小孢子,是引起小孢子败育的原因之一。本研究观察到,宁夏枸杞可育花药药室中四分体数量明显多于不育花药药室,且可育花药中绒毡层细胞排列紧密,细胞体积较小,而同时期不育花药中绒毡层细胞体积异常增大,细胞形状近长方形,细胞数量较少且排列较松散,呈现出异常形态结构,这与前人的研究结果一致。绒毡层细胞异常增大和液泡化增加、细胞程序性死亡异常,导致不能正常合成和分泌胼胝质酶、提供小孢子营养物质及花粉外壁形成原料异常是宁夏枸杞的败育原因。宁夏枸杞合成胼胝质壁的多糖来源、胼胝质沉积变化与绒毡层细胞的关系、胼胝质多糖的转运机制等问题缺乏相关报道,有待进一步研究。
4 结论
宁夏枸杞不育系小孢子母细胞时期胼胝质分布特点与可育系一致,胼胝质分布不规则,一边厚一边薄。在形成四分体时,不育花药的四分体胼胝质壁还未显示差异。但在四分体后期胼胝质壁的降解显示异常,至开花时期,胼胝质壁一直包裹着四分体小孢子,胼胝质壁延迟及不完全降解使小孢子无法释放,造成花粉发育异常最终败育。

