荒漠植物花花柴HTR 基因家族表达模式及其增强细菌抗逆性分析
徐靖辰 ,郭 媛 ,王彦芹,2*
(1 塔里木大学 生命科学与技术学院,新疆阿拉尔 843300;2 塔里木盆地生物资源保护利用兵团重点实验室,新疆阿拉尔 843300)
由于植物在其生长过程中无法移动,所以周围的环境对其生长发育的影响巨大[1]。近年来,研究发现大多数植物的生长发育过程都受到极端温度,高盐的胁迫[2-3]。植物长期生长于恶劣环境中,会造成作物严重减产,因此通过分子生物学手段挖掘抗逆相关基因,通过转基因技术使其稳定地在作物中遗传,并期望得到抗逆性较强的作物种质资源[4]。
研究发现,14-3-3蛋白是目前研究较深、较为广泛的抗逆基因家族之一,具有优异的广谱抗逆性[5],模式生物拟南芥(Arabidopsis thaliana)中14-3-3蛋白的过表达增强了拟南芥的耐寒性,14-3-3 和SOS3(salt overly sensitive 3)/scapp8(SOS3-like calcium binding protein 8)相互作用进而解码盐胁迫下的钙信号,并选择性激活或失活下游蛋白激酶SOS2(Salt Sensitive 2)和PKS5(protein kinase SOS2-like 5),通过协调介导质膜Na+/H+反转运蛋白和H+-ATP酶活性来调节Na+稳态[6],14-3-3基因在棉花中过表达可有效提高棉花抗旱能力,14-3-3基因主要通过调节离子通道和参与激素信号的通路减轻或促进棉花对这些应激的耐受性[7]。14-3-3蛋白是一类在生物体内普遍存在的调节磷酸丝氨酸/苏氨酸结合蛋白,存在于所有真核细胞中[8]。通常14-3-3 结构域与其靶蛋白的结合以磷酸化方式进行[9],但在某些情况下,含有14-3-3 结构域的蛋白质以磷酸化非依赖性方式参与许多细胞过程的调节和信号传导[10],前期本研究从花花柴高温转录组数据中筛选出7 个差异表达基因,通过NCBI在线比对发现均属于14-3-3基因家族,因其在高温转录组数据中上调表达,故命名为Kc H TR。
新疆地理气候的特殊性,使得新疆本土植物具有很强的抗逆性,花花柴是荒漠中最为典型的草本植物[11]。花花柴(Kareliniacaspia)具有耐盐碱、耐干旱、耐高温和抗风沙等优异的广谱抗逆性,是珍贵的抗逆植物天然种质资源[12]。其生长环境极为恶劣,多生于戈壁滩,少数生长于草甸盐碱地和苇地水田旁,常常大片群生[13]。花花柴叶扁平且肉质化,体内有发达的储水组织,保水能力强,具有较低的萎蔫系数[14]。花花柴有极好的耐盐性和耐旱性,是一种改良盐碱土的有用草本植物,同时也是产草量和营养价值都较高的一种野生饲草[15]。但关于花花柴14-3-3基因序列和蛋白的功能鲜见报道,因此该研究通过对花花柴HTR 基因家族进行原核表达并分析其抗逆性,进一步确定Kc H TR的抗逆性及其表达蛋白质的最佳诱导条件,为后续研究提供有力的支撑。通过挖掘利用花花柴耐极端温度和耐盐基因进行系统研究,利用其抗逆机制增加作物对逆境的耐受性,同时确保作物丰产、稳产以及为荒漠植物及其基因资源发掘利用提供一定参考价值和理论支撑。
1 材料和方法
1.1 试验材料
试验所用的花花柴种子于2022年9月采自新疆阿拉尔市塔克拉玛干沙漠的荒漠土壤(40°32′N,81°17′E),种子经过自然干燥后放置于离心管中常温保存。
1.2 试验方法
1.2.1 材料处理
营养土与蛭石按3∶1混合均匀,将花花柴种子均匀撒在营养土内,待发芽后取长势相同的花花柴幼苗进行4℃低温胁迫5 min、0.5 h、2 h、4 h、8 h,45℃高温胁迫5 min、0.5 h、2 h、4 h,400 mmol/L Na+高盐胁迫处理2,4,8,24,48 h,每个处理3个重复,待处理完毕后取花花柴植株的根、茎、叶分别用液氮速冻后放入-80℃冰箱保存备用。
1.2.2 花花柴总RNA提取及cDNA合成
用RNAprep Pure Plant Kit试剂盒(天根生化科技北京有限公司,中国)提取花花柴的总RNA,用PrimeScriptTMRT Master Mix 反转录试剂盒(TAKARA 公司,中国)将其反转录为cDNA,试验操作均参照试剂盒说明书。
1.2.3 花花柴Kc HTRs原核表达载体构建
首先根据原核表达载体p ET28a的多克隆位点设计带有酶切位点的Kc H TRs引物,并送至北京睿博兴科生物技术有限公司进行合成,如表1 所示。用反转录所得到的花花柴cDNA 为模板进行PCR扩增,扩增体系为:95℃4 min,95℃30 s,35循环;57℃30 s,35 循环;72℃1 min,35 循环;72℃7 min,4℃15 min。PCR 扩增结束后利用0.8%的琼脂糖凝胶120 V 电泳15 min进行检测,克隆成功后用高效DNA胶回收试剂盒(天根生化科技北京有限公司,中国)进行回收,与p MD18-T载体连接(TAKARA 公司,中国),连接后转化至大肠杆菌DH5α感受态细胞,随机选取3个带有目的产物的阳性克隆质粒,送由陕西杨凌天润奥科生物科技有限公司完成测序,并用DNAMAN软件分析测序结果。
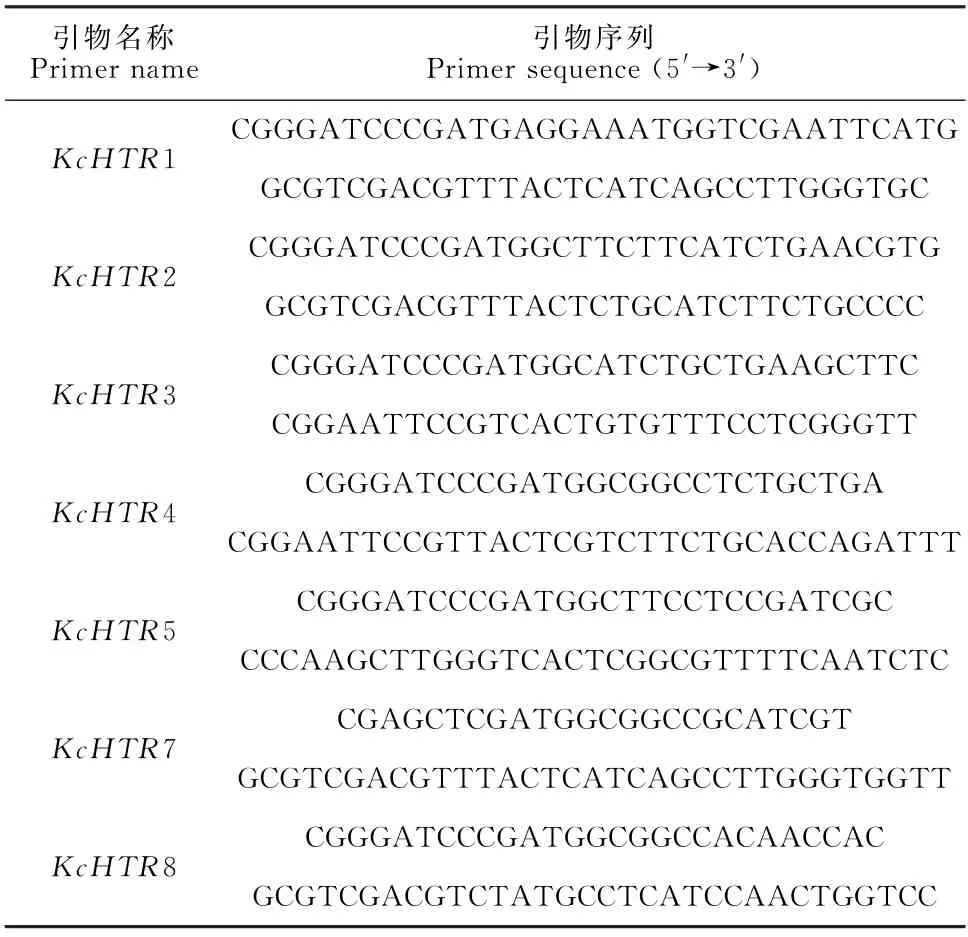
表1 Kc HTRs 引物序列Table 1 Primer sequences for Kc HTRs
测序成功后用质粒提取试剂盒(天根生化科技北京有限公司,中国)提取p MD18-T-Kc HTRs和p ET28a空载体质粒,将质粒分别利用(BamH Ⅰ-SaiⅠ、BamHⅠ-HindⅢ、SacⅠ-SaiⅠ、BamHⅠ-SalⅠ、BamH Ⅰ-EcoRⅠ)进 行双酶切,p MD18-T-Kc HTRs双酶切产物和p ET28a双酶切产物用T4 DNA 连接酶37℃定向连接30 min后,连接产物通过热激法转化大肠杆菌DH5α感受态细胞中,然后均匀涂布在含有硫酸卡那霉素(50 mg/L)的LB 固体培养基上,37℃培养倒置培养16 h后,挑取单菌落在含有硫酸卡那霉素(50 mg/L)的LB 液体培养基中,37℃、180 r/min振荡培养6 h,进行菌液PCR 筛选阳性菌落。
1.2.4 花花柴Kc HTRs原核表达
将阳性菌落进一步扩大培养提取质粒,利用热激法转化大肠杆菌BL21感受态细胞中,利用PCR筛选阳性菌落。将阳性菌落进一步扩大培养,在含有硫酸卡那霉素的LB 液体培养基中37℃、180 r/min过夜培养,按照1∶60比例进行二次活化菌株,直至OD600达到0.8,加入终浓度0.5 mmol/L的IPTG 溶液诱导0,2,4,6,8,10,12 h用以分析蛋白最佳诱导表达时间,扩大培养阳性菌株直至OD600分别达到0.4、0.5、0.6、0.7、0.8、0.9、1.0,加入0.5 mmol/L的IPTG 溶液诱导8 h用以分析蛋白最佳诱导OD600值,扩大培养阳性菌株至OD600达到0.8,加入终浓度为0.2,0.3,0.4,0.5,0.6,0.7,0.8 mmol/L的IPTG 溶液诱导8 h用以分析最佳诱导IPTG 浓度,提取蛋白经SDS-PAGE 电泳检测,确定Kc HTRs蛋白的最佳诱导表达条件。
1.2.5 重组BL21(pET28a-KcHTRs)的抗逆性分析
(1)耐极端温度分析:在上述最佳诱导条件下,诱导BL21-p ET28a和重组菌落表达Kc HTRs蛋白后,用含有硫酸卡那霉素的液体LB 培养基将菌液分别稀释10、100、1000倍,取稀释后菌液各2μL,点在含有硫酸卡那霉素(50 mg/L)的LB 固体培养基上,将2个平板分别放置在高温胁迫45℃和低温胁迫4℃处理48 h后再放置于37℃正常培养16 h,拍照观察菌落生长状态。
(2)耐盐分析:在上述最佳诱导条件下,诱导重组菌落表达Kc HTRs蛋白后,用含有硫酸卡那霉素的液体LB 培养基将菌液分别稀释10、100、1 000倍,取稀释后菌液各2μL,分别点在含有0.1,0.2,0.3 mol/L 的NaCl和硫酸卡那霉素(50 mg/L)的LB固体培养基上,放置37℃培养16 h后拍照观察菌落生长状态。
(3)菌落形成率:无胁迫处理的平板作为对照37℃培养4 h,胁迫处理的平板同样生长4 h后,计算不同菌株的菌落形成率。菌落形成率=(胁迫生长菌落数/对照生长菌落数)×100%。
1.2.6 花花柴Kc HTRs极端温度及盐胁迫表达模式分析
用RNAprep Pure Plant Kit[天根生化科技(北京)有限公司,中国]试剂盒提取花花柴的总RNA,再用PrimeScriptTMRT Master Mix反转录试剂盒(TAKARA 公司,中国)将其反转录为cDNA。
不同胁迫处理按时间梯度进行表达模式分析,半定量PCR 引物(表2),PCR 扩增体系为:95℃4 min,95℃30 s,35循环;57℃30 s,35循环;72℃1 min,38循环;72℃7 min,4℃15 min。用18S作为内参基因,用0.8%的琼脂糖凝胶电泳检测,用凝胶成像分析系统观察结果,并用Image J软件和Graphpad Pism9.5软件对条带灰度值进行统计学分析并绘图,进而确定在不同胁迫下Kc H TRs表达趋势。

表2 Kc HTRs 半定量PCR 引物序列Table 2 Primer sequences of semi-quantitative PCR for Kc HTRs
2 结果与分析
2.1 花花柴Kc HTRs 原核表达载体的构建
用1.2.2节花花柴反转录的cDNA 为模板,通过1.2.3节的PCR 程序扩增并用0.8%琼脂糖凝胶电泳检测扩增产物,双酶切后与p ET28a载体连接,热激转化大肠杆菌BL21挑取阳性菌落利用上述PCR 程序扩增后进行验证,分别获得708,777,780,771,789,777,765 bp 共7 条带,分别命名为Kc HTR1、Kc HTR2、Kc HTR3、Kc HTR4、Kc HTR5、Kc H TR7、Kc H TR8,如图1所示。
M.DL2000;A.泳道1-5分别为Kc HTR1、Kc H TR2、Kc H TR5、Kc H TR7、Kc H TR8;B.泳道1-2分别为Kc H TR4、Kc H TR3。图1 转Kc HTRs 大肠杆菌BL21菌落PCR 验证图M,DL2000.A.Lanes 1-5 are K c HTR1,Kc H TR2,Kc H TR5,Kc HTR7,and K c HTR8,respectively.B.Lanes 1-2 are K c H TR4 and K c H TR3,respectively.Fig.1 PCR verification of the BL21 colonies transformed with K c H TRs
2.2 花花柴Kc HTRs 原核表达结果
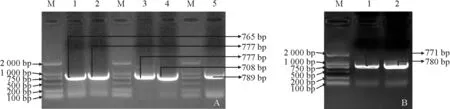
将阳性克隆的Kc H TRs菌液在含有硫酸卡那霉素(50 mg/L)的液体LB 培养基中扩大培养至OD600达到0.8 后加入终浓度 为0.5 mmol/L 的IPTG 溶液,分别诱导0,2,4,6,8,10,12 h,用OD600为0.8且同样加入终浓度0.5 mmol/L IPTG溶液的大肠杆菌BL21和BL21-pET28a作为对照,结果表明:Kc HTRs表达蛋白的大小在27~29 kD 之间,如图2所示。通过不同诱导时间发现,花花柴Kc HTRs蛋白在诱导时间达到8~10 h时表达量趋于稳定,并达到最高,故确定最佳诱导表达时间为8~10 h。
将阳性克隆的Kc H TR1菌液在含有硫酸卡那霉素(50 mg/L)的液体LB 培养基中扩大培养至OD600达到0.8 后,分别加入终浓度为0.2,0.3,0.4,0.5,0.6,0.7,0.8 mmol/L 的IPTG 溶液诱导8 h,用OD600为0.8 且加入终浓度0.5 mmol/L IPTG 溶液的大肠杆菌BL21和BL21-p ET28a作为对照,结果发现当IPTG 浓度大于0.5 mmol/L 后蛋白表达量达到最高,综合经济效益考虑确定最佳诱导Kc HTRs蛋白的IPTG 浓度为0.5 mmol/L,如图3,A 所示。
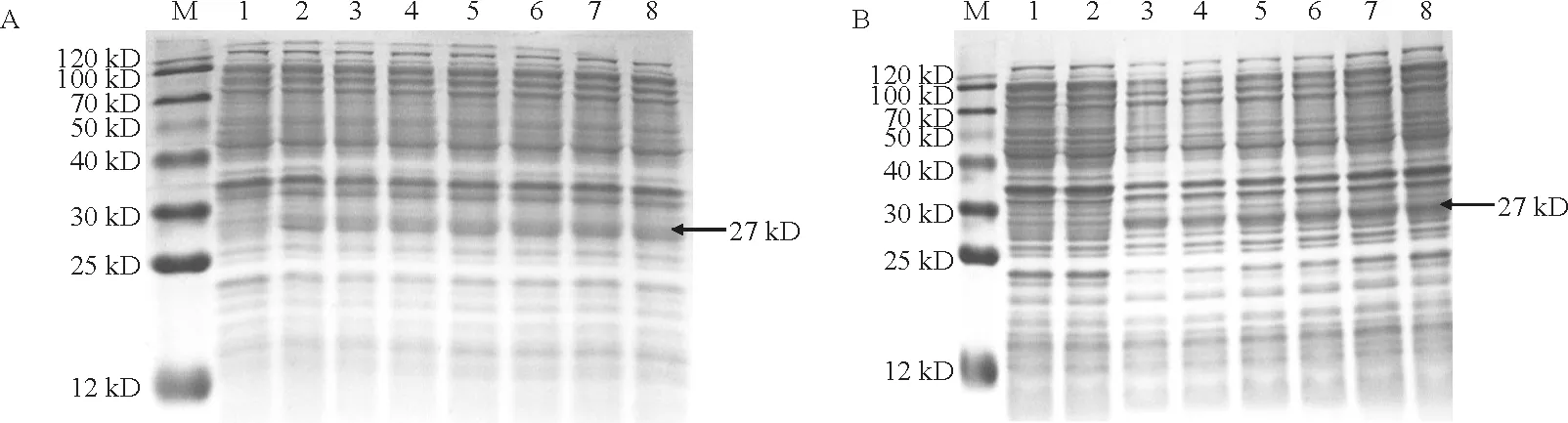
图3 不同IPTG 浓度(A)和OD600(B)对花花柴Kc HTRs蛋白表达的影响Fig.3 Effects of different IPTG concentrations(A)and OD600 (B)on the expression of Kc HTRs in K.caspia
将阳性克隆的Kc HTR1菌液在含有硫酸卡那霉素(50 mg/L)的液体LB 培养基中扩大培养至OD600达到0.4,0.5,0.6,0.7,0.8,0.9,1.0,加入0.5 mmol/L 的IPTG 溶液诱导8 h,用OD600为0.8且加入终浓度0.5 mmol/L IPTG 溶液的大肠杆菌BL21和BL21-p ET28a作为对照,结果发现当菌液OD600达到0.8时蛋白表达量到最高,为节约试验时间并达到最好的试验效果确定最佳诱导Kc HTRs蛋白的OD600值为0.8,如图3,B所示。
2.3 重组BL21(pET28a-KcHTRs)的抗逆性分析
按照1.2.5节的试验方法进行重组质粒的抗逆性分析,以无胁迫处理37℃正常培养的重组大肠杆菌生长情况作为对照。结果(图4)发现,在无胁迫处理时重组大肠杆菌均能够正常生长,且生长趋势一致,但在45℃高温胁迫时除Kc H TR8之外其余菌落生长数均明显高于p ET28a,在4℃低温胁迫时Kc HTR2、Kc HTR3、Kc HTR4、Kc HTR5的 菌落生长数均高于p ET28a,在3种不同的盐浓度胁迫下Kc H TR2、Kc H TR5均比对照生长得好,Kc HTR2、Kc HTR5在盐浓度达到0.3 mol/L NaCl时生长状态均好于对照组,但是在盐浓度为0.2 mol/L NaCl时Kc HTRs的菌落生长状态相比较对照较好,盐浓度为0.1 mol/L NaCl时Kc HTR1、Kc HTR2、Kc HTR5菌落生长状态均好于对照,且菌落形成率与对照相比有显著性差异。因此花花柴除Kc H TR8以外均能够提高重组大肠杆菌的耐高温性,花花柴Kc HTR2、Kc HTR3、Kc HTR4、Kc HTR5能够提高重组大肠杆菌的耐低温性,重组大肠杆菌p ET28a-Kc HTRs在0.2 mol/L NaCl溶液中展现出较好的耐盐性,花花柴Kc HTR2、Kc HTR5能够提高重组大肠杆菌的耐盐性。综上所述,Kc HTRs能够在一定程度上增加大肠杆菌对逆境胁迫的抗性。

*、**、***分别表示处理内p ET28a-Kc HTRs与p ET28a分别在0.05、0.01、0.001水平存在显著性差异,ns则表示无显著性差异。图4 花花柴Kc HTRs 在大肠杆菌中的抗逆性分析*,**,and***indicate significant difference between pET28a-Kc HTRs and pET28a at 0.05,0.01,and 0.001 levels,respectively.ns indicates no significant difference.Fig.4 Stress resistance analysis of Kc HTRs in E.coli
2.4 花花柴Kc HTRs 极端温度及高盐胁迫表达模式分析
2.4.1 高温胁迫表达模式
45℃高温胁迫表达模式分析结果显示:Kc HTRs均在高温处理5 min时表达量降低,当处理时间延长到0.5 h时表达量增加,处理时长增加到2 h时表达量降低,但当处理时间为4 h时表达量高于未处理时,Kc HTR3、Kc HTR4、Kc HTR7在45℃高温处理时在根茎叶中的表达量一直较高,而Kc H TR1、Kc H TR2、Kc H TR8在45℃高温时普遍在根和茎中的表达量较高,Kc HTR5在茎和叶中的表达量较高,该结果表明花花柴Kc H TRs在面对45℃高温胁迫时表达量呈现出高—低—高的趋势(图5,A)。
2.4.2 低温胁迫表达模式
4℃低温胁迫表达模式分析结果显示:Kc HTRs在遭受冷胁迫时在根器官中的表达量较高,Kc HTR2、Kc HTR5、Kc HTR7、Kc HTR8在4℃低温处理5 min时表达量降低,随着低温处理时间增加到0.5 h时表达量上升,当低温处理时间达到8 h时表达量几乎与未处理一致,除Kc HTR5以外其余成员的表达量比未处理时表达量还高,然而Kc HTR1、Kc HTR3、Kc HTR4、Kc HTR5在4℃低温胁迫处理过程中在茎中几乎没有表达,在叶中的表达量也较低。该现象表明花花柴Kc HTRs在面对4℃低温胁迫时表达量总体呈现高—低—高的趋势,说明花花柴在面对4℃低温胁迫时Kc HTRs在根部总体上调表达,而Kc H TR2、Kc H TR5在根和叶中均能够较好的响应低温胁迫(图5,B)。
2.4.3 高盐胁迫表达模式
400 mmol/L Na+高盐胁迫表达模式分析显示:Kc H TRs在400 mmol/L Na+高盐胁迫处理2 h时表达量降低,处理时长达到4 h时Kc HTR7和Kc H TR8表达量增加,当处理时长达到8 h 时Kc HTR1、Kc HTR5、Kc HTR7、Kc HTR8均增加,但表达量仍然低于未处理时的表达量,且在应对高盐胁迫时在根茎叶中均有较高的表达量,但Kc HTRs在遭受400 mmol/L Na+高盐胁迫时表达量均低于未处理时,表明花花柴Kc HTRs并不能积极响应400 mmol/L Na+高盐胁迫(如图5,C)。
3 讨论
研究表明在植物体内14-3-3 蛋白具有2 个高度保守的结构域[16],通过构建系统发育树发现花花柴Kc HTR5、Kc HTR3和拟南芥GRF9、GRF7蛋白质序列相似性最高,研究发现拟南芥GRF9编码14-3-3蛋白,主要响应低温胁迫并增强了拟南芥的耐旱性[17],而花花柴Kc HTR5 蛋白比拟南芥GRF9所编码的14-3-3蛋白多出Motif5,其氨基酸序列为:EREENVYMAKLAEQAERYEEMVEFMEKVA,根据花花柴低温表达模式分析结果显示Kc H TR5在应对低温胁迫和高盐胁迫时表达量总体呈现增加的趋势,故推测其不仅具有耐低温性、耐旱性,还有一定的耐盐性,推测Kc HTR3仅具有耐极端温度的功能。花花柴Kc HTR2、Kc HTR4与番茄TFT8、Kc HTR8与TFT10、Kc HTR7和Kc HTR1蛋白与TFT5蛋白质序列相似性最高[16],研究表明番茄这类基因编码的14-3-3蛋白在遭受极端温度时被大量激活[18-19],同时花花柴极端温度表达模式分析和在细菌中的抗逆性结果分析显示,推测花花柴Kc H TRs同样具有耐极端温度广谱抗逆性。
14-3-3蛋白可以直接通过影响蛋白与蛋白之间的互作,而广泛存在于所有真核生物中,并发挥靶蛋白的调节作用[20],14-3-3蛋白调节其他靶蛋白作用主要是通过结合靶蛋白上特定的位点并经磷酸化介导[10,21]。14-3-3蛋白具有较强的适应能力,它可以在多蛋白复合物中发挥作用[22],它们还可以通过调节转录因子的活性或者定位来调节应激诱导基因的表达[6]。由于14-3-3蛋白特殊的结构,其在植物逆境胁迫中扮演者多种多样的角色,因此通过研究花花柴抗逆相关基因的分子机理,利用其抗逆原理,将其转入到棉花等经济作物中[23],可提高农作物对逆境胁迫的耐受性,并且为后期花花柴抗逆性基因资源发掘与研究提供理论依据。
4 结论
研究用原核表达系统在大肠杆菌BL21中异源表达了花花柴Kc HTRs 蛋白,明确了花花柴Kc HTRs蛋白在大肠杆菌BL21 最适生长温度37℃下其最佳诱导表达体系为OD600达到0.8,IPTG最佳诱导浓度为0.5 mmol/L,诱导时间为8~10 h,并对重组BL21(p ET28a-Kc HTRs)的抗逆性进行研究,发现其能够明显提高宿主菌对极端温度和高盐胁迫的耐受性,说明花花柴Kc HTRs具有耐极端温度,耐盐等优异的广谱抗逆性。通过对花花柴Kc HTRs进行耐极端温度(45℃、4℃)和耐盐性(400 mmol/L Na+)的表达模式分析发现,花花柴Kc HTRs耐极端温度的能力较强,而耐高盐胁迫的能力较一般,花花柴Kc H TRs在面对极端温度胁迫时总体表达趋势呈现高—低—较高,说明花花柴植株在面对逆境胁迫时表现出耐受-响应-适应的过程。

