一种[60]富勒烯环丙烷二羧酸酯衍生物的合成研究
宋建兴,刘修善,尹少杰,柴明顶,王兴宇,李法宝
(湖北大学化学化工学院, 湖北 武汉 430062)
0 前言
1990年,Kräschmer等采用石墨棒电弧蒸发法在实验室成功制备了含量为1%的富勒烯烟灰[1],自此以后,越来越多合成富勒烯的方法相继被人们发现。[60]富勒烯(C60)由于丰度大、成本低、纯度高和完美对称性引起了科学家的广泛关注。截至目前,[60]富勒烯及其衍生物的应用研究已扩展到多个领域,包括:生物、物理、能源、材料等,并表现出了巨大的潜力和非同一般的应用价值[2-7]。尽管C60有着诸多的优点,但由于其完美的对称性,使得自身毫无极性,依照相似相溶原理,这一点使得它在绝大多数极性有机溶剂中溶解性很差,因此严重限制了富勒烯及其衍生物的应用和发展。然而对富勒烯表面进行功能化修饰,不仅可以改善它在极性有机溶剂中的溶解性,还可以得到更多结构丰富的富勒烯衍生物。因此探索和发展更多的化学反应来对富勒烯进行功能化修饰就变得至关重要。合成结构丰富多样的富勒烯衍生物已经成为当下合成化学家们研究的重点[8-10]。而这也对富勒烯及其衍生物在其他领域的潜在应用有着积极的推动作用。富勒烯环丙烷衍生物是一类能够应用于有机太阳能电池领域的重要富勒烯化合物,部分富勒烯环丙烷化合物例如PCBM([6,6]-phenyl-C61-butyric acid methyl ester)已被成功作为有机太阳能电池电子受体材料且实现商业化,受到了广泛关注。Bingel反应[11]是制备富勒烯环丙烷衍生物最有效、最经典的方法,另一种制备方法是重氮化合物参与的反应[12-13]。然而,已知制备富勒烯环丙烷衍生物的方法仍然有一些合成的局限性,例如反应条件苛刻、化学选择性不易控制、反应底物种类有限等。因此继续探索和开发新的制备富勒烯环丙烷衍生物的方法将显得尤为重要。
本工作通过利用碘叶立德热分解反应原位产生的活性卡宾,对C60分子进行加成反应,制备了一系列单加成与多加成富勒烯环丙烷二羧酸酯衍生物。同时利用制备的富勒烯环丙烷二羧酸叔丁酯在酸性条件下的水解反应,定量获得水溶性较好的富勒烯环丙烷二羧酸衍生物,增强了富勒烯衍生物在各个领域的潜在应用价值。另外,当前合成方法成功克服了重氮化合物法导致5,6-开环富勒烯衍生物生成的弊端。
1 实验部分
1.1 仪器与试剂
仪器:Bruker(400 MHz)核磁共振仪,恒温加热磁力搅拌器,AL-206型电子天平(上海,梅特勒-拖利多公司),SHZ-Ⅲ型循环水式真空泵(上海荣生化学仪器厂),旋转蒸发仪,氮气保护装置。试剂:所用试剂除碘叶立德外均为市售,试剂纯度均为AR。
1.2 合成表征
所有产物(2a~c和3~6)为已知化合物,均通过核磁共振氢谱(1H NMR)进行了结构确认。以富勒烯环丙烷二羧酸酯2b的1H NMR谱为例(如图1),我们可以清楚地看到化学位移在4.40~4.50范围内有一个四重峰(q峰),对应于与氧直接相连的2个亚甲基上的4个氢质子信号;而化学位移在1.4~1.5范围内有一个三重峰(t峰),对应于2个甲基上的6个氢质子信号。所有氢质子的裂分方式、化学位移以及氢个数均符合预期的结构。
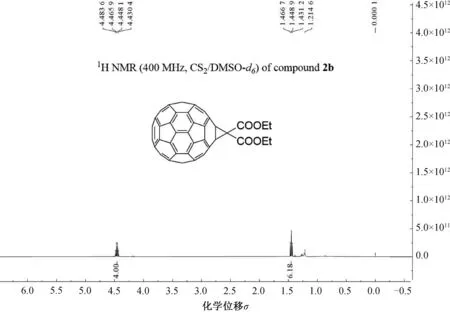
图1 [60]富勒烯环丙烷二羧酸酯2b的1H NMR
1.3 原料的制备
本章节所使用的原料按照已报道方法合成[14-15],包括两步反应,其中第一步制备浑浊液,第二步加入醋酸碘苯进行反应(如图2)。
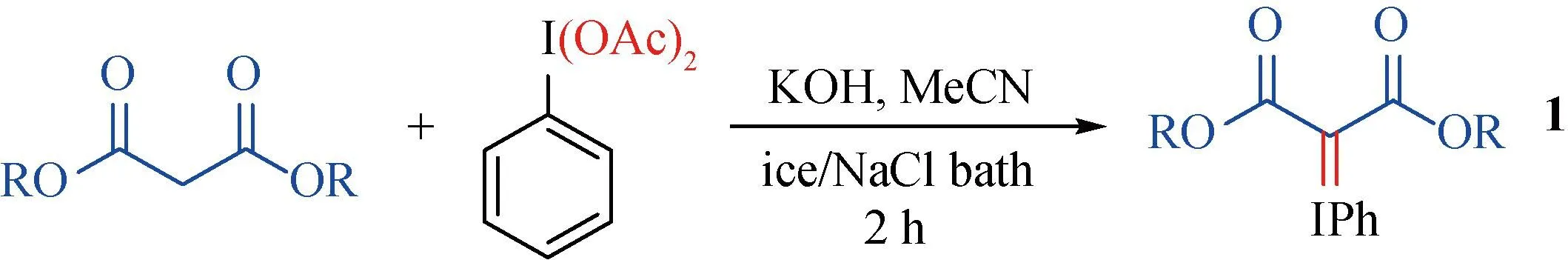
图2 碘苯二羧酸酯的制备
第一步:称取KOH固体(2 g, 36 mmol)加入100 mL反应瓶中,以20 mL乙腈为反应溶剂,加入丙二酸酯化合物(6 mmol),在空气条件下搅拌5 min,制成浑浊液。
第二步:称取醋酸碘苯(2.13 g, 6.6 mmol)加入已制备的浑浊液中,快速进行氮气保护,在冰盐浴下搅拌2 h,停止反应。在室温下,利用旋转蒸发仪除去溶剂,得到碘苯二羧酸酯1。
1.4 C60与碘叶立德反应
将C60(36 mg, 0.05 mmol)、碘叶立德1(0.25 mmol)加入到100 mL圆底烧瓶中。再利用超声震荡使化合物完全溶解在6 mL邻二氯苯(ODCB)中,将所得反应液置于预设为50 ℃油浴锅中加热并在空气条件下搅拌,用薄层色谱(TLC)点板跟踪反应。待反应结束后,将未经处理的反应液利用短硅胶柱过滤,随后在旋转蒸发仪上去除溶剂,得到粗产品。最后,利用柱层析技术分离纯化少量二硫化碳溶解的粗产物,以二硫化碳为洗脱剂首先得到未反应的C60,再用二硫化碳/二氯甲烷为洗脱剂得到目标产物2。
1.4.1 富勒烯环丙烷二羧酸酯2a的合成
根据上述一般步骤,将C60(36 mg, 0.05 mmol)和碘叶立德1a(104.5 mg, 0.25 mmol)加入到100 mL圆底烧瓶中,在50 ℃反应3 min,分离得到未反应的C60(10.2 mg, 28%)和棕色无定型状粉末目标产物2a(20.7 mg, 44%);1H NMR (400 MHz, CS2/DMSO-d6)δ(ppm): 1.64 (s, 18H)。
1.4.2 富勒烯环丙烷二羧酸酯2b的合成
根据上述一般步骤,将C60(36 mg, 0.05 mmol)和碘叶立德1b(90.5 mg, 0.25 mmol)加入到100 mL圆底烧瓶中,在50 ℃反应7 min,分离得到未反应的C60(13.5 mg, 38%)和棕色无定型状粉末目标产物2b(21.0 mg, 48%);1H NMR (400 MHz, CS2/DMSO-d6)δ(ppm): 4.46 (q,J= 7.1 Hz, 4H), 1.45 (t,J= 7.1 Hz, 6H)。
1.4.3 富勒烯环丙烷二羧酸酯2c的合成
根据上述一般步骤,将C60(36 mg, 0.05 mmol)和碘叶立德1c(83.5 mg, 0.25 mmol)加入到100 mL圆底烧瓶中,在50 ℃反应15 min,分离得到未反应的C60(2.7 mg, 8%)和棕色无定型状粉末目标产物2c(22.9 mg, 54%);1H NMR (400 MHz, CS2/DMSO-d6)δ(ppm): 4.00 (s, 6H)。
1.4.4 二加成富勒烯环丙烷二羧酸酯3的合成
根据上述一般步骤,将2a(18.7 mg, 0.02 mmol)和碘叶立德1a(41.8 mg, 0.10 mmol)加入到100 mL圆底烧瓶中,在50 ℃反应8 min,分离得到未反应的2a(10.5 mg, 56%)和棕色无定型状粉末目标产物3(8.7 mg, 38%);1H NMR (400 MHz, CS2/DMSO-d6)δ(ppm): 1.73~1.56 (m, 36H)。
1.4.5 三加成富勒烯环丙烷二羧酸酯4的合成
根据上述一般步骤,将3(23.0 mg, 0.02 mmol)和碘叶立德1a(41.8 mg, 0.10 mmol)加入到100 mL圆底烧瓶中,在50 ℃反应8 min,分离得到未反应的3(3.3 mg, 14%)和棕色无定型状粉末目标产物4(11.3 mg, 42%);1H NMR (400 MHz, CS2/DMSO-d6)δ(ppm): 1.73~1.45 (m, 54H)。
1.4.6 四加成富勒烯环丙烷二羧酸酯5的合成
根据上述一般步骤,将4(27.2 mg, 0.02 mmol)和碘叶立德1a(41.8 mg, 0.10 mmol)加入到100 mL圆底烧瓶中,在50 ℃反应15 min,分离得到未反应的4(10.1 mg, 37%)和棕色无定型状粉末目标产物5(5.2 mg, 17%);1H NMR (400 MHz, CS2/DMSO-d6)δ(ppm): 1.61~1.45 (m, 72H)。
1.4.7 富勒烯环丙烷二羧酸6的合成
将2a(18.7 mg, 0.02 mmol)和TsOH·H2O(11.4 mg, 0.06 mmol)加入到100 mL圆底烧瓶中,再通过超声处理使化合物完全溶解在6 mL氯苯(CB)中,将所得反应液置于预设为130 ℃油浴锅中加热并在空气条件下搅拌,用薄层色谱(TLC)点板跟踪反应。待反应结束后,冷却至室温,利用柱层析技术分离纯化,以二硫化碳/二氯甲烷为洗脱剂首先得到未反应的2a,再用二硫化碳/乙酸为洗脱剂得到棕色无定型状粉末目标产物6(产率> 95%)。
2 结果与讨论
本研究以碘苯丙二酸二叔丁酯1a与C60反应生成[60]富勒烯环丙烷二羧酸叔丁酯化合物2a为模板反应,针对反应条件进行了详细的优化,所有数据汇总于表1。起始反应没有添加促进剂,以邻二氯苯(ODCB)为反应溶剂,反应温度为150 ℃,反应的摩尔比C60∶1a为1∶2,反应6 min后,能以15%的收率获得一个新的化合物(序号1,表1),经核磁共振波谱分析,确定产物结构为[60]富勒烯环丙烷二羧酸叔丁酯2a。当持续增加碘叶立德1a的当量到6倍时(序号1~4,表1),产物的产率先升高后降低,并在5倍当量时取得最高产率(序号3,表1)。确定了1a的当量后,开始对反应温度进行了优化(序号5~9,表1)。反应温度的降低,使得产率有所增加(序号5,表1),并且在40~70 ℃区间内,产率变化不明显(序号6~8,表1),最终确定了在50 ℃时,反应的效果比较理想(序号7,表1)。为排除空气中氧气对反应的影响,我们研究了氮气条件下的反应,最终获得了相同的产物产率,证明了氧气对反应并无明显的影响(序号10和7,表1)。所以,最佳的反应条件为在空气条件下,摩尔比为:C60∶1a= 1∶5,在50 ℃的邻二氯苯中反应(序号7,表1)。

表1 C60与碘苯丙二酸二叔丁酯1a反应条件的优化a
表2 C60与碘叶立德1反应条件及产率a,b,c
表3 多加成反应的反应条件及产率a,b,c
在最优条件下,我们进行了底物拓展,考察了几类简易合成的碘叶立德化合物。在加热条件下,按照C60∶1a= 1∶5的摩尔比,在邻二氯苯(ODCB)中,50 ℃下进行反应。不同的碘叶立德化合物(1a~c)均能以较高的产率得到富勒烯环丙烷二羧酸酯化合物(44%~54%)。
a除非另外说明,所有反应均在空气条件下,在6 mL邻二氯苯(ODCB)中进行;bC60/1=1∶5;c分离产率
利用底物1a的高反应活性,在产物2a的基础上,进行了再次反应,可以很好的得到二加成的产物3;利用相同的方法,经过多次梯次加成后,我们成功得到了三加成产物4和四加成产物5,并且可以保持较好的产率,对于四加成产物,可能由于空间位阻的影响,导致产率有所下降。这些结构复杂的[60]富勒烯环丙烷化合物在各领域具有潜在的应用价值。
a除非另外说明,所有反应均在空气条件下,在6 mL邻二氯苯(ODCB)中进行;b2a或3或4/1a= 1∶5;c分离产率基于我们先前报道的方法[16],富勒烯环丙烷二羧酸叔丁酯2a可以在一水合对甲苯磺酸(TsOH·H2O)存在下进行水解,从而定量得到具有一定水溶性的富勒烯环丙烷二羧酸化合物6(如图3)。同样,对于多加成的产物可以使用相同的方法得到对应的[60]富勒烯环丙烷多羧酸化合物。使得该方法在合成水溶性富勒烯领域具有一定的参考价值,并将更多的功能基团引入富勒烯分子。
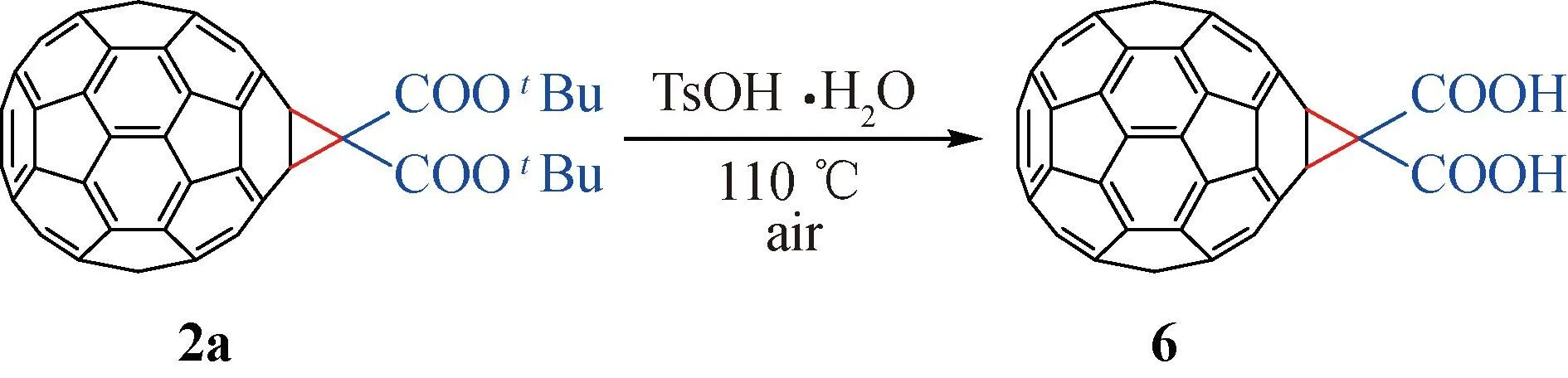
图3 [60]富勒烯环丙烷二羧酸的制备


图4 富勒烯环丙烷二羧酸酯衍生物可能的生成机理
3 结论
在空气条件下,通过加热使[60]富勒烯与不同的碘叶立德发生热分解反应,制备了一系列[60]富勒烯环丙烷二羧酸酯衍生物。在单次加成产物的基础上,研究了多次加成反应,得到了一系列二加成、三加成以及四加成的富勒烯环丙烷二羧酸酯衍生物。所有合成的羧酸叔丁酯化合物可以在一水合对甲苯磺酸存在下进行水解,生成水溶性较好的富勒烯环丙烷二羧酸衍生物,对于拓展其在众多领域的应用具有重要意义。

