2,6-双(1,2,3-三唑-4-基)吡啶钌(Ⅱ)的合成及其光催化性能的研究
刘佳欣,聂俊琦
(湖北大学化学化工学院, 湖北 武汉 430062)
0 引言
传统化石燃料的过度使用造成了日益严重的能源危机和环境问题.因此,清洁和可持续的能源以及能源转换系统需求巨大。在这方面,利用光催化剂将太阳能直接转化为化学能的可见光驱动光催化提供了一种有前景的替代方案[1-2]。迄今为止,基于过渡金属的光催化体系,如钌(Ⅱ)或铱(Ⅲ)络合物,由于其在可见光区域的高吸收性能和长激发态寿命,无疑是最广泛研究的光催化剂之一。过渡金属光催化剂的使用允许在温和条件下以高产率进行多种有机转化,并且还提供了容易获得新型分子结构的途径[3]。已发现具有不同结构和电子性质的配体强烈影响这些金属络合物的氧化还原性质[4]。然而,用于钌光催化的配体的非常少,探索具有合适配体的新型有效的钌光催化剂非常重要。
硫代氨基甲酸酯是一种有用的生物活性化合物,具有广泛的生物活性[5-7]。在过去的几十年里,人们付出了巨大的努力来合成这些模式。传统方法主要包括光气或羰基二咪唑与胺和硫酚的反应[8-10],使用一氧化碳和元素硫/二硫化物对伯胺进行硫代羧化[11-12]。还开发了涉及异氰酸酯的硫代氨基甲酸酯的替代方法[13-17]。通常,这些合成方案大多有缺点,例如危险的试剂、相对苛刻的反应条件、较差的原子经济性和金属盐。最近,Wei和他的同事报道了有机染料促进的硫代氨基甲酸酯的光催化合成,这可能是一种获得硫代氨基酸酯的环保方法[18]。然而,有机染料常常受到稳定性降低的困扰。另一种常用的光催化系统,如钌或铱络合物[3,19],则可能是避免有机染料缺点的替代解决方案。
2,6-双(1,2,3-三唑-4-基)吡啶钌(Ⅱ)是高分子领域一种常见的功能单位,可用于光化学和医药领域[20-25],然而其光催化性能研究还未见报道。本文中制备了钌络合物2,6-双(1,2,3-三唑-4-基)吡啶钌(Ⅱ)六氟磷酸盐Ru(btp)2(PF6)2,通过核磁氢谱、碳谱、高分辨质谱和元素分析证实了它的合成。研究发现,此络合物可以有效地吸收可见光,具有和商业化的钌催化剂类似的氧化还原电位,可以高效光催化硫醇合成二硫化物的偶联反应。
1 实验部分
1.1 试剂和仪器
试剂:苯胺,2,6-二乙炔基吡啶,六氟磷酸铵,五水合硫酸铜(CuSO4·5H2O),抗坏血酸钠,三水合氯化钌(Ⅲ)(RuCl3·3H2O),2,2,6,6-四甲基哌啶氧基(TEMPO),丙酮(acetone),四氢呋喃(THF),甲苯(toluene),乙腈(CH3CN),N,N-二甲基甲酰胺(DMF),乙醇(EtOH)。以上试剂均为市售分析纯,直接使用。
仪器:核磁共振仪使用WIPM 400 MHz(中科开物公司),恒温加热磁力搅拌器(德国IKA公司),AL-206型电子天平(上海梅特勒-拖利多公司),SHZ-Ⅲ 型循环水式真空泵(上海荣生化学仪器厂),旋转蒸发仪(河南巩义予华仪器厂)。
1.2 合成路线

图1 络合物Ru(btp)2(PF6)2的合成路线
叠氮苯的合成:在配有磁力搅拌子的圆底烧瓶中,将苯胺(930 mg, 10 mmol)悬浮在冰浴中冷却的盐酸中(6 mol/L, 10 mL),然后滴加亚硝酸钠水溶液(4 mol/L, 5 mL)。将反应混合物搅拌0.5 h,并滴加叠氮化钠水溶液(4 mol/L, 5 mL)。随后,混合物在室温下再搅拌12 h,然后用乙酸乙酯(15 mL × 3)萃取混合物。有机提取物用盐水洗涤并用MgSO4干燥。在真空下除去溶剂,得到粗产物,通过硅胶柱色谱法纯化(石油醚),得到叠氮苯(1.08 g, 91%)。1H NMR (400 MHz, CDCl3)δ=7.42~7.33 (m, 2H), 7.20~7.13 (m, 1H), 7.10~7.00 (m, 2H);13C NMR (101 MHz, CDCl3)δ= 140.04, 129.78, 124.89, 119.04。
化合物btp的合成:将2,6-二乙炔基吡啶(305 mg,2.4 mmol)、叠氮苯(595 mg, 5.0 mmol),CuSO4·5H2O(0.25 g,1.0 mmol)和抗坏血酸钠(0.198 g,1.0 mmol)加入到10 mL DMF中,所得混合物在氮气氛和90℃条件下搅拌48 h。反应完毕,反应液冷却至室温并加入10 mL水.混合物用二氯甲烷(20 mL×3)萃取,有机相用盐水洗涤并用MgSO4干燥.在真空下除去溶剂,得到粗产物,通过硅胶柱色谱纯化(二氯甲烷),得到btp(683 mg, 78%)。1H NMR (400 MHz, CDCl3)δ=8.67 (s, 2H), 8.17 (d,J= 7.8 Hz, 2H), 7.89 (t,J= 7.8 Hz, 1H), 7.78 (d,J= 8.0 Hz, 4H), 7.50 (t,J= 7.6 Hz, 4H), 7.42 (t,J= 7.4 Hz, 2H);13C NMR (101 MHz, CDCl3)δ=149.78, 148.83, 137.94, 136.92, 129.82, 128.94, 120.44, 120.22, 119.76。
化合物RuCl2(DMSO)4的合成:参考已报道的方法[20]。向100 mL三颈烧瓶中加入RuCl3·3H2O(1.0 g, 3.8 mmol)、异丙醇(15 mL)和DMSO(5 mL),将混合物脱气并用N2置换三次,在85 ℃下加热48 h后,将混合物冷却至室温.过滤所得沉淀物依次用丙酮、甲苯和乙醚洗涤.真空干燥后,得到黄色固体状产物(1.2 g,65%),直接使用,无需进一步纯化。
化合物Ru(btp)2(PF6)2的合成:参考已报道的方法[21],并做了部分修改。将含有[RuCl2(DMSO)4](196 mg, 405 μmol)的乙二醇溶液(20 mL)滴加到btp(296 mg, 810 μmol)的乙二醇(300 mL)悬浮液中。将反应混合物加热回流2 h,得到黄色溶液。随后加入饱和NH4PF6水溶液(3 mL),出现黄色固体沉淀。冷却至室温后,过滤,残留物用水彻底洗涤并真空干燥,然后将固体再溶于乙腈(50 mL)中并过滤以分离杂质。除去溶剂,将残留物真空干燥,得到产物Ru(btp)2(PF6)2(227 mg, 50%)。1H NMR (400 MHz, DMSO-d6),δ=10.02 (s, 4H), 8.67~8.49 (m, 6H), 7.76~7.62 (m, 8H), 7.61~7.44 (m, 12H);13C NMR (101 MHz, DMSO-d6),δ=150.58, 150.52, 139.19, 135.99, 130.64, 130.53, 125.13, 121.03, 120.96。HRMS (ESI, CH3OH):m/z= 416.090 1, (calcd 416.090 5 for [Ru(btp)2]2+)。
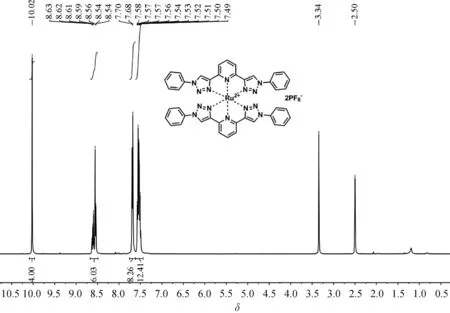
图2 Ru(btp)2(PF6)2的氢谱
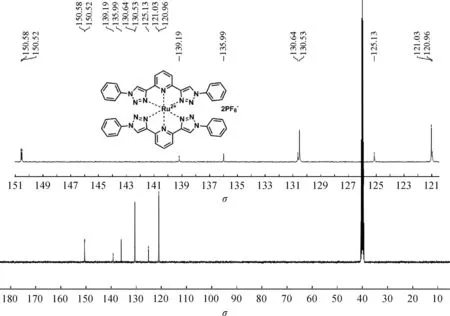
图3 Ru(btp)2(PF6)2的碳谱
1.3 硫代氨基甲酸酯的光合成
向玻璃管加入底物硫醇(0.2 mmol),异氰(0.5 mmol),Ru(btp)2(PF6)2(4.5 mg, 2 mmol%)和乙腈(3 mL)。将所得混合物脱气并用O2填充3次,然后在室温和O2氛下用蓝光LED(6 W)照射反应混合物.反应后,通过离心将催化剂从混合物中分离出来,并在减压下蒸发上清液.残余物做1H NMR测试,确定反应的收率。
2 Ru(btp)2(PF6)2在硫代氨基甲酸酯光合成中的催化作用
为了评价Ru(btp)2(PF6)2光催化性能,我们将其作为催化剂进行了硫代氨基甲酸酯的光合成。首先在蓝光照射下进行了异氰基乙酸乙酯与4-甲基苯硫醇的模型反应,反应时间6 h,筛选合适的条件。如表1所示,用EtOAc作为溶剂,催化剂表现出最佳的活性,以82%的收率得到产物(条目6),和小分子有机染料相比[18],反应时间更短,表明Ru(btp)2(PF6)2对硫代氨基甲酸酯光合成具有良好的催化性能.暴露在空气中或白光照射下的反应仅给出56%和44%的产率(条目8和9)。当使用市售Ru(bpy)3(PF6)2作为光催化剂时,反应产率为61%(条目10),这说明所制备的Ru(btp)2(PF6)2具有更好的催化效果. 随后我们探讨了时间对反应的影响,可以看出,反应5 h只有70%的收率(条目11),而反应时间7 h,其收率为84%(条目12),相较于反应6 h的收率,并没有明显的变化。
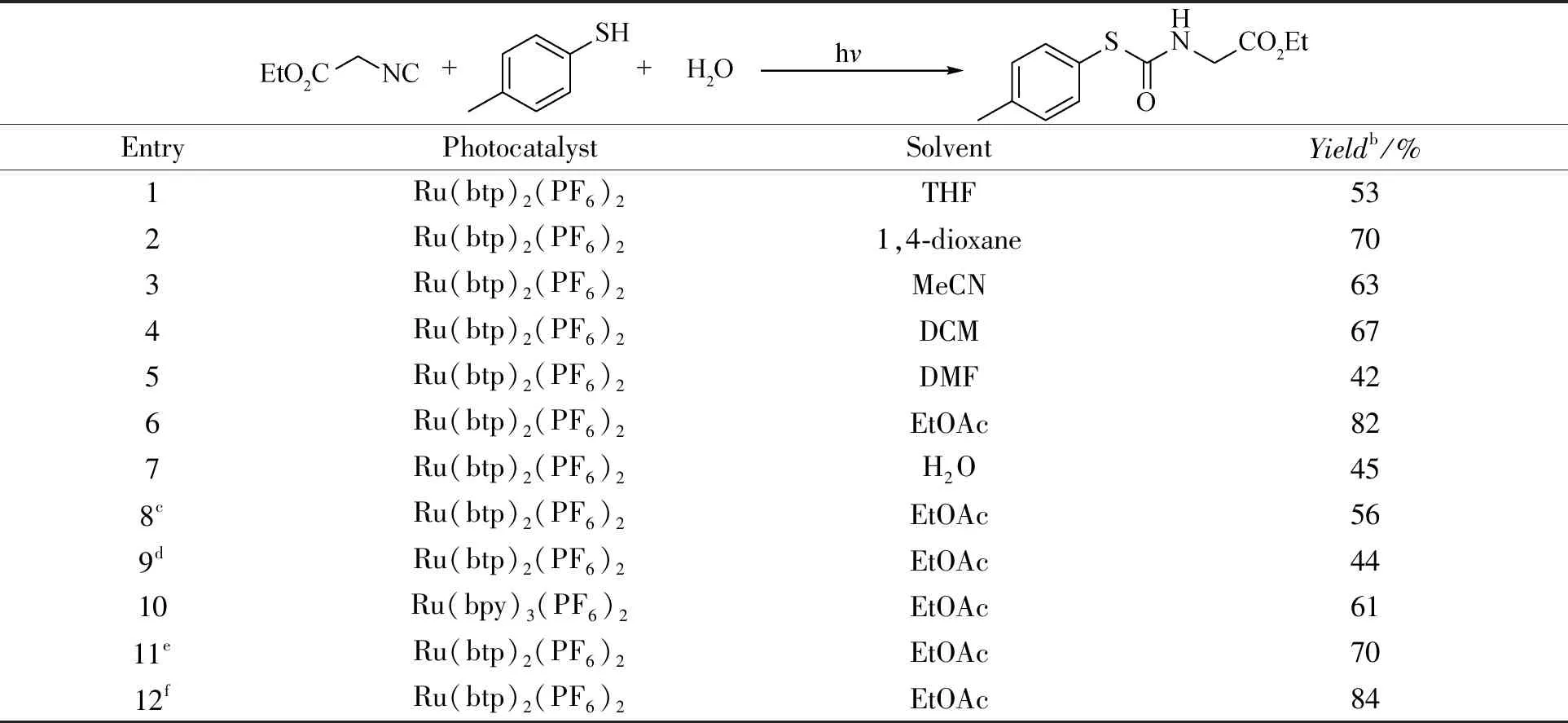
表1 硫代氨基甲酸酯光催化合成的条件筛选a
随后,我们使用Ru(btp)2(PF6)2作为光催化剂探索了硫醇和异氰反应合成硫代氨基甲酸酯的底物适用范围.如表2所示,一系列在苯环上带有富电子和吸电子取代基的芳基硫醇与异氰基乙酸乙酯反应良好,以良好的产率得到所需产物(条目1-6)。邻甲基、间甲基和对甲基取代基不会干扰反应(条目1-3)。萘-2-硫醇,一种空间要求更高的底物,也可以参与反应,以70%的产率提供相应的产物(条目7)。除异氰乙酸乙酯外,其他一些脂肪族异氰如异氰叔丁酯和异氰环己酯也与该光催化体系很好地兼容,产率分别为75和83%(条目8和9)。甲苯磺甲基异氰化物也可用于该方法,以77%的产率得到所需产物(条目10)。值得注意的是,该方法同样耐受芳香族异氰化物如4-甲基苯基异氰化物,以74%的产率提供产物(条目11)。此外,该催化体系与烷基硫醇如环己硫醇反应良好,并以中等产率得到相应的产物(条目12)。
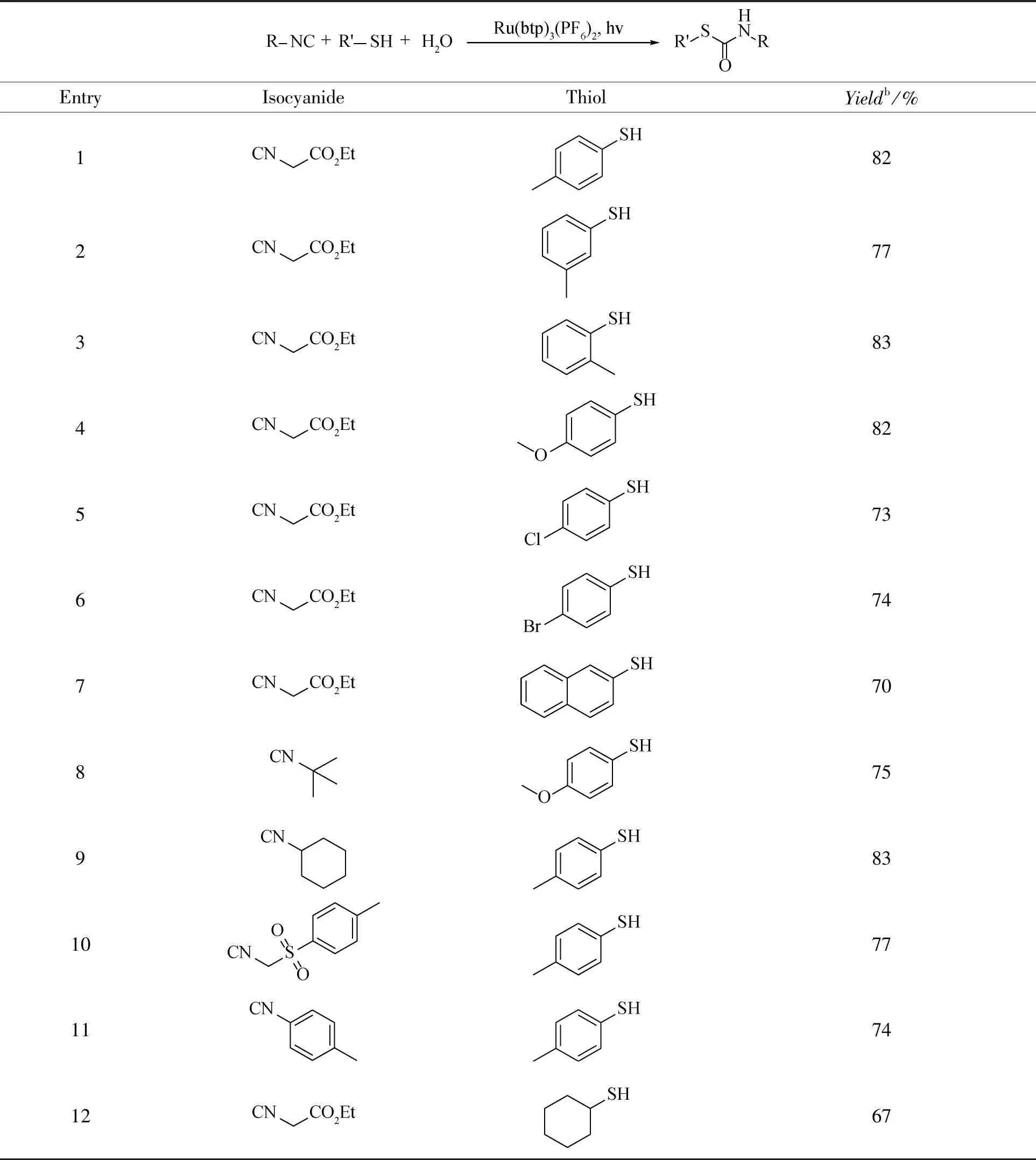
表2 Ru(btp)2(PF6)2光催化异氰和硫醇合成硫代氨基甲酸酯a
3 反应机理研究
为了探索反应机理,我们开展了一些对照实验。从图4(a)和4(b)的结果可以看出,在没有光照射或催化剂的情况下没有发生反应.当在N2氛下或在干燥溶剂中进行模型反应时,仅检测到微量产物(图4(c)和4(d)),表明氧和水在该反应中的关键作用。此外,添加超氧自由基清除剂(苯醌)可导致显著降低的反应速率(图4(e)),表明超氧自由基深参与反应.随着单线态氧清除剂(NaN3)的加入,反应产率没有显著降低(图4(f)),这意味着单线态氧气被排除在反应过程之外.此外,当在标准条件下添加TEMPO(自由基清除剂)时,反应被显著抑制(图4(g)),进一步表明反应可能经历自由基过程.此外,我们将KI/CH3COOH/淀粉引入催化体系,反应液变成蓝色,证明反应过程产生了过氧化氢.结合对照实验和先前报告的结果[18],我们提出了Ru(btp)2(PF6)2催化硫代氨基甲酸酯光合成的合理反应机理(图5)。起初,Ru(btp)2(PF6)2被光照射后形成激发态,激发态Ru2+还原氧分子生成超氧自由基阴离子O2·-, 并形成氧化态Ru3+。随后,Ru3+接受来自硫酚的电子,形成自由基阳离子A.然后A被去质子化,得到苯硫基B和过氧羟基自由基.过氧羟基自由基发生歧化反应生成氧和过氧化氢.同时,自由基B与异氰化物反应,生成碳自由基中间体C,该中间体可被另一分子Ru3+氧化,生成腈中间体D。中间体D与H2O发生反应,生成所需产物。
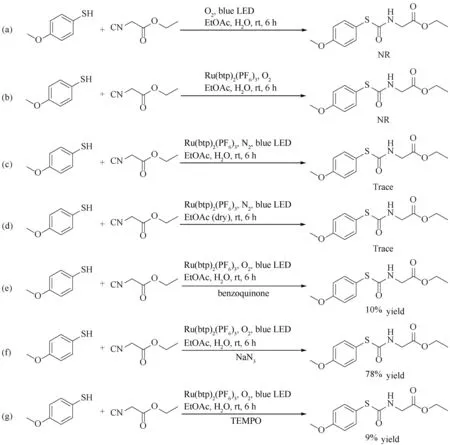
图4 开展的控制实验

图5 硫代氨基甲酸酯光合成的反应机理
4 结论
本研究利用2,6-双(1,2,3-三唑-4-基)吡啶作为配体,合成出了一种新型钌(Ⅱ)络合物2,6-双(1,2,3-三唑-4-基)吡啶钌(Ⅱ),并通过核磁氢谱和碳谱证实了其结构。该络合物在硫代氨基甲酸酯的光合成中表现出良好的催化活性,底物兼容性好,相应产物收率在65%~82%之间。一系列的控制实验表明,本催化反应的机理为Ru(btp)2(PF6)2首先被光照射激发,激发态Ru(Ⅱ)还原氧分子生成超氧自由基阴离子,并形成氧化态Ru(Ⅲ)。随后,Ru(Ⅲ)接受来自硫酚的电子,被还原形成Ru(Ⅱ),完成催化循环。产生的硫自由基与异氰化物反应,随后一系列转化产生腈正离子,并与H2O发生反应,生成硫代氨基甲酸酯。

