肝脏血管肉瘤的临床病理特征及诊断难点分析
刘周英 杜俊 张劲松 刘东戈 杨重庆
肝脏血管肉瘤(hepatic angiosarcoma,HAS)是一种少见的肝脏恶性肿瘤,占肝脏恶性肿瘤的0.1~2.0%[1]。本文分析6例HAS患者的病历资料、影像学检查、病理形态特征及免疫组化染色特点、治疗方案等,旨在提高临床与病理医师对此病的认识水平。
对象与方法
一、研究对象
纳入北京医院2014年6月至2022年6月病理诊断为HAS的患者6例,收集临床病历资料、影像学检查、肿瘤标志物及肝功能指标。患者中4例男性,2例女性,平均年龄为62.7岁。其中5例患者为健康检查时偶然发现,仅有1例患者出现腹痛。所有患者术前均进行了B超、腹部CT等影像学检查,5例患者影像学提示为肝脏多发占位,1例患者为单发占位。术后随访时间6~34个月,所有患者均死亡,1例患者随访过程中出现骨髓转移。
二、方法
肝脏切除标本取材部位包括肿物及周围肝脏,肝脏穿刺标本常规取材。脱水、浸蜡,石蜡包埋并切片(5~6 μm),苏木素-伊红染色及免疫组织化学染色,光学显微镜下观察。采用EnVision两步法进行免疫组织化学染色。一抗抗体(CD31、CD34、ERG、Fli-1等)、二抗抗体及显色液(DAB)均购自北京中杉金桥生物技术有限公司,以棕黄色颗粒为阳性。PBS缓冲液代替一抗作为阴性对照。
结 果
一、 临床特征
5例患者无明显不适,为健康检查时偶然发现,仅有1例患者出现腹痛。5例患者影像学提示为肝脏多发占位,1例患者为肝脏单发占位,见表1。3例患者影像学随访2~3个月后,发现结节体积增大,结节数量增多,另3例患者无影像学随访数据。1例患者发现时已有远处转移, 1例患者2年后出现骨髓转移。

表1 6例患者的临床资料及随访结果
血清学检查发现,1例患者CA125升高为87.7 U/mL,其余患者肿瘤标志物(CEA、CA125、CA199、AFP、SCC)均在正常范围内。1例出现AST(45 U/mL)、GGT(235 U/L)、LDH(475 U/L)水平升高,1例患者ALT(252 U/mL)及AST(90 U/mL)升高。
术后随访患者的生存时间为6~34个月,平均生存时间为12.8个月。
二、 病理检查
1例影像检查为单发结节,行部分肝脏切除术,5例为肝脏多发占位,行肝脏穿刺活检术。肝脏切除标本见肿物为肝实质内单一结节,最大径3.5 cm,切面呈灰褐色、实性、质软、肿瘤无包膜、边界尚清楚。穿刺标本为灰黄至灰白色组织,长0.5~1.7 cm,直径均为0.1 cm。
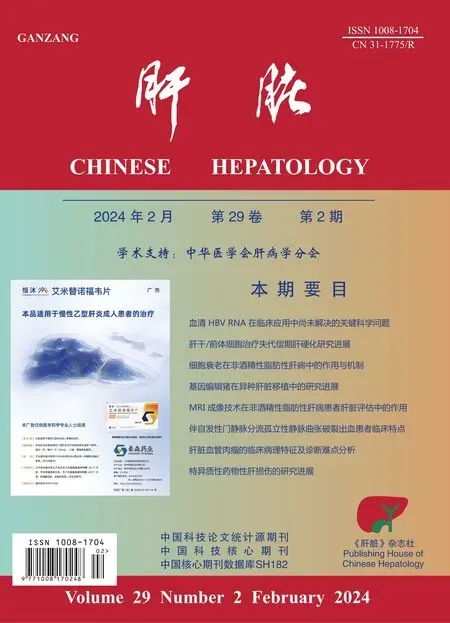
5例为高分化血管肉瘤,多结节型,低倍镜下可见病变区域肝板有不同程度的萎缩或消失,肝板周围肝窦内被覆异型肿瘤细胞,可形成血管腔结构,细胞呈短梭形、长梭形或卵圆形,胞质较少,核浆比显著增高,核呈多泡状,核仁不明显,呈新月形衬覆于肝窦内或鞋钉样突出至周围肝窦内,随着肿瘤细胞的浸润可见肝板断裂,形成粗钝的乳头状结构(图1-2)。
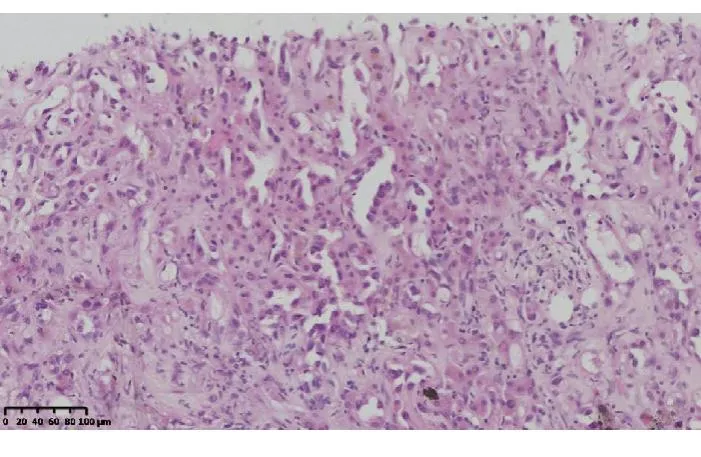
图1 肿瘤细胞突出至肝窦内,形成粗钝的乳头状结构(HE 染色,×200)
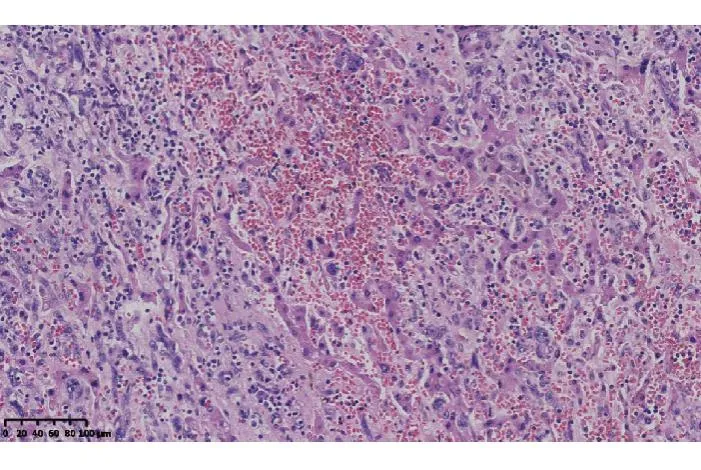
图2 异型肿瘤细胞衬覆于或突出至肝窦内,可见肝板断裂,伴出血(HE 染色,×200)
肝脏切除标本镜下为中-低分化血管肉瘤,巨块型,肿瘤与周围肝组织分界截然,肿瘤细胞形成血管腔或窦隙样结构,细胞异型性显著,细胞核呈梭形,核仁明显,细胞核呈空泡状,核分裂像多见(18个/10HPF)(图3),增殖指数高达70%,较高分化血管肉瘤明显增高,同时伴广泛出血及大片坏死。

图3 中-低分化血管肉瘤可见明显异型的肿瘤细胞(HE 染色,×400)
三、 免疫组化
高分化血管肉瘤免疫组化染色显示萎缩的肝细胞(图4),肝窦内衬覆的异型肿瘤细胞不表达肝细胞及上皮标记(AE1/AE3,CK8),血管内皮标记CD31(图5)、CD34(图6)、ERG(图7)、Fil-1(图8)染色阳性,其中,CD31和CD34为胞膜着色,ERG及Fil-1为细胞核染色。Ki-67染色阳性肿瘤细胞占10%~25%。中-低分化血管肉瘤同样表达血管内皮标记,且Ki-67高表达(70%)。
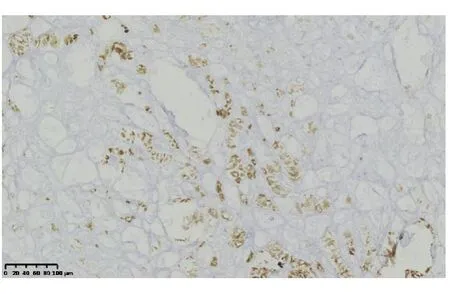
图4 HCC免疫组化染色显示萎缩的肝细胞(HE 染色,×200)

图5 肿瘤细胞CD34阳性(HE 染色,×200)
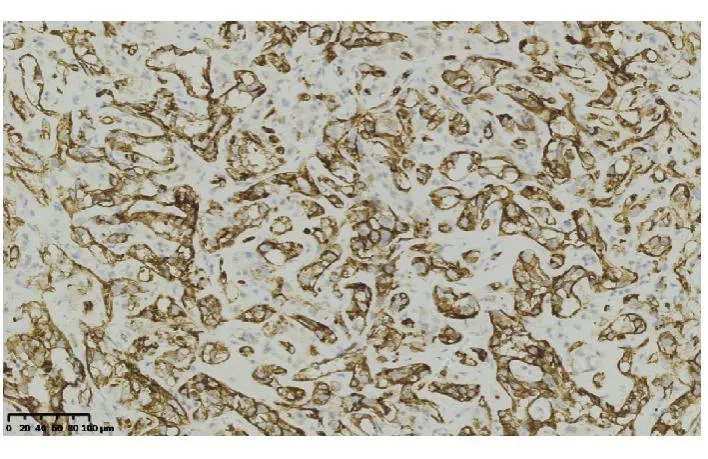
图6 肿瘤细胞CD31阳性(HE 染色,×200)
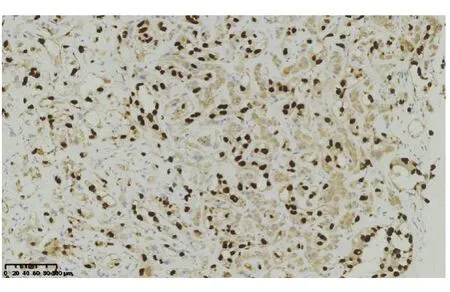
图7 肿瘤细胞ERG阳性(HE 染色,×200)
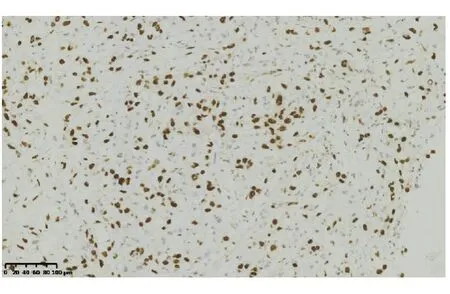
图8 肿瘤细胞Fil-1阳性(HE 染色,×200)
讨 论
HAS是一种少见的肝脏恶性肿瘤,其来源于肝窦血管内皮细胞,发病高峰在70岁左右,男性多发,病因不明,大约1/4的患者与氯乙烯、砷剂、氧化钍等致癌物接触史有关,但是大多数病例无明确致癌物接触史[1-4]。本组患者均无明确致癌物接触史,5例为体检时偶然发现,无明显临床不适,仅有1例患者因腹痛就诊。
1例患者肿瘤标志物CA125升高,2例患者转氨酶升高,其他患者均未见异常。影像学检查包括超声、CT等均无特异性,仅提示肝脏多发或单发占位,无法与肝细胞癌或其他肝脏富于血管病变相鉴别[5],影像学随访可见肿物增大,与文献报道一致[6]。
病理大体表现呈多发或单发结节,边界不清,肿瘤切面呈暗红色,蜂窝状,可伴出血及囊性变。分化好的肿瘤细胞沿肝板周围肝窦生长,呈乳头状或鞋钉样突出于肝窦表面,血管之间相互沟通融合呈迷宫样或血管样结构,内衬梭形、卵圆形或不规则形的肿瘤性细胞,瘤细胞体积大,核深染。同时伴有肝细胞萎缩,肝窦变宽。分化较差的肿瘤低倍镜下可见大小不一的肿瘤性血管,呈裂隙样血管腔样结构及实性结构,肿瘤细胞异型性明显,并形成多核瘤巨细胞,易见核分裂像及病理性核分裂像,肿瘤细胞间可见幼稚的血管腔形成,腔内可见红细胞,常见出血、坏死。部分肿瘤细胞可排列成海绵状血管腔样结构[5, 7, 8]。免疫组化染色血管内皮细胞标记CD31,CD34,Fli-1,ERG,FVIII阳性,有研究认为CD31是其最可靠的抗体[1]。ERG及Fli-1均为细胞核着色,其较少产生非特异性着色,特异度及敏感度均较高[3]。有研究发现,血管肉瘤出现ATRX的表达缺失,ALT阳性[9]。约有10%的病例广谱CK阳性[1],此时需要与低分化癌相鉴别,血管内皮标记阳性可资鉴别。
本病预后极差,中位生存时间仅为6个月,约有近一半患者发现时已有远处转移。临床治疗效果不佳,肿瘤局部切除+辅助化疗可以改善预后,中位生存时间为17个月[10]。本组病例3行多种治疗,包括放疗、射频消融、靶向治疗及生物免疫治疗,诊断后34个月死亡,生存时间最长。
该病起病较为隐匿,大多数患者无明显临床表现,主要有腹痛、发热、消瘦、腹部包块等,肿瘤标志物及肝功能大多在正常范围。影像学表现有一定帮助,但不具有特异性,且肿瘤分化不同,影像学表现谱系较广,难以区别高分化血管肉瘤及其他富于血管的肝肿瘤,对低分化血管肉瘤与其他肝脏实性肿瘤的鉴别也帮助不大[11]。肝脏内多发占位、肿物内出血及进行性增大对于血管肉瘤有一定提示作用[6]。由于肿瘤富于血管,少数患者行经皮肝穿刺活检后发生大出血,因此部分学者不主张行经皮肝穿刺活检[8]。本组病例中,仅有1例为单发结节,行肿物切除后诊断为血管肉瘤,其余均为肝脏多发结节,仅行经皮肝穿刺活检术,穿刺术后均未出现大出血。
病理是诊断的金标准。对于单发结节,可手术切除后诊断;而对于多发结节,临床无法手术切除,多行经皮穿刺活检,而穿刺活检肿瘤组织较少,且多取材于肿瘤边缘,易见肝板萎缩,肝窦扩张,肿瘤细胞沿肝窦排列,部分肝板断裂形成乳头样结构,肿瘤细胞与正常肝细胞交织在一起,诊断较为困难。且免疫组化染色仅可标记血管内皮,而无法判断其良恶性,需要结合形态,进一步判断,对于高分化血管肉瘤,形态学判断较为困难,免疫组化的作用显得比较局限,尽管有研究发现ATRX缺失对判断良恶性有一定帮助[9],但是其特异性及敏感性尚有待进一步研究。目前分子检测尚未发现血管肉瘤比较特异的基因改变,对诊断帮助较小。
综上所述,HAS临床表现、实验室检查及影像学检查不具有特异性,病理诊断亦有困难,综合患者的临床及影像学表现,加以细致的形态学观察,及免疫组化辅助,方可做出准确的病理诊断。
利益冲突声明:所有作者均声明不存在利益冲突。