三叶崖爬藤查耳酮异构酶基因克隆与外源诱导表达及酶活性分析
郦露群,龚一富*,宋奕珩,高孟雪,王何瑜
1.宁波大学海洋学院 浙江省海洋生物工程重点实验室,浙江 宁波 315832
2.宁波大学食品与药学学院,浙江 宁波 315832
三叶崖爬藤TetrastigmahemsleyanumDiels et Gilg 是被子植物门双子叶植物纲葡萄科崖爬藤属多年蔓生植物,作为中国特有的珍贵中草药,临床上主要用于抗癌,治疗血液及心脑血管疾病、肝炎、脑膜炎、肺炎、肠炎、咽炎等感染性疾病,以及儿童高热惊厥[1-2],在抗氧化、抗癌、抗炎等方面中也均得到证实[3-5]。三叶崖爬藤药物有效成分分析方面已经有大量的研究报道,主要包括黄酮类、酚酸类、磷脂、糖酯类和苯磺酸类等[6],黄酮类化合物是三叶崖爬藤的主要功效成分[7],现有研究表明,其可结合新型冠状病毒的2~3 个靶蛋白,从而发挥抗新冠病毒感染的作用[8]。
已有研究阐述黄酮类化合物的合成通路中的关键酶基因,查耳酮异构酶(chalcone isomerase,CHI)基因调控早期黄酮生物合成途径,并产生不同种类的类黄酮前体[9]。CHI基因作为黄酮合成过程中重要的限速酶,催化查耳酮异构化为黄烷酮柚皮素。CHI基因具有重要作用,可以控制花色苷的合成,增强植物抗逆性和抗氧化能力,增加药用植物中的黄酮及类黄酮化合物的积累等[10]。现已从苦荞麦Fagopyrumtataricum(L.) Gaertn.[11]、灰毡毛忍冬LoniceramacranthoidesHand.-Mazz.[12]、青蒿ArtemisiacaruifoliaBuch.-Ham.ex Roxb.[13]、红花CarthamustinctoriusL.[14]和丹参SalviamiltiorrhizaBunge.[15]等多种药用植物中克隆得到了CHI基因序列并对其功能进行剖析,但在三叶崖爬藤中CHI基因还未见有被克隆的研究报道,因此从三叶崖爬藤中克隆CHI基因并探究基因表达特性可为三叶崖爬藤黄酮生物合成机制提供分子基础。
外源诱导因素对次生代谢产物的形成具有重要作用,黄酮类合成途径的众多结构基因和调控基因均具有诱导表达特性,已有研究表明,吲哚-3-乙酸(3-indoleacetic acid,IAA)、茉莉酸甲酯(methyl jasmonate,MeJA)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)和酵母提取物(yeast extract,YE)均可诱导药用植物中次生代谢产物的生物合成。100 μg/mL 的IAA 可以促进甘草中甘草酸的积累[16]。100 μmol/L 的MeJA 处理可以诱导丹参中苯丙烷生物合成基因的表达,促进酚类化合物的积累[17]。ABA 可促进越南三七中三萜皂苷的积累[18]。100 μmol/L 的SA 可有效提高东北刺人参不定根中黄酮类和蒽醌类物质的含量[19]。100 mg/L 的YE可诱导夹竹桃科植物悬浮细胞总黄酮和总酚的积累[20]。外源化学诱导子均可诱导处理参与黄酮类生物合成途径的代谢和相关基因的表达,但在三叶崖爬藤中对于诱导子调控次生代谢产物合成的研究较少,主要针对各种培养条件下三叶崖爬藤生理生化和黄酮含量方面,对关键基因表达调控的研究较少。目前对于黄酮合成研究主要集中在相关酶基因的表达或相关酶活性的变化,缺乏对基因表达、酶活性和黄酮含量三者之间的研究。本研究从基因层面出发,重点探讨外源诱导子调控CHI基因表达、CHI酶活性及黄酮含量积累的机制。本研究从三叶崖爬藤中克隆CHI基因并进行生物信息学分析,测定三叶崖爬藤中各组织CHI基因表达量及黄酮含量,并分析各组织基因表达量与黄酮含量之间的相关性。探究IAA、MeJA、ABA、SA 和YE 对三叶崖爬藤CHI基因相对表达量和CHI 酶活性的动态变化及黄酮含量的影响,并对黄酮含量、CHI基因表达量和CHI 酶活性进行相关性分析。明确三叶崖爬藤黄酮合成相关酶基因CHI在不同组织和不同诱导处理下的表达模式,以期进一步探究三叶崖爬藤中CHI基因功能及外源诱导子提高三叶崖爬藤内源性黄酮含量的机制。
1 材料与仪器
1.1 材料
三叶崖爬藤由宁波大学海洋学院海洋生物工程重点实验室提供,由宁波大学海洋学院龚一富副教授鉴定为三叶崖爬藤T.hemsleyanumDiels et Gilg。部分样品烘干用于黄酮含量测定,部分样品液氮速冻后保存于−80 ℃低温条件下,用于RNA 提取。
芦丁对照品(批号1103M028,质量分数≥98%)、IAA(批号610M021)、MeJA(批号3230306002)、ABA(批号814C0223)、SA(批号515A031)和YE(批号505U051)购于北京索莱宝科技有限公司;甲醇、乙醇、亚硝酸钠、三氯化铝和氢氧化钠购于国药集团化学试剂有限公司;克隆载体pMD-19T、大肠杆菌感受态细胞DH5α 购于宝日医生物技术(北京)有限公司;2×Taq MasterMix 购于江苏康为世纪生物科技股份有限公司,植物总RNA 提取试剂盒、DNA 凝胶回收试剂盒购于美国Omega Bio-Tek 公司;反转录试剂盒、SYBR qPCR Master Mix 购于南京诺唯赞生物科技股份有限公司;CHI 试剂盒购于苏州科铭生物技术有限公司。
1.2 仪器
光照培养箱(宁波莱福科技有限公司);PCR 扩增仪(eppendorf 公司,德国);实时荧光定量PCR仪(eppendorf 公司,德国);NanoDrop 2000 核酸/蛋白定量仪(Thermo 公司,美国);高速冷冻离心机(eppendorf 公司,德国)。
2 方法
2.1 三叶崖爬藤的处理与采集
选择生长状况良好且相似的三叶崖爬藤植株,每组每株叶片喷施5 mL 蒸馏水、IAA、MeJA、ABA、SA 和YE,2 周后取样,55 ℃烘干,用于测定黄酮含量变化。另外在同等培养和处理条件下,采集处理后0、6、12、24、48、72、96 h 外源诱导条件下的三叶崖爬藤叶片组织用于基因表达量及酶活性的测定。所有样品采集均遵循3 个生物学重复原则并在采集后立即液氮速冻储存在−80 ℃低温条件下,用于进一步的实验分析。
2.2 三叶崖爬藤转录组测序及CHI 基因序列的获得
提取三叶崖爬藤叶片总RNA,测定RNA 浓度,并对提取的总RNA 进行电泳检测评估。通过RTPCR,反转录为cDNA,并对文库进行构建、纯化、检测、定量,送至安升达生物科技有限公司进行Illumina HiSeqTM2000 高通量测序。通过数据分析获得三叶崖爬藤CHI基因的cDNA 全长序列,利用Primer 5.0 设计了一对CHI基因开放阅读框(open reading frame,ORF)扩增引物:F:5’-TTCTCCTTTATCTGCATCAG-3’;R:5’-GCACAAGGGTTTTATTCCAT-3’。引物委托生工生物工程(上海)股份有限公司合成,PCR 后电泳检测、回收,通过测序证实插入片段。
2.3 三叶崖爬藤CHI 蛋白的生物信息学分析
在DNAMAN 9.0 软件上分析三叶崖爬藤CHI基因cDNA 全长序列,通过ExPASy Protparam 预测蛋白质基本理化性质,包括氨基酸数目、相对分子质量、PI 值、分子式和不稳定系数等。WOLF PSORT进行蛋白质亚细胞定位的预测。ExPASy ProtScale预测蛋白亲水性和疏水性。TMHMM 2.0 分析蛋白质跨膜结构。SignalP 4.1 Server 进行信号肽预测。SMART 和NCBI 中的CD search 分析蛋白质结构域。SOPMA 对CHI 蛋白的二级结构进行预测。SWISS-MODEL 和Phyre2 预测CHI 蛋白三级结构。通过NCBI 基因数据库,下载绿豆、甘草、苜蓿和黄芪等15 个物种的CHI 氨基酸序列并利用MEGA 11 以邻接法(neighbour joining,NJ),设置Bootstrap值(自展值)为1 000,其他参数默认,进行序列比对并构建系统进化树。
2.4 三叶崖爬藤黄酮含量测定
黄酮含量测定参考朱良辉等[21]的方法,以芦丁对照品的浓度(Y)为横坐标,吸光度值(X)为纵坐标,绘制线性方程Y=9.340 7X-0.004 5,R2=0.998 8,线性范围为0.008~0.048 mg/mL,用于计算三叶崖爬藤黄酮含量。本研究所建立的黄酮含量测定方法能满足方法学考察要求。
2.5 三叶崖爬藤CHI 基因组织及诱导表达测定
分别提取三叶崖爬藤根、茎、块茎、老叶和幼叶组织总RNA。利用IAA、MeJA、ABA、SA 和YE诱导处理三叶崖爬藤,分别提取经诱导处理0、6、12、24、48、72、96 h 后的三叶崖爬藤叶片RNA,测定三叶崖爬藤中各组织及各诱导处理的RNA 浓度,并对提取的总RNA 进行电泳检测评估,反转录为cDNA,并于−20 ℃保存备用。设计qRT-PCR 引物F-5’-GCCAACCACCTCTTCCTCAG-3’和R-5’-TCAACAGTCTTGCCCTTCCA-3’。以GAPDH基因作为内参基因,设计引物序列为F-5’CCATTACTGCTACCCAAAAAACT-3’和 R-5’-GTGAGGTCAACCACCGACACATC-3’。根据上述基因的引物序列进行RT-qPCR 扩增,对三叶崖爬藤CHI基因进行各组织及各诱导处理的表达量分析,各组织基因表达量以块茎中的表达量为参照。qRT-PCR 反应体系为:灭菌水8.2 μL,SYBR qPCR Master Mix10 μL,正反引物各0.4 μL,cDNA 模板1.0 μL,共20 μL 的反应体系。qRT-PCR 反应程序为:95 ℃预变性30 s,95 ℃变性10 s,55 ℃退火30 s,熔解曲线按仪器默认,反应40 个循环。采用2−ΔΔCt法分析基因表达水平。
2.6 诱导条件下三叶崖爬藤CHI 酶活性测定
CHI 酶活性测定使用查耳酮异构酶试剂盒,称取三叶崖爬藤诱导处理后的叶片0.1 g 和提取液1 mL 于离心管中,至于冰上,进行冰浴匀浆,4 ℃离心取上清,置冰上待测。用蒸馏水调零,在1 mL 玻璃比色皿中加入50 μL 上清液和950 μL缓冲液,立即混匀并在381 nm 下测定初始吸光度(A)值,记为A1,37 ℃保温30 min 后测定A值,记为A2,计算ΔA(ΔA=A2-A1)。按公式计算CHI活性。
CHI 活性=400×ΔA/样本质量
2.7 数据分析
试验所得数据采用Excel 2016、SPSS 26.0 和Graph Pad Prism 9 等软件进行处理。
3 结果与分析
3.1 三叶崖爬藤CHI 基因克隆和序列分析
经转录组测序分析获得三叶崖爬藤CHI基因cDNA 全长序列1 096 bp,经ORF-Finder 分析,含有一个长为714 bp 的开放阅读框,编码237 个氨基酸(图1)。对三叶崖爬藤CHI 蛋白进行预测,该蛋白分子式为C1148H1819N285O348S5,PI 值为5.28,偏酸性,相对分子质量为25 340,其中谷氨酸(Glu)和丝氨酸(Ser)占比最高,达10.1%,色氨酸(Trp)和组氨酸(His)占比最低,只占0.8%。该蛋白不存在信号肽,为非分泌型蛋白,编码的氨基酸全都在膜外,不具有跨膜结构。ProtScale 预测该蛋白为疏水性蛋白,且总平均疏水指数(GRAVY)为0.070。亚细胞定位预测三叶崖爬藤CHI蛋白主要分布在在叶绿体中,其次分布于细胞质中,蛋白不稳定系数为37.61,属于稳定蛋白。结构域预测结果表明,三叶崖爬藤CHI 蛋白属于Chalcone-3 超基因家族,包含一个Chalcone 结构域(4~233),编码查耳酮黄烷酮异构酶。二级结构预测结果表明,4 种二级结构在整个氨基酸序列中均有分布,该蛋白中α-螺旋(alpha helix)占比最高,占46.41%,无规则卷曲(random coil)占29.11%,延伸链(extended strand)占16.03%,β-折叠(beta turn)占8.44%。α-螺旋为三叶崖爬藤CHI 蛋白二级结构的主要结构组成元件,占比最高,其次是延伸链。利用Phyre2和SWISSMODEL 在线预测三叶崖爬藤CHI 编码蛋白三级结构空间结构(图2)。在蛋白三级结构中,三叶崖爬藤CHI 蛋白呈明显的倒置三明治状折叠结构,是该类蛋白的特征之一,明显可见三级结构中存在大量的α-螺旋和无规则卷曲,与二级结构预测结果一致。
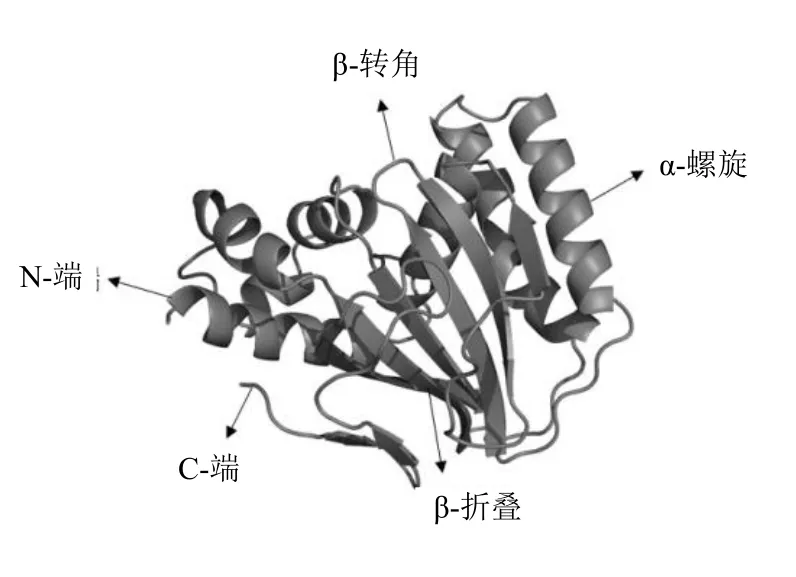
图2 三叶崖爬藤CHI 蛋白的三维空间结构Fig.2 Three-dimensional spatial structure of T.hemsleyanum CHI protein
3.2 三叶崖爬藤CHI 蛋白序列比对和系统进化树分析
为进一步研究三叶崖爬藤CHI氨基酸序列与其他物种之间的进化关系,利用MEGA11 中的NJ 法构建系统进化树(图3)。进化树总体分为2 个分支,单子叶植物和双子叶植物分支。美人蕉、玉米、日本晴水稻和小麦聚为单子叶植物分支,绿豆、甘草、苜蓿、黄芪、花生、大豆和欧洲葡萄等聚为双子叶植物分支,双子叶植物分支可进一步细分为豆科和葡萄科两小支,三叶崖爬藤CHI 蛋白与其他葡萄科植物CHI 蛋白具有高度的相似性,与欧洲葡萄VitisviniferaL.和山葡萄VitisamurensisRupr.在系统进化树上聚为葡萄科小支,同源性最高,说明该基因具有较高的科间同源性。
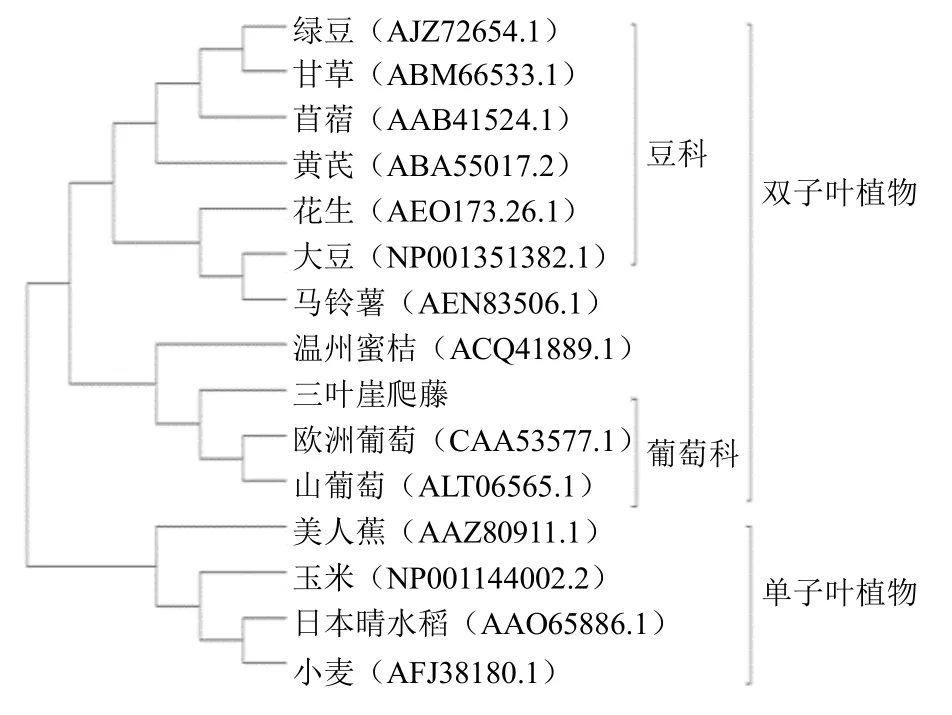
图3 三叶崖爬藤CHI 蛋白与其他植物CHI 蛋白系统进化树Fig.3 Phylogenetic tree of T.hemsleyanum CHI proteins and other plant species
3.3 三叶崖爬藤CHI 基因组织表达分析
利用qRT-PCR 测定三叶崖爬藤CHI基因在不同组织下的表达模式,结果表明(图4),CHI基因在三叶崖爬藤各组织中均得到表达,但基因表达量存在差异。以三叶崖爬藤块茎中的CHI基因表达量为参照,表达量从高到低为根>幼叶>茎>老叶>块茎,CHI基因在根中的表达量显著高于其他组织,是幼叶、茎、老叶和块茎的1.52、2.44、2.61、4.78倍。黄酮含量测定结果表明,三叶崖爬藤各组织黄酮含量从高到低为茎>根>块茎>幼叶>老叶(图4)。CHI基因在三叶崖爬藤根、幼叶、老叶中表达量与总黄酮量变化趋势一致,茎和块茎中基因表达量与总黄酮含量趋势不一致,对2 组数据进行相关性分析,结果表明,各组织中基因表达量与总黄酮含量趋势无显著相关性。
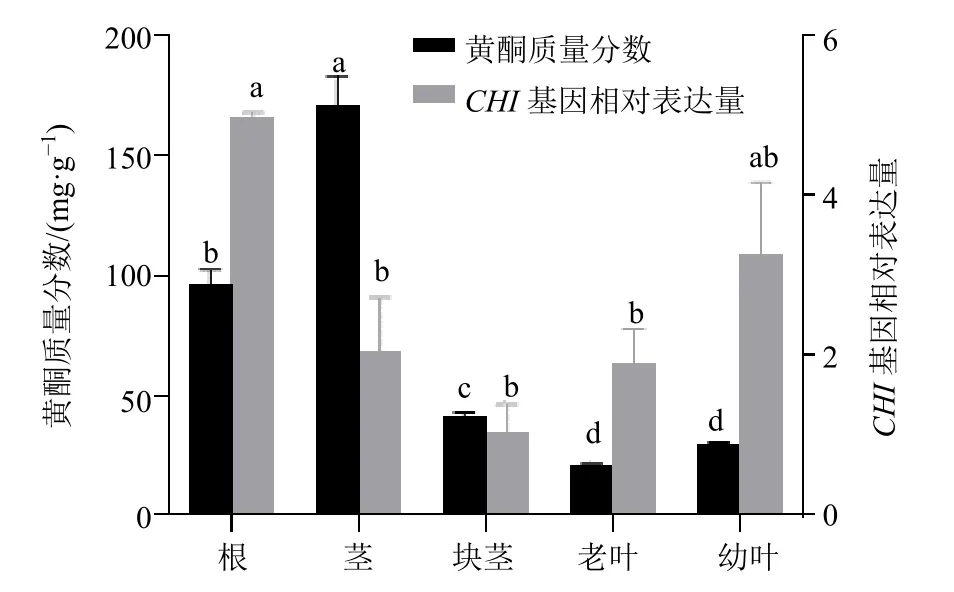
图4 三叶崖爬藤在各组织中的黄酮含量和CHI 基因表达量Fig.4 Flavonoid content and CHI gene expression of T.hemsleyanum in various tissues
3.4 三叶崖爬藤CHI 基因诱导表达调控分析
利用IAA、MeJA、ABA、SA 和YE 诱导处理三叶崖爬藤叶片,利用RT-qPCR 对不同处理时间后CHI基因表达量进行检测,结果表明,5 种外源诱导物质对三叶崖爬藤CHI基因表达量均起到不同程度的诱导作用。IAA 处理后,三叶崖爬藤CHI基因在96 h 相对表达量达到峰值,基因表达量为对照组的7.36 倍(图5-A)。MeJA 处理后,三叶崖爬藤CHI基因表达量随着处理时间的增加,基因表达量呈逐渐上升的变化趋势,48 h 后基因表达量开始显著高于对照组,96 h 基因表达量达到最高,为对照组的11.61 倍,说明MeJA 对CHI基因诱导表达效果显著且相对较快(图5-B)。ABA 处理后,CHI基因表达量呈现先稳定后迅速提高的趋势,在72 h 和96 h 显著提高了三叶崖爬藤CHI基因表达量,在处理后72 h 达到最高,为对照组的5.04 倍(图5-C)。SA、YE 处理后,三叶崖爬藤CHI基因表达量也呈现先稳定后迅速提高的趋势,均在96 h 显著提高了三叶崖爬藤CHI基因表达量,相比对照组分别提高了8.62 倍和5.71 倍(图5-D、5-E)。结果表明,5 种外源物质对三叶崖爬藤CHI基因表达有重要的诱导提高作用。
为进一步探究5 种外源诱导处理下三叶崖爬藤黄酮含量积累情况,对各诱导处理下的三叶崖爬藤黄酮含量进行测定。结果表明,ABA 处理对黄酮积累效果最为明显,相比对照组提高了1.97 倍,其次是YE 和SA,相比对照组提高了1.74 倍和1.57 倍,最后是MeJA 和IAA 比对照组提高了1.42 倍和1.31倍(图5-F)。利用不同诱导物质处理后,对三叶崖爬藤黄酮含量的影响虽具有一定差异性,但较对照组黄酮含量均显著提高。结果表明,5 种外源物质均促进三叶崖爬藤黄酮含量积累。
3.5 不同诱导处理对CHI 酶活性的影响分析
为进一步探究5 种外源诱导物质在翻译水平上对黄酮含量积累的作用,对各诱导处理下三叶崖爬藤CHI 酶活性进行测定,结果表明,IAA、MeJA、ABA、SA 和YE 处理下CHI 酶活性与对照组相比显著提高(图6)。IAA 处理后,0~48 h CHI 酶活性无显著差异,处理后72 h,CHI 酶活性才显著提高,96 h 达到最高,相比对照组提高了3.23 倍(图6-A)。MeJA 处理后,0~72 h 酶活性基本持平,只在处理后96 h 显著提高,相比对照组提高了1.76 倍(图6-B)。ABA 处理后,0~48 h CHI 酶活性基本无变化,72 h 后CHI 酶活性才显著提高,96 h 达到最高,相比对照组提高2.41 倍(图6-C)。SA 和YE在处理后0~24 h 酶活性都无显著差异,48 h 开始显著提高,在96 h 后酶活性进一步提高,相比对照组分别提高了2.39 倍和2.95 倍(图6-D、6-E)。该5 种诱导物质对CHI 酶活性均有不同程度的促进作用,结合黄酮含量积累结果,进一步说明外源物质诱导提高了CHI 酶的活性,加速了次生代谢产物黄酮的合成。
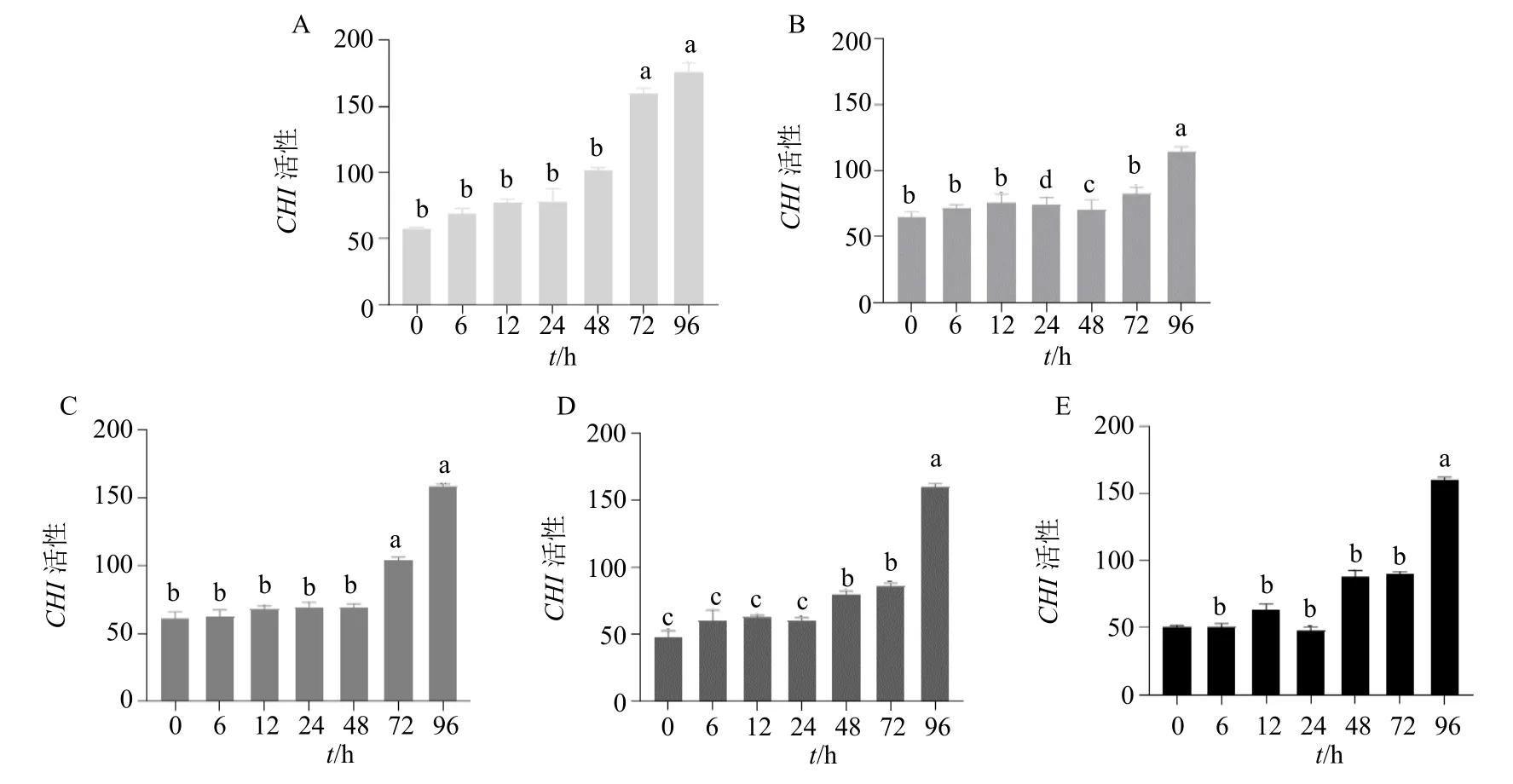
图6 5 种外源因素 [IAA (A)、MeJA (B)、ABA (C)、SA(D)、YE(E)] 对三叶崖爬藤CHI 酶活性的影响Fig.6 Effect of five exogenous factors [IAA (A), MeJA (B), ABA (C), SA(D), YE(E)] on CHI enzyme activity of T.hemsleyanum
3.6 三叶崖爬藤黄酮含量、CHI 基因表达量和CHI酶活性的相关性
利用SPSS 26.0 进行一元线性回归分析,结果表明,5 种外源诱导处理虽然在黄酮合成途径中对黄酮的积累及CHI基因的表达有显著促进作用,但在各诱导处理下,黄酮含量与CHI基因表达量之间未表现出明显的相关性,黄酮含量与CHI 酶活性的相关系数要高于CHI基因表达(R2=0.453,P<0.01),说明黄酮含量与CHI 酶活性存在中等相关,在各诱导处理下,CHI 酶活性变化显著影响黄酮含量。
4 讨论
药用植物三叶崖爬藤用途广泛,市场需求量大,其中含有的黄酮类化合物具有抗癌、抗炎等多种不同的药理作用,提高三叶崖爬藤内源性黄酮含量尤为重要。CHI是黄酮合成途径的关键基因之一,具有重要的作用,它调控早期黄酮类合成途径,提高CHI 酶活性,可以提高植物中黄酮类、花色素等有效成分的含量[22]。本研究基于前期三叶崖爬藤转录组数据,结果表明,三叶崖爬藤CHI基因全长1 096 bp,含有一个长为714 bp 的开放阅读框,编码的237 个氨基酸,通过测定三叶崖爬藤根、茎、块茎、老叶、幼叶的黄酮含量及黄酮合成途径关键酶基因CHI的表达量,探究黄酮含量和CHI基因表达差异及其关系。CHI基因在三叶崖爬藤各组织中均有表达,以三叶崖爬藤块茎中CHI基因表达量为参照,表达量从高到低为根>幼叶>茎>老叶>块茎,说明CHI基因在不同部位的时空表达特性不同,各组织总黄酮含量从高到低为茎>根>块茎>幼叶>老叶,不同部位总黄酮含量存在着明显差异,这与前人的实验结果相符[23],同时也证明三叶崖爬藤全草均可入药一说。三叶崖爬藤各组织中CHI基因表达与黄酮含量并无显著相关性,说明黄酮含量与三叶崖爬藤CHI基因的表达具有差异性,推测自然状态下三叶崖爬藤黄酮含量积累不完全只受到CHI基因表达量的影响,还受到黄酮类合成途径中其他重要的限速酶影响,说明黄酮类生物合成途径是复杂多变的,其分子机制有待进一步研究。另外,各类非生物胁迫因素也是黄酮生物合成和积累的调节剂,如植物激素尤其是生长素或其他外源诱导物质可以调控黄酮类化合物合成途径和有效成分的积累[24-26]。
本研究利用IAA、MeJA、ABA、SA 和YE 诱导处理三叶崖爬藤,结果表明,CHI基因表达量和黄酮含量均表现出不同程度的上调,其他物种的CHI基因也受到本实验中5 种外源诱导物质的诱导表达,IAA 诱导草莓FragariaananassaDuch.CHI的表达,从而使总黄酮、总酚、花色苷的含量得到积累[27]。外源添加MeJA 不仅增强了黄芩Scutellaria baicalensisCHI基因表达,而且使黄岑产生更多的黄芩苷、黄芩素等黄酮化合物[28],植物激素ABA、SA 诱导愈伤组织中白香木AquilariasinensisCHI基因表达,从而积累了内源黄酮类化合物[29]。YE 可以诱导甘草GlycyrrhizauralensisFisch.毛状根中CHI基因表达,使CHI的转录水平和CHI 酶活性显著提高,从而积累甘草毛状根中的黄酮含量[30]。研究成果表明,CHI基因表达量、CHI 酶活性、黄酮含量受到本实验5 种外源物质不同程度的诱导,说明外源诱导物质对三叶崖爬藤CHI基因响应和黄酮代谢具有重要作用。究其原因,一方面,这些外源诱导物质作为信号转导分子诱导三叶崖爬藤CHI基因转录水平的上调,另一方面,在翻译水平上,三叶崖爬藤CHI 酶活性水平得以提高,从而产生并积累大量的次生代谢产物。
不同诱导物质下三叶崖爬藤黄酮含量和CHI基因表达量的相关性分析发现,5 种诱导处理下,黄酮含量与CHI基因表达量并无显著相关性,在枸杞中,CHI基因表达量与类黄酮含量无显著相关关系,而CHI 酶活性与类黄酮含量达到显著相关关系[31],这与本实验结果相符。说明黄酮合成途径错综复杂,CHI基因作为黄酮合成途径上游基因,对最终代谢产物的积累不起决定性作用,也可能还受到其他转录调控因子的影响,其机制有待进一步研究。
不同诱导物质下三叶崖爬藤黄酮含量和CHI酶活性的相关性分析发现,黄酮含量与CHI 酶活性存在显著正相关。在烟草中CHI 酶活性与黄酮含量呈显著正相关关系[32],这与本实验结果相符。说明5种外源处理可以强烈激活CHI 酶的活性,促使产物黄酮生成与积累,并且随着处理时间的延长,其活性整体呈逐渐上升的趋势,CHI 作为关键酶参与到了黄酮合成途径中。外源物质的诱导、关键酶基因的表达、生物合成关键酶活性的变化以及次生代谢产物的产生与积累之间存在相互交织的关系。因此,通过外源诱导物质提高关键酶基因的表达及酶活性的提高是药用有效成分积累的方法之一。外源诱导物质可能通过多方面影响黄酮合成通路关键基因,因此可通过转录组测序分析对各关键基因调控黄酮合成的机制进行更进一步的研究。
利益冲突所有作者均声明不存在利益冲突

