汞、 砷、 镉在秦皇岛近海几种典型底栖生物体内的富集特征
张玉龙, 尹晓斐, 屈佩, 王鹏功, 宋伟, 徐金涛, 宫于琛,鲁世尧, 王宗灵, 张学雷, 庞敏
(1. 自然资源部海洋生态环境科学与技术重点实验室, 自然资源部第一海洋研究所, 山东 青岛 266061; 2. 崂山实验室, 海洋生态与环境科学功能实验室, 山东 青岛 266237; 3. 中国检验认证集团山东检测有限公司, 山东 青岛 266300; 4. 国家海洋局秦皇岛海洋环境监测中心站, 河北 秦皇岛 066000; 5. 山东省海洋工程咨询协会, 山东 济南 250013)
0 引言
近年来, 秦皇岛工农业发展迅速, 大量工农业废水、 生活污水通过陆源排污、 地面径流等方式进入秦皇岛沿岸海域[1-2], 加之国内煤炭输出第一大港秦皇岛港船舶运输活动频繁, 使该海域重金属污染加剧[3]. 汞(Hg)、 砷(As)、 镉(Cd)[3]是生物生长的非必需元素, 长期接触会对生物产生一定的毒性, 增加各类心血管和神经疾病的患病风险, 甚至致畸致癌[4]. Hg、 As、 Cd在秦皇岛近岸沉积物和港口海洋生物中均有检出, 虽然浓度较低, 但经由海洋生物的富集和食物链的传递, 可能在高营养级海洋生物体内累积较高浓度, 因此其生态毒性效应不可忽视.
为监测此类重金属污染物在海洋环境中的变化, 常选用对污染物具有更强耐受性和富集作用的底栖软体动物作为生物指示物种[5]. 秦皇岛海区广泛分布有太平洋牡蛎(Ostreagigas)、 紫贻贝(Mytilusedulis)和脉红螺(Rapanavenosa). 其中, 紫贻贝、 牡蛎等双壳类被誉为“哨兵生物”[6], 主要滤食浮游植物, 在食物链中处于较低位置, 可以用来监测重金属进入食物链的初始浓度; 而杂食性的脉红螺, 通常营养级位置较高, 易于从沉积物中富集各类污染物, 也是监测环境污染物的良好生物材料.
然而, 底栖动物体内重金属的质量分数与其生长特性及其对外部环境中重金属的生物利用度有关, 生长速率和繁殖周期会对生物体内重金属浓度产生稀释或浓缩效应, 从而影响监测的准确性[6]. 有研究将生物体内污染物的质量分数或净积累能力作为依据, 为不同污染物选择监测生物[7]. 本研究通过潜水采集秦皇岛近海的紫贻贝、 太平洋牡蛎、 脉红螺, 将其作为主要研究对象, 对其体内富集Hg、 As、 Cd的质量分数进行分析, 探讨这几种元素的生物富集因子(bioconcentration factor, BCF), 并进一步解析其与3种底栖生物的体长、 体重等常规生长指标的相关性. 同时, 测定各生物的氮稳定同位素比率值(δ15N), 以此指示生物体的营养等级, 与体长、 体重指标相结合, 以更准确地反映生物体的生长特征, 探究不同元素在不同底栖生物体内的富集差异, 达到阐明各重金属元素在秦皇岛近海典型底栖生物中的富集特征的研究目的, 从而为秦皇岛海域的重金属污染监测工作中环境监测生物的筛选提供参考数据.
1 材料与方法
1.1 研究区域和样品采集
在秦皇岛港口附近海域设置采样站点C1(39° 53.677′ N, 119°37.877′ E), 于2020年5月至2020年12月每月通过潜水进行一次生物样品采集, 采集物种主要为紫贻贝、 太平洋牡蛎和脉红螺. 将获取的生物样品分组放置于洁净的聚乙烯袋中, 并标明采集日期和品种. 沉积物采集搭载合作单位的监测航次, 共获得2020年6月、 9月和11月3个航次的样品. 沉积物样品使用采泥器采集后, 用塑料勺在0~3 cm层混合取样500~600 g, 放入洁净聚乙烯袋中, 密封备用. 生物样本和沉积物样本冷冻保存, 直至进行实验分析.
1.2 生物指标分析方法
生物指标主要包括几种底栖生物的体长和总湿质量(wet weight). 将贝类样品表面附着物用塑料刀清理干净, 用卡尺测量紫贻贝、 脉红螺外壳纵向长度, 记为体长(l), 单位为mm. 对每个紫贻贝、 脉红螺进行称量, 记为湿质量(m), 单位为g. 因太平洋牡蛎难以从岩石上完整取下, 因此其体长采用壳内表面纵向长度表示, 湿质量采用软组织湿质量表示. 打开贝壳后, 用蒸馏水清洗软组织并用塑料刀和镊子将其取出. 将软组织在80 ℃下干燥48 h, 研磨成粉末样后用铝箔包装保存, 直至稳定同位素分析时取出.
准确称取粉末样品约0.5 mg, 用4 mm×6 mm锡杯包样, 用元素分析仪-稳定同位素质谱仪联机(Flash EA 1112 HT-Delta V Advantages, 德国赛默飞世尔科技公司)测定样品中氮稳定同位素比率(δ15N). 氮指标为有机氮百分比和以大气氮作为参考标准的氮同位素比率, 其计算公式为

(1)
式中:Rsample为样品的实际氮同位素丰度比值, 即稳定同位素15N与14N原子数量的比值;Rair为对应标准大气氮同位素丰度比值.
1.3 化学指标分析方法
1.3.1 贝类软组织Hg、 As、 Cd质量分数分析方法
称取0.5 g软组织干样, 将其置于微波消解内罐中, 加入5 mL硝酸, 加盖放置30~60 min, 旋紧罐盖后置于微波消解仪中进行消解. 预处理后, 在同条件下将空白试剂、 样品待测液分别引入电感耦合等离子体质谱仪(iCAP Qnova Series, 德国赛默飞世尔科技公司), 采用电感耦合等离子体质谱法(inductively coupled plasma-mass spectrometry, ICP-MS)测定贝类软组织中Hg、 As和Cd这 3种重金属的质量分数[8-9].
1.3.2 沉积物Hg、 As、 Cd质量分数分析方法
将沉积物湿样于60 ℃烘箱内烘干后剔除杂质, 用玛瑙研钵将其分批研磨并过孔径96 μm尼龙筛, 待该站点沉积物样品全部研磨过筛后, 充分混匀取样备用. 取0.1~0.5 g沉积物干样于50 mL具塞比色管中, 加入2 mL硝酸、 6 mL盐酸. 预处理后, 用原子荧光光度计(AFS-930, 北京吉天仪器有限公司)测定空白液和样品消化液的荧光强度, 计算出Hg的质量分数. 另取0.1 g沉积物干样于微波消解罐中, 加少许水润湿, 加入6 mL硝酸、 3 mL盐酸和2 mL氢氟酸, 待反应平稳后, 旋紧瓶盖, 放入微波消解仪进行消解. 预处理后, 将空白试剂、 样品待测液分别引入电感耦合等离子体质谱仪中测定, 根据标准曲线线性回归方程计算出沉积物中Cd和As的质量分数[10-11]. Hg、 As和Cd含量以质量分数表示.
1.4 数据处理方法
1.4.1生物富集因子
生物富集因子(f)是生物体内污染物的平衡浓度与其生存环境中该污染物浓度比值, 用于表征生物对某污染物的积累能力. 6、 9、 11月份3种底栖生物对3种重金属的生物富集因子的计算公式为
f=w/w0
(2)
式中:w是底栖生物体内Hg、 As、 Cd的质量分数;w0是沉积物中Hg、 As、 Cd的质量分数.
1.4.2统计分析
通过SPSS软件进行统计分析, 包括线性回归、 相关性分析、 单因素方差分析和多元比较, 差异显著性采用ANOVA分析方法, 当P<0.05时, 被认为差异具有统计学意义.
2 实验结果与讨论
2.1 底栖生物的Hg、 As、 Cd质量分数和生长指标
2020年5月至2020年12月紫贻贝、 太平洋牡蛎和脉红螺软组织内3种重金属的质量分数如图1所示.

图1 不同底栖生物软组织内Hg、 As和Cd的质量分数Fig.1 Mass fraction of Hg, As and Cd in different macroinvertebrates
Hg、 As在脉红螺软组织中的质量分数要高于其他两种底栖生物(P<0.01), Cd在5~10月份在太平洋牡蛎软组织中的质量分数最高. Hg在紫贻贝和脉红螺体内的质量分数变化基本一致, 在6~7月出现峰值, 在8月出现最低值, 然后在9月质量分数回升后又在10月份下跌. As在紫贻贝和脉红螺体内的质量分数变化基本一致, 在6~7月和9月产生峰值. 紫贻贝体内Cd的月际变化幅度较小, 脉红螺体内Cd的质量分数较低, 在11和12月有较高值. 污染物质量分数峰值主要出现在6~9月份, 可能是受到降雨和生物活动的影响[12]. 随着天气转暖, 降雨量增大, 大量污染物随沿岸径流输入海湾, 导致秦皇岛港口附近在夏季重金属的质量分数较高, 而春夏季底栖生物活动性较强, 对污染物的吸收效率更高. 此外, 季节变化会对水体理化因素(如水温、 pH值、 盐度等)、 食物供给和性腺肥满度[13]等方面产生影响, 从而影响底栖生物对重金属的富集.
根据《食品安全国家标准 食品中污染物限量》[14]中对水产品污染物的限量要求, 在除鱼以外的水产动物体内, 甲基汞和无机砷的限量标准为0.5 mg·kg-1, Cd的限量标准为2.0 mg·kg-1. As在海洋生物体内主要以无毒的有机砷形式存在, 通常认为在海产品中毒性较强的无机砷的质量分数在总As质量分数的1%~5%范围内, 一般情况下采用总量的3%估算无机砷的质量浓度[15]. 紫贻贝、 太平洋牡蛎和脉红螺3种生物软组织内Hg的质量分数分别为0.079、 0.064和0.180 mg·kg-1, 无机砷的质量分数分别为0.035、 0.057和0.126 mg·kg-1, 均未超过国家限量标准; 紫贻贝和脉红螺两种底栖生物中的Cd质量分数分别为1.107和1.100 mg·kg-1, 平均水平上也没有超过限量标准; 太平洋牡蛎软组织中Cd的平均质量分数为2.331 mg·kg-1,超过限量标准(如表1所示), 具体为2020年7、 8和10月太平洋牡蛎样品中Cd的平均质量分数超标, 其他样品均未出现超标.

表1 不同底栖生物的生长指标和Hg 、 As、 Cd的质量分数
为考察生长对这3种有毒元素富集的影响, 对3种底栖生物的生长指标(体长、 湿质量、δ15N)进行分析, 结果如表1所示. 由于新陈代谢的同化作用和氨基酸分馏, 生物体的δ15N随着营养转移呈现显著且稳定的富集效应(富集因子稳定在3‰~5‰), 因此常被用来反映生物种的营养层次[16]. 脉红螺的δ15N(8.33‰~10.05‰)高于紫贻贝(5.56‰~8.45‰)和太平洋牡蛎(6.15‰~8.41‰), 说明脉红螺在食物网中处于较高营养级, 这跟脉红螺杂食性的摄食偏好有关[17].
2.2 底栖动物对Hg、 As、 Cd的富集差异
富集因子(BCF)是描述污染物在生物体内累积趋势的重要指标. 为比较紫贻贝、 太平洋牡蛎和脉红螺对3种重金属的富集能力, 通过对比2020年6、 9和11月份采样地点沉积物中Hg、 As、 Cd的质量分数, 比较紫贻贝、 太平洋牡蛎和脉红螺在这3个月份对3种重金属的生物富集因子(f), 如图2所示. 由图分析可知, 脉红螺对Hg和As有更强的富集能力, 而紫贻贝和太平洋牡蛎比脉红螺对Cd的富集更加稳定, 其中太平洋牡蛎对Cd的富集比紫贻贝更加敏感.
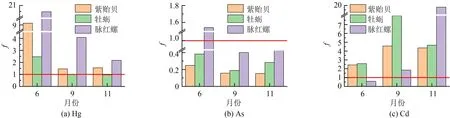
图2 2020年 6、 9和11月份3种底栖生物对Hg、 As和Cd的生物富集因子Fig.2 BCF of Hg, As and Cd in three macroinvertebrates in June, September and November 2020
软体动物不同的生活习性、 生理结构, 导致其对重金属的富集能力存在较大种间差异[6]. 脉红螺处于较高营养级, 体内Hg和As的质量分数明显高于其他两种底栖生物(如图1所示,P<0.01), 说明脉红螺对Hg和As的富集能力较强, 且污染物在食物链上有逐级放大的特点. 牡蛎通常附着于水流变动较大的河流入海口区的岩石底部, 率先接触陆源污染物, 暴污时间较长[18]. 且相较于紫贻贝, 牡蛎个头较大, 具有更高的滤水能力, 这可能是牡蛎拥有较高Cd积累量的原因[18]. 室内模拟暴露实验表明, As的质量浓度为10 μg·L-1时, 紫贻贝对As的富集量很少[7]. 本实验数据显示, 秦皇岛港口自然海区沉积物中As的质量浓度在4~10 μg·L-1. 因此, 紫贻贝对As的富集能力可能受到秦皇岛环境中As质量浓度的限制.
2.3 生长参数对Hg、 As和Cd富集的影响
Yap等[19]的研究表明, 某些污染物的质量分数与体型在双对数尺度上通常会呈现直线关系, 可以用公式Y=a+bX表示. 式中:Y为金属的质量分数;X为体长或湿质量;a为截距;b为斜率. 为探究生长参数对污染物浓度是否存在影响, 本研究对污染物质量分数与生长参数的对数转换形式进行线性回归分析, 结果如表2所示,R2为相关性系数. 数据表明, 3种生物中Hg、 As、 Cd的质量分数与其体长、 湿质量没有显著线性相关关系.
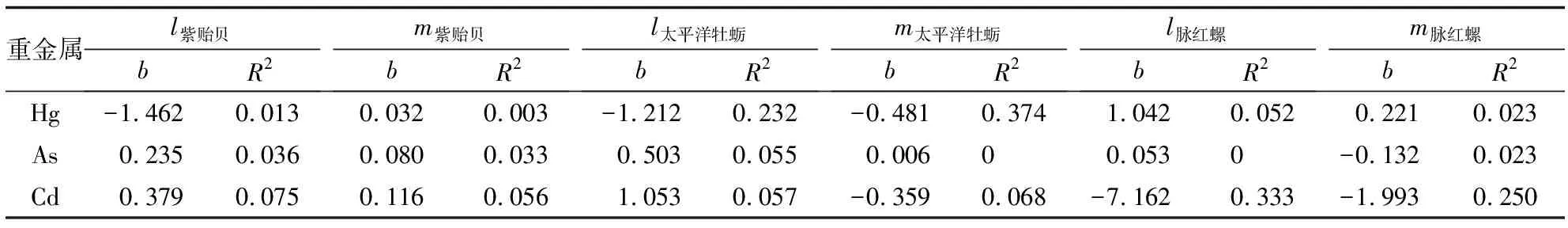
表2 3种底栖动物中Hg、 As、 Cd的质量分数与体长、 湿质量的相关性
分别对紫贻贝、 太平洋牡蛎和脉红螺的软组织中重金属的质量分数(w)、 体长(l)、 湿质量(m)和δ15N进行皮尔森相关性分析, 皮尔森相关性系数用r表示, 结果如图3(a)所示. 紫贻贝组织中Hg的质量分数与δ15N呈显著正相关(r=0.319,P<0.05), Cd与Hg的质量分数呈显著正相关(r=0.312,P<0.05); 太平洋牡蛎软组织中Hg的质量分数与总软组织湿质量呈显著性负相关(r=-0.611,P<0.05); 脉红螺软组织中重金属的质量分数与体长、 湿质量和δ15N之间没有显著相关性.
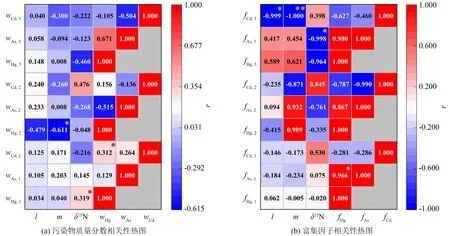
注: 1、 2和3分别代表紫贻贝、 太平洋牡蛎和脉红螺; *表示P<0.05; **表示P<0.01. 图3 生长参数与污染物质量分数和生物富集因子之间的相关性分析Fig.3 Pearson’s correlation analysis of allometric parameters with pollutants mass fractions and bioconcentration factors
对6、 9、 11月份3种底栖生物体长、 湿质量、δ15N、 富集因子进行相关性分析, 如图3(b)所示. 结果显示, 紫贻贝对3种污染物的生物富集因子与生长参数没有显著相关性, 对As的生物富集因子(fAs, 1)与对Hg的生物富集因子(fHg, 1)存在显著性正相关关系(r=0.966,P<0.05); 太平洋牡蛎各因素之间没有显著相关性; 脉红螺除体长与湿质量显著性相关外, 对As的富集因子(fAs, 3)与δ15N呈显著性负相关, 对Cd的富集因子(fCd, 3)与体长和湿质量呈显著性负相关, 其他各因素之间没有显著相关性.
个体生长会对生物体内某些重金属的吸收和富集产生影响[19]. 上述结果显示, 紫贻贝中Hg的质量分数随着δ15N值的升高而显著升高, 而与体长和湿质量的相关性不显著, 说明紫贻贝主要通过摄食途径富集Hg, 因此生长过程中的食性变化会引发Hg的质量分数的波动; 太平洋牡蛎营固着生活, 壳长受到生活空间的影响, 无法准确反映生长状态, 因此太平洋牡蛎软组织内Hg的质量分数与体长无显著相关性这一结果不能反映生长对Hg富集的影响. 太平洋牡蛎Hg的质量分数随着湿质量升高而显著降低, 可能是由于牡蛎软组织含水量较高, 在生长过程中湿质量增速大于对Hg的富集, 会对Hg的质量分数进行稀释; 脉红螺对As的富集因子随着δ15N值的升高而显著降低, 说明脉红螺对食物的选择会影响其对As的富集, 从较高营养级饵料中富集As的比例小于较低营养级饵料, 具体原因还需要进一步调查研究. 脉红螺对Cd的富集因子随体长、 湿质量显著降低, 说明在生长过程中体型增大会降低脉红螺对Cd的富集能力. Hg在海洋中的主要形态是甲基汞, 具有较强的脂溶性特征[20]; Cd在海水中主要以Cd2+形式存在, 易与一些有机化合物特别是含有—SH基团的氨基酸配位体螯合, 因此亦具有较大的脂溶性, 易在水生生物体内脂质含量高的部位蓄积. 个体生长发育过程中, 脂肪含量会因内脏性腺发育产生波动, 这可能是造成亲脂性污染物浓度变化的原因之一. Yap等[19]研究表明, 贻贝软组织中的金属浓度与体型呈负相关, 因为体型越小, 表面积体积比越大, 新陈代谢也就越旺盛, 更有利于污染物的吸收和转移. 紫贻贝体内As、 Cd的质量分数与生长参数没有显著相关性; 太平洋牡蛎体内As、 Cd的质量分数亦与生长参数无显著相关性; 脉红螺体内Hg的质量分数不受生长参数影响. 生物生长过程对污染物的吸收和代谢必然会产生影响, 污染物的质量分数与生物生长无显著相关性, 这是多种生理因素影响下的总结果. 正如Thomas等[21]在研究中指出的那样, 年龄是导致鱼类Hg个体变异的主要因素, 在标准体长下, 年龄大的个体中Hg的质量分数更高. 因为在体长相同时(即年龄为单一变量, 体型不会对Hg的质量分数产生影响), 年龄越大的个体对Hg的富集时间越长. 因此, 在无法控制单一变量的自然环境下, 上述的底栖软体动物生长指标与某些重金属质量分数没有明显的相关性这一结果, 可能是由于年龄(富集时间)、 体型和代谢速率等生理因素导致的个体变异在某种程度上已达到平衡.
前人研究发现, 软体动物体内某几种重金属之间会产生协同、 拮抗等复杂的相互作用[22-23], 对重金属在生物体内的富集产生影响. 例如, 李玉环等[22]研究发现海湾扇贝体内高质量分数的Cd2+对Zn的富集有抑制作用, 而对Se的吸收有促进作用. Leonzio等[23]指出鱼类肌肉中Se和Hg存在互补积累作用. 本研究的结果显示紫贻贝软组织中Hg与Cd的质量分数呈显著正相关,fHg与fAs呈显著正相关, Hg与As、 Cd之间可能存在相互作用, 这一推论还需进一步实验验证. 虽然紫贻贝体内Hg与As、 Cd之间的作用机制尚不明确, 但正如污染物与生物指标之间的相互作用一样, 生物体内污染物之间相互作用的存在也会影响监测数据准确性[23].
3 结语
秦皇岛海域Hg、 As和Cd现存量未超过水质标准(除2020年7、 8和10月太平洋牡蛎样品Cd平均质量分数超标外), 但其在3种底栖生物体内存在富集现象, 有潜在的生态危害. 通过对比分析, 紫贻贝、 太平洋牡蛎和脉红螺对环境中污染物的富集存在种间差异, 对于Hg和As来说, 脉红螺对其更加敏感, 富集能力更强; 对于Cd来说, 牡蛎对其富集能力更强. 相关性分析表明, Hg在紫贻贝、 牡蛎体内的质量分数和脉红螺对As、 Cd的富集都受到生长影响; 紫贻贝体内3种污染物可能存在相互作用. 因此, 脉红螺可以用来监测环境中Hg的污染情况, 太平洋牡蛎可以用来监测环境中Cd的污染情况.

