植物生长素响应基因SAUR 的功能及其在大豆中的研究进展*
季雨佳,赵 琳
(东北农业大学农学院/大豆生物学教育部重点实验室,哈尔滨 150030)
生长素作为人类发现最早的一类植物激素,参与调节植物体的多个生长发育过程。相关研究已确定生长素合成的主要途径、代谢过程及主要生长素响应基因家族。其中SAUR 基因家族(Small auxin up-regulated RNA)作为生长素响应的三大基因家族成员之一,参与植物生长发育的多个过程,在响应生长素变化,影响植物体内生长素合成及转运,细胞伸长、代谢及逆境胁迫中发挥重要作用。研究证实在施加外源生长素的情况下,SAUR 基因转录本显著积累[1]。目前,对SAUR 基因的研究多集中在玉米、水稻、棉花、番茄、拟南芥等作物,在大豆中的研究较少。为深入阐述植物生长素响应基因SAUR 的功能,本文综述了生长素的生理作用、生长素信号转导、生长素与不同激素信号间的相互作用及SAUR 基因功能的研究进展,包括SAUR 基因的结构及在大豆中的功能等,旨在为深入研究大豆SAUR 基因功能奠定理论基础。
1 生长素研究进展
1.1 生长素的生理作用
生长素(Auxin)是一类重要的植物内源激素,其含有1 个不饱和芳香族环和1 个乙酸侧链,化学本质是吲哚乙酸。生长素是人类发现最早且唯一一种具有极性运输特性的植物生长激素。作为调控植物生长发育的重要植物激素之一,生长素在植物体内参与调控多个生长发育过程,如细胞的分裂与分化、花器官的形成、细胞的伸长及侧根与不定根的生长等。相关研究证实生长素的生理效应与浓度相关,低浓度时促进生长,高浓度时抑制生长。此外,生长素还参与调控植物的生理反应,包括向性生长、向光反应及对胁迫的响应等。SAKATA 等[2]研究表明生长素可逆转高温引起的植物雄性不育,通过施加外源生长素可减少由高温对植物造成的损伤。植物生长素IAA 作为引发剂处理棉花种子,通过促进幼苗光合作用和增强抗氧化酶活性提高棉花幼苗耐盐性[3]。刘明等[4]研究表明生长素参与调控低钾胁迫下甘薯根系生长,通过外源施加IAA 可减轻低钾胁迫对甘薯根系生长的抑制作用,提高低钾水平下甘薯对钾离子的吸收,适应低钾环境。
1.2 生长素的合成与信号转导
生长素的生物合成具有动态性和组织特异性,幼苗的所有部位均可合成IAA,合成IAA 后可通过极性运输到达作用部位,其中叶片为重要的合成来源[5]。
生长素生物合成途径分为2 种,即依赖色氨酸途径和非依赖色氨酸途径[6]。以色氨酸(Trp)为前体的4 条典型生长素途径分别为吲哚丙酮酸(IPyA)途径、吲哚乙酰胺(IAM)途径、色胺(TAM)途径和吲哚乙醛肟(IAOx)途径。其中IPyA 途径被认为是生长素生物合成的主要且保守途径,其他途径以平行或以发育/环境调节的方式发挥作用[7]。
生长素代谢包括生长素结合物的形成、转化成IBA 和氧化分解3 个过程。调控植物体内IAA水平的主要分解代谢途径是IAA 不可逆氧化为吲哚二酮-3-乙酸(oxIAA),并进一步糖基化为oxIAA-glc 的过程[8]。在植物体内,生长素保持合成与代谢的动态平衡并在植物生长中发挥重要作用[9]。
生长素信号主要由3 个蛋白家族介导:ARF(Auxin response factor),负责调节生长素应答基因表达;Aux/IAA(Auxin/indole-3-acetic acid)转录抑制剂,负责与ARF 相互作用并阻止其作用;E3 泛素连接酶复合体SCFTIR1/AFB(Transport inhibitor response 1/auxin-related F-box proteins),控制生长素响应的Aux/IAA 快速泛素化降解[10]。生长素信号主要由SCFTIR1E3 泛素连接酶复合体介导,该泛素连接酶复合体在响应IAA 时促进Aux/IAA 阻遏蛋白与SCFTIR1/AFB泛素E3 连接酶复合物TIR1/ AFB F-box组分的相互作用,加速Aux/IAA 26S 蛋白酶体降解,从而改变基因表达[11-13]。2 种生长素应答基因编码负向作用产物(Aux/IAA 转录抑制因子和GH3家族IAA 结合酶),表明及时终止生长素信号起关键作用[14]。Aux/IAAs 家族中的部分蛋白由于缺失结构域而无法被TIR1/AFBs 识别,因此其不能参与经典的生长素信号转导途径,如TMK1-IAA32/34-ARFs 途径和MPK14-IAA33-ARFs 途径等,其主要通过蛋白质磷酸化介导[15]。
1.3 生长素与不同激素间的相互作用
生长素通过联合多种不同激素协同发挥作用。生长素与细胞分裂素相互作用,共同调节侧根和茎的生长发育[16-17]。JONES 等[18]研究表明在拟南芥中,细胞分裂素信号转导可调节IAA 的生物合成速率,生长素和细胞分裂素信号共同参与的稳态反馈调节平衡在发育中的根与茎中起维持适当生长素与细胞分裂素浓度作用。根的生长还受到生长素和乙烯的协同作用控制[19-21]。HUANG 等[22]研究发现,乙烯以生长素和脱落酸(ABA)为下游信号,修饰水稻根细胞伸长和径向扩展,导致根尖膨大,降低其穿透压实土壤的能力。脱落酸同样利用生长素作为下游信号[23],在相互作用中对植物生长发育产生影响。LIU 等[24]研究发现生长素信号传导方面的缺陷会导致对ABA 抑制种子萌发作用敏感性改变。
生长素与赤霉素协同作用调控植物生长发育。HU 等[25]研究发现,RGL1、ARF7 和IAA9 形成三元复合物,介导杨树形成层发育过程中生长素与赤霉素信号通路间的相互作用,其中ARF7 直接激活PIN-FORMED 1 的表达,通过生长素极性运输增加赤霉素(GA)依赖的杨树形成层活动。
2 SAUR 基因功能研究进展
2.1 SAUR 基因结构特征
生长素早期主要响应基因包括Aux/IAAs(Auxin/indole-3-aceticacid)、GH3s(Gretchenhagen3)及SAURs(Smallauxinup-regulatedRNA)3 个家族[26,34]。其中SAUR 基因家族是生长素响应中的最大家族,是MCCLURE 和GUILFOYLE 于1987 年在外源施加生长素诱导伸长的大豆下胚轴中发现的,并判定其为一种由生长素诱导的转录本[27]。SAUR 基因一般缺乏内含子且成簇存在,其启动子上游区域大多含有一个AuxREs,可快速响应生长素[26,28-29]。其3’UTR 非编码区含有高度保守的下游元件DST,导致SUAR 基因编码的mRNA 不稳定,这进一步表明SAUR 基因可在转录后受到调节[30]。SAUR 蛋白高度保守,具有1 个SAUR-specific domain(SSD)核心区域,约由60 个氨基酸组成[31]。SAUR蛋白参与植物生长发育,且同一分支的SAUR 基因表现为功能相似性[32]。
2.2 SAUR 基因在细胞伸长中的研究进展
SAUR 基因通过调节细胞伸长在植物生长发育中发挥作用(见图1)。SPARTZ 等[33]研究表明SAUR19-24 可通过调节生长素运输,作为细胞扩增正效应因子行使功能。HUANG 等[34]研究发现,在外源IAA 及其他生长素类似物的作用下,水稻OsSAUR10 基因表达升高,OsSAUR10 通过促进生长素的生物合成、极性转运及参与细胞伸长起植物生长调节剂作用。KONG 等[35]研究发现,拟南芥中SAUR41 过表达使下胚轴伸长、侧根发育、花瓣膨大;在外源生长素作用下,SAUR41 在伸长区内胚层细胞中特异性诱导,异位表达的SAUR41蛋白促进生长素在下胚轴中的运输。KATHARE等[36]研究发现,SAUR53 在拟南芥中正向调节细胞和器官的伸长,但SAUR53 升高干扰生长素正常运输,负向调节生长素运输。SAUR62/75 与其相互作用蛋白RPL12 在花粉管伸长和核糖体组装中发挥重要作用[37]。组成型GFP-AtSAUR19 的表达绕过生长素需求,促进切除的下胚轴节段延伸,正常生长素诱导SAUR 基因的组成型表达促进器官伸长[38]。
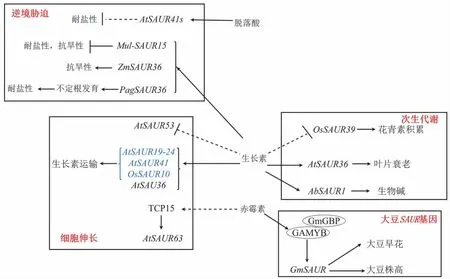
图1 SAUR 基因功能机制图
SAUR 基因表达同时受其他激素调控。STAMMM等[39]研究发现,拟南芥中SAUR36 的表达受生长素和赤霉素调控,外源生长素可显著提高幼苗GUS活性,SAUR36 作为信号整合的交汇点在种子萌发、光依赖性下胚轴伸长及顶端弯钩形成中发挥作用。GASTALDI 等[40]验证TCP15 可通过启动子中的保守靶位点直接激活SAUR63 亚家族基因,从而调节GA 依赖性雄蕊丝伸长。DING 等[41]采用ABA处理SUAR41/40/71/72 缺失的四重突变体和SAUR41 过表达系,发现四重突变体对ABA 反应更敏感,表现在子叶变绿,过表达系表现为敏感性较低,表明SAUR41 亚家族基因是由ABA 诱导的。
2.3 SAUR 基因在代谢过程中的研究进展
次生代谢是指生物合成生命非必需物质并储存次生代谢产物的过程。SAUR 基因在次生代谢过程中发挥重要作用(见图1)。KANT 等[42]研究发现,OsSAUR39 基因在不同环境因子(生长素、氮、盐、细胞分裂素和缺氧)的瞬时变化中表现出快速诱导表达,OsSAUR39 过表达表现为叶绿素含量降低,花青素、脱落酸、糖和淀粉含量升高,叶片衰老加快,施加外源生长素可恢复水稻植株生长缓慢和产量降低表型。在拟南芥中,SAUR36 由外源生长素诱导,是控制叶片衰老的正调节因子,介导生长素诱导的叶片衰老,促进花青素积累[43]。在颠茄中,AbSAUR1 促进颠茄生长发育,使株高和根系分枝增加,显著提高产量和生物碱含量[44]。
2.4 SAUR 基因在逆境胁迫中的研究进展
SAUR 基因在逆境胁迫中发挥作用(见图1)。在拟南芥中,SUAR41/40/71/72 缺失的四重突变体和SAUR41 过表达系在幼苗育成过程中均对盐胁迫高度敏感,其中SAUR41 亚家族基因可提高拟南芥耐盐性[45]。在玉米中,ZmSAUR36 过表达促进玉米根伸长,提高玉米抗旱性[46]。在杨树中,WOX11/12a 蛋白直接与SAUR36 启动子结合调控SAUR36 转录,这种结合在盐胁迫时增强,可提高杨树耐盐性[47]。在桑树中,Mul-SAUR15 基因促进幼苗根系生长发育,参与植物对环境胁迫的响应过程[48]。
3 大豆SAUR 基因的研究进展
大豆作为我国重要的粮食和油料作物,在国民经济中占有重要地位,在保障我国粮食安全中发挥重要作用[49]。目前,人们对生长素信号转导过程及生长素响应因子,特别是SAUR 基因功能的研究较为深入,多集中在玉米、水稻、棉花、番茄、拟南芥等作物,但对大豆SAUR 基因的研究较少。SUN 等[50]研究发现,GmSAUR 基因可促进大豆开花及成熟,GmGBP1 蛋白与GmGAMYB 蛋白相互作用增强赤霉素信号,赤霉素信号激活GmSAUR 基因表达,促进大豆株高增加及下胚轴伸长(见图1)。上述研究使人们加强了对大豆光周期控制开花和赤霉素控制株高分子机制的认识,对进一步探究GmSAUR 基因在大豆生长发育及其他过程中的作用具有重要意义。
当前,我国大豆产业发展迅猛,但与世界发达国家大豆生产水平相较仍具有一定差距[51]。随着生物信息学的迅猛发展及分子育种的普及与应用,大豆GmSAUR 基因功能将被深入阐释,这也将会对生长素信号转导通路的研究产生积极影响。

