大豆GmHSF21 基因的生物信息学分析*
宋勇泽,刘汝翠,朱永胜,李 月,姜 妍,佟晓红,王绍东**,王 遂
(1.东北农业大学农学院,哈尔滨 150030;2.克东禹王大豆蛋白食品有限公司,黑龙江 克东 164800;3.黑龙江九阳豆业有限公司,黑龙江 大庆 166200;4.杭州九阳豆业有限公司,杭州 310018)
大豆在我国种植历史悠久,富含丰富的蛋白质和油脂,在国民生产中占有重要地位[1-2]。“扩大豆,提产能”是当前我国大豆生产的重要任务。目前,受种植结构调整及耕地资源限制等因素影响,亟需扩大大豆适用耕地资源。我国盐渍土地面积较大,其总面积约为99.13 万km2,其中涵盖了作为我国粮食主产区的黄淮海平原和东北松嫩平原[3-4]。因此,提升大豆耐盐碱性可作为增加大豆产量和耕地面积的重要手段之一,筛选耐盐碱大豆品种是提高盐碱地利用率的重要途径。
植物中共有64 种转录因子,其广泛参与植物的细胞、分子、生理生化等不同调节机制,通过调节基因表达水平抵御胁迫带来的伤害[5-6]。热激转录因子作为植物中研究广泛的转录因子之一,根据其蛋白质结构差异可分为A、B、C 三类[7]。其中仅有A 类HSFs 成员C 末端包含具有转录激活功能的AHA 基序。目前,对植物热激转录因子的研究主要集中在A 类,对B 类和C 类的研究相对较少[8]。A 类热激转录因子是参与热胁迫响应的重要调控因子,其通过调控热激蛋白(Heat shock protein,HSPs)基因的表达参与植物热胁迫响应[9-10],在细胞中发挥重要保护作用,可维持蛋白质的正确折叠和细胞内环境稳定性,减轻由胁迫对细胞产生的损害。此外,A 类热激转录因子还参与干旱及盐等非生物胁迫[11-12]。
A 类热激转录因子对防治生物胁迫和非生物胁迫具有重要意义。云柳等[13]发现将小麦HSFB4 基因转至拟南芥中可负向调控拟南芥抗盐性和耐旱性;李天豪等[14]人发现将桃A 类HSF 转录因子PpHSF18 过表达可减小其分枝角度。水稻中的OsHSFC1b 在对渗透胁迫响应及ABA 介导的耐盐性中发挥重要作用[15]。OsHSFC2a 的CRISPR/Cas9敲除突变后不仅可使种子在低温条件下萌发加速,还可上调COLD1 等耐冷基因的表达[16]。LI 等[17]发现在高温条件下番茄SlHSFA3 基因表达水平显著提高,该基因过表达可显著增强植株对高温的耐受性。
大豆属中低度耐盐作物,因此筛选耐盐基因对大豆产量和品质提升及保证大豆在逆境胁迫条件时降低产量损失具有重要意义[18]。本文以大豆品种中黄13 前期盐胁迫处理下的转录组差异基因数据为研究对象,对HSF 基因家族中的候选基因GmHSF21 进行生物信息学分析,旨在为深入探究大豆GmHSF21 在盐胁迫应答中的作用机制奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
中黄13[19]由东北农业大学大豆遗传育种实验室提供。在东北农业大学温室大棚中采用盆栽法对三叶期大豆幼苗进行盐胁迫处理。采用浓度为200 mmol/L 的NaCl 溶液灌根2 次,灌根时间间隔为48 h。于灌根处理后24 h 取第3 个三出复叶,所有叶片取样后立即采用液氮速冻,于-80 ℃冰箱保存,用于提取大豆总RNA。
1.1.2 试剂材料
大豆总RNA 提取:OMEGA 植物RNA 提取试剂盒(BIO-TEK,R6827-01),北京百泰克生物技术有限公司;反转录:PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa,RR047A),宝日医(北京)生物技术有限公司;荧光定量分析:SYBR Green Realtime PCR Master Mix(TOYOBO,QPK-201),东洋纺(上海)生物科技有限公司; 2 × Taq PCR MasterMix II(TIANGEN,KT211-02),天根生化科技(北京)有限公司。
1.1.3 其他材料
基因组信息参考中黄13 基因组ZH13.v2 版本(https://ngdc.cncb.ac.cn/soyomics/download)。
1.2 试验方法
1.2.1 大豆GmHSF21 蛋白质结构及多态性位点分析
通过PlantTFDB 下载大豆HSF 家族全部蛋白质序列。利用SOPMA(http://npsa-pbil.ibcp.fr/cgibin/npsa_automat.pl?page=npsa)预测蛋白质二级结构,利用Alphafold2(https://alphafold.ebi.ac.uk)预测蛋白质三级结构,采用Pymol(version2.5.5)绘制三级结构图。
1.2.2 大豆HSF 基因家族结构域预测
通过MEME(https://meme-suite.org)进行HSF家族保守结构域功能基序分析,利用TBtools(version1.120)对其结果进行可视化。
1.2.3 大豆HSF 基因家族系统发育及顺式作用元件分析
通过Tair(https://www.arabidopsis.org/)下载拟南芥HSF 家族蛋白质序列,通过MEGA(version11)软件与大豆HSF 家族蛋白质序列进行ClustalW 多重序列比对,构建系统发育进化树。利用TBtools获取基因上游2 000 bp 序列,通过Plant Care(https://bioinformatics.psb.ugent.be/webtools/plantcare)进行顺式作用元件预测,再利用TBtools 对其结果进行可视化。
1.2.4 大豆总RNA 提取及cDNA 合成
使用OMEGA 试剂盒提取大豆总RNA,进行去除基因组DNA 反应。每个反应管分装10 μL 混合液、10 μL 去除基因组DNA 后的RNA,混匀后进行反转录,条件设置为37 ℃反应15 min,85 ℃反应5 s,随后放入-20 ℃保存。混合溶液为:4 μL RNase Free dH2O、4 μL 5 × PrimeScript Buffer 2(for Real Time)、1 μL RT Primer Mix、1 μL Prime-Script RT Enzyme Mix I。
1.2.5 盐胁迫差异基因的荧光定量PCR 分析
通过盐胁迫差异对基因进行荧光定量PCR 分析,其中处理1 为对照CK(无任何处理),处理2为经盐胁迫处理24 h。荧光定量PCR 分析使用TOYOBO 试剂盒,混合溶液为:6.4 μL 的ddH2O、10 μL SYBR Green Realtime PCR Master Mix、上下游引物各0.8 μL 及2 μL 的cDNA 模板。设置3 次重复,扩增阶段反应条件为:95 ℃反应15 s,60 ℃反应60 s,循环次数为45 次。引物设计使用NCBI 数据库中的Primer-BLAST 功能设计引物,并对引物进行特异验证。选择特异性好、退火温度相近、跨内含子的引物。引物及序列信息参数如表1 所示。

表1 大豆盐胁迫差异基因荧光定量PCR 引物信息参数
2 结果与分析
2.1 大豆GmHSF21 蛋白质结构分析
2.1.1 大豆GmHSF21 蛋白质二级结构预测
由图1 可知,大豆GmHSF21 共编码341 个氨基酸,其中183 个氨基酸处于α-螺旋结构中,16 个氨基酸处于伸展链结构中,18 个氨基酸处于β-转角中,124 个氨基酸处于无规则卷曲中。
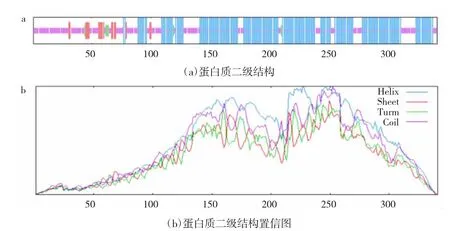
图1 大豆GmHSF21 蛋白质二级结构预测
2.1.2 大豆GmHSF21 蛋白质三级结构预测
大豆GmHSF21 蛋白质三级结构预测如图2(a)所示。图2(b)为蛋白质三级结构置信图,当预测结构与真实结构在残基y 上对齐时,位置(x,y)处的颜色表示AlphaFold 2 在残基x 处的预期位置误差。由图2(b)可知,由大豆GmHSF21基因编码的蛋白质氨基酸序列长度为40~130 bp,预测结构可信。
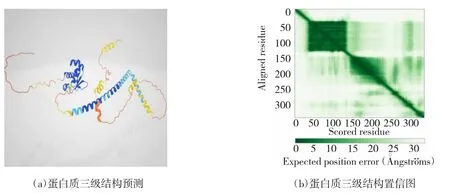
图2 大豆GmHSF21 蛋白质三级结构图
结果表明,该蛋白质仅含有1 条多肽链时空间结构相对稳定。
2.1.3 大豆GmHSF21 基因多态性位点分析
由图3 可知,编码区共存在4 处多态性位点,其中2 个位点位于α-螺旋结构中,另2 个位点位于无规则卷曲中。
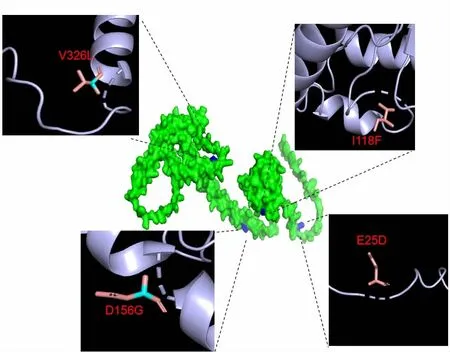
图3 大豆GmHSF21 突变体三级结构预测
4 处位点分别位于第25、118、156、326 个氨基酸处,其中第156 个氨基酸突变导致氨基酸电荷改变,由带负电荷的天冬氨酸突变为不带电荷的甘氨酸。
2.2 大豆HSF 基因家族结构域预测
由图4 可知,HSF 基因家族成员均具有保守基序HSF 和HSF DNA-binding,且大部分含有UPF0242 和BRE1 超家族基序,表明该基因家族蛋白具有相似结构域,其基因可能具有相似功能。
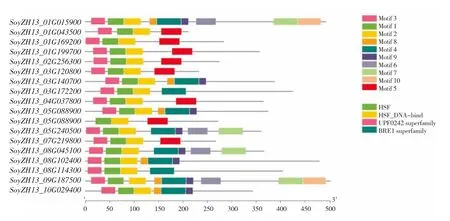
图4 大豆HSF 基因家族结构域分析
2.3 大豆HSF 基因家族系统发育分析
由图5 可知,AT3G22830 与GmHSF21 亲缘关系近。研究显示,AT3G22830 属HSF 基因家族中的A 亚族,且已被证实AT3G22830 基因参与抗病反应,在抵抗逆境胁迫中发挥重要作用[20]。结果表明,大豆GmHSF21 为HSF 基因家族中的A 亚族,推测其可能与AT3G22830 行使相同功能,在非生物胁迫中发挥作用。
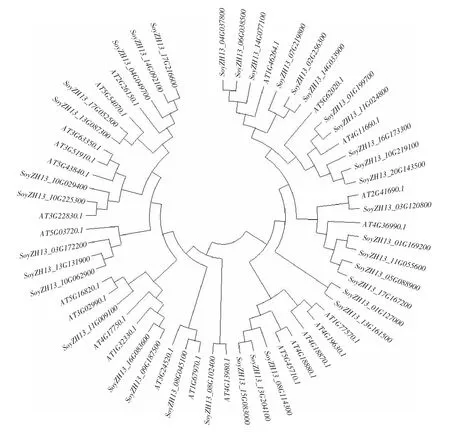
图5 不同物种HSF 基因家族系统进化树
2.4 大豆GmHSF21 启动子顺式作用原件分析
由图6 可知,大豆GmHSF21 的启动子顺式作用元件包含光响应元件、脱落酸元件、防御及应激响应元件等,多与胁迫相关。结果表明,GmHSF21 参与多种胁迫响应,在逆境胁迫中发挥重要作用。

图6 大豆GmHSF21 启动子顺式作用原件分析
2.5 大豆GmHSF21 基因表达量分析
由图7 可知,盐胁迫条件下大豆GmHSF21 基因的表达量上调。结果表明,该基因参与盐胁迫调控。
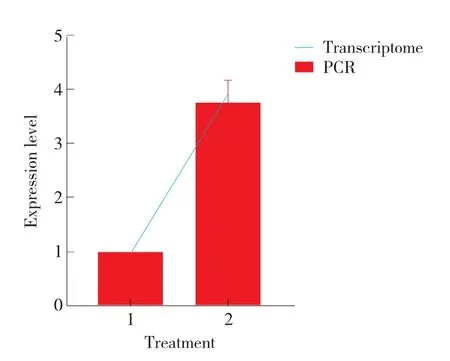
图7 大豆GmHSF21 盐胁迫后基因表达量
3 结论与讨论
本研究通过对大豆GmHSF21 的生物信息学分析发现该基因共编码341 个氨基酸,其编码区存在4 处多态性位点,具有保守的HSF 和HSF DNA-binding 基序。其中第156 个氨基酸处的多态性位点位于HSF DNA-binding 结构域中,该处氨基酸由天冬氨酸突变为甘氨酸,其中甘氨酸为非极性疏水性氨基酸,天冬氨酸为酸性氨基酸,二者理化性质不同。α-螺旋结构的稳定是蛋白质结构稳定的基础,已有研究表明脯氨酸、甘氨酸、酪氨酸及天门冬酰胺不利于α-螺旋结构稳定。本研究中第156 个氨基酸处的多态性位点处于α-螺旋结构中,且突变后对应的氨基酸为甘氨酸,因此推测该突变可能会造成α-螺旋结构不稳定,其是否会对蛋白质功能产生影响需要进一步研究证实。
系统发育分析表明AT3G22830 与GmHSF21亲缘关系近,符合HSF 基因家族中A 亚族的一般特征,推测其可能与AT3G22830 行使相同功能,在非生物胁迫中发挥作用。顺式作用元件预测发现该基因启动子顺式作用元件包含光响应元件、脱落酸元件、防御及应激响应元件等,多与胁迫相关,表明大豆GmHSF21 基因可能参与植物胁迫应答。当前部分HSF 基因家族成员已被证实能够调节植株对盐胁迫的响应,但目前关于上述研究结果还存在一定争议。一方面,研究发现某些植物中增加热激蛋白的表达可增强植物对盐碱胁迫的耐受性。这是因为热激蛋白可协助维持蛋白质的正确折叠,避免蛋白质在胁迫条件下聚集和失活,从而维持细胞正常功能[21]。另一方面,热激蛋白过表达可能影响植物生长发育。SUN 等[22]发现匍匐剪股颖发芽期和生长期对高盐和外源脱落酸的超敏性和AsHSP17 基因的过表达相关。这可能与蛋白质折叠和调节的平衡有关,过多热激蛋白可能干扰其他蛋白质的正常功能。
HSF 基因家族作为近年来的研究热点,已被证实可响应除热胁迫外的其他非生物胁迫。相关研究发现,大豆共有52 个HSF 基因家族成员,在不同胁迫条件下,每个基因的表达水平相差较大[23]。盐胁迫条件下,GmHSF12 已被证实在24 h 内表达量显著上调。低温胁迫条件下,GmHSF12 和GmHSF28 基因表达量稍上调,GmHSF35 显著上调[23]。LI 等[24]研究发现GmHSF34 基因转入拟南芥后使其对高温和干旱胁迫的耐受性增强。此外,GmHSFB2b 可促进黄酮类化合物合成,降低体内ROS 积累,提高大豆耐盐性[25]。盐胁迫差异基因荧光定量PCR 分析表明,盐胁迫条件下大豆GmHSF21基因表达量上调,表明该基因参与盐胁迫调控。
本研究为进一步研究大豆GmHSF21 基因功能奠定了基础。今后将对该基因在不同部位、不同时期的表达及HSF 基因家族在大豆盐胁迫条件下的表达进行研究,并通过构建该基因过表达载体在拟南芥和大豆中进行遗传转化,实现对该基因功能的深入系统鉴定。

