异时性肺小细胞癌继发肺腺癌1 例同源性分析*
叶颖雪,左卓,聂畅波,周进,魏阳,谢华,朱亚杰
611137 成都,成都中医药大学 医学与生命科学学院(叶颖雪、聂畅波) ;610041 成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 肿瘤内科(左卓、周进、魏阳、谢华、朱亚杰)
据全球癌症流行病学数据GLOBOCAN 2020年统计,肺癌是全球第2 大常见癌症,目前仍是导致癌症死亡的首要原因。中国的肺癌发病数和死亡数分别占全球37.0%和39.8%[1]。肺癌通常分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC)两大类,根据2015 年WHO修订的病理分型标准,肺癌病理学分类中较为常见的是鳞状细胞癌、腺癌以及小细胞癌[2]。小细胞肺癌的癌细胞来源于支气管黏膜的基底细胞或储备细胞,约占肺癌的10%~20%,患者生存率较低,中位生存时间仅8~13 个月,2年生存率<5%[3-4]。肺腺癌约占肺癌的25%~30%。不同组织学类型来源的癌对相同治疗方案的反应略有不同,且肿瘤在恶性进展或药物压力下会存在发生组织病理学转变的情况[5-6],因此临床上应特别重视肺癌的病理类型。
肺癌多为单发,而多原发肺癌(multiple primary lung cancer,MPLC)是指两个及两个以上原发性肺癌出现在肺的不同部位,且各个癌灶排除肺内转移癌[7]。早在1975 年,根据病灶出现的时间不同,Martini 等[8]将MPLC 分为同时性多原发性肺癌(synchronous multiple primary lung cancer,sMPLC)和异时性多原发性肺癌(metachronous multiple primary lung cancer,mMPLC)两大类,两者多需鉴别。随着我国肺癌发病率的增加,基于临床、影像及病理检测技术的提升[9],被诊断为mMPLC 的患者人数也在逐年上升。
目前国内肺异时性多重癌的报道较少[10],现就临床上1 例肺异时性肺小细胞癌继发肺腺癌进行临床报告及文献复习,通过此病例前后组织病理学及分子检测分析比对确诊病理学转化或双原发,分子检测指导下的精准治疗,最大程度地延长了患者生存。通过对此病例诊疗过程的分析,总结经验,以期对多原发肺癌的诊治有所启发,减少临床误诊误治几率。
1 临床资料
女性,69 岁,因在外院支气管镜检查发现新生物于2018 年4 月转诊至我院。患者2018 年3 月出现咳嗽、咳痰、气紧不适,外院颅脑胸腹部CT 提示:右肺中央型占位伴右下肺不张及阻塞性肺炎,大小约2.4 cm×1.3 cm。2018 年4 月8 日纤支镜:右中间叶支气管近右下肺开口处见菜花状新生物阻塞管腔。2018 年4 月19 日外院支气管镜标本于我院会诊提示:<右下肺>结合HE 形态及肿瘤细胞免疫表型:PCK(点状+),CK7(-),TTF-1(+),CGA(+),Syn(+),CD56(+),P63(-),LCA(-),Ki-67(+,约75%),活检组织:小细胞癌。明确诊断和分期为:右肺中央型小细胞肺癌(T3N2M0,IIIB 期,局限期)。2018 年4 月25 日至2018 年9 月12 日行EC 方案(依托泊苷+卡铂)6 周期化疗。2018 年5 月21 日至2018 年6 月8 日完成同步放疗:1.5 Gy×30 次Bid(图1)。疗效评价:PR。根治性治疗结束后,于2018 年8 月9 日行全身PET/CT(图2)评估示:与2018 年4 月17 日旧片对比,右下肺区不规则稍增厚影,末见明显占位,病灶较前明显缩小,综合考虑:符合肺癌治疗后肿瘤活性受抑表现,SUV 1.4;右肺门及纵隔小淋巴结显示,短径约0.8 cm,代谢稍增高,SUV 2.1。经MDT 讨论后,认为患者右肺门淋巴结为炎性增生性可能大,于2018 年9 月完成颅脑预防性放疗。之后定期门诊复查未见肿瘤复发转移征象。
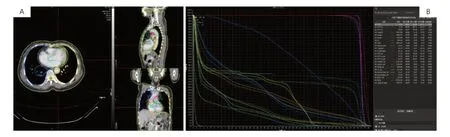
图1 本例患者的放射治疗计划图像Figure 1.Planning Images of Radiotherapy for This Case
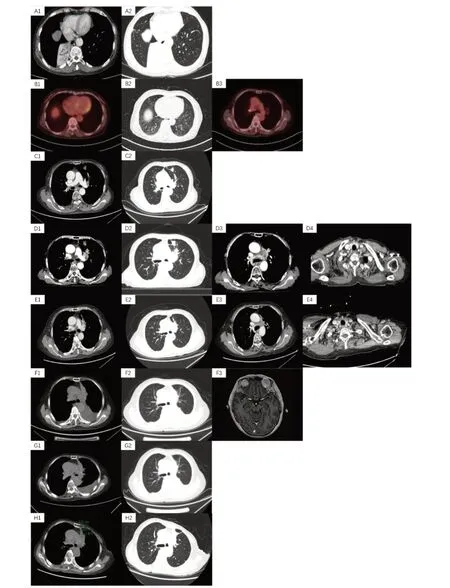
图2 不同治疗时期的图像Figure 2.Different Treatment Periods
2019 年12 月27 日于我院常规复查发现左肺结节,建议患者肺穿刺活检,患者因无任何症状,要求随访。2020 年4 月13 日胸上中腹增强CT 示:左肺上叶前段团片影,较前范围明显增大,约4.6 cm×2.2 cm,周围肺野及左肺上叶舌段少许小结节、斑片及实变影,较前新增;左锁骨上、双肺门及纵隔内多发稍大及增大淋巴结,伴液化坏死,较前增多、增大,短径约1.3 cm,多系转移;心包少-中量积液,较前新增。综上考虑为患者小细胞肺癌(T3NXM0,局限期)放化疗后复发转移,于2020 年4 月21 日行左颈部淋巴结穿刺活检:查见癌细胞。颅脑MRI未见明显占位,骨扫描未见明显骨转移征象。考虑为小细胞肺癌复发,筛选入组我院“SHR-1316 联合卡铂和依托泊苷对比安慰剂联合卡铂和依托泊苷一线治疗广泛期小细胞肺癌的随机、双盲、安慰剂对照、多中心的III 期临床研究”,于2020 年4 月28 日患者左颈部淋巴结活检免疫组化回示:(左颈4 区淋巴结)穿刺组织:查见癌,癌组织呈筛状结构,结合肿瘤细胞免疫表型:CK7(+),CK5/6(灶+),TTF-1(+),NapsinA(-),CgA(-),CD56(-),Syn(-),Ki67(+,约50%),P40(灶+),PAX8(-),SP-B(-);首先考虑为腺癌,免疫组化提示肺来源可能性大。患者既往病理学类型为小细胞肺癌,本次颈部淋巴结穿刺活检提示腺癌,不符合临床研究入组标准,遂出组此研究。为进一步明确患者两种不同组织学类型肿瘤相关性,安排患者行原发病灶活检。2020 年5 月20 日行EBUS 纤支镜活检病理诊断:(4L 淋巴结)(2R 淋巴结)查见少量异型细胞,TTF-1(+),NapsinA(-),CK5/6(-),p63(-),CgA(-),Syn(-),ALK-V(+),ROS1(-),ERCC(个别阳性),SPB(-),CK7(+),Ki67(40%),较倾向为腺癌。2020 年5 月27 日基因检测(我院10 基因 FCR-ARMS 法):EML4-ALK/KIF5B融合基因突变(突变Ct 值为22.83),余均为阴性。考虑患者为双原发肺癌,更改诊断和分期:左肺腺癌伴双肺门纵隔及左锁骨上淋巴结转移(T2N3M0,IIIC 期,ALK+);右肺中央型小细胞肺癌(T2NXM0,局限期)。放疗科评估后示:患者既往已达根治剂量,且伴多发转移,暂不考虑针对左肺放疗。于2020 年5 月28 日开始口服“阿来替尼600 mg po Bid”靶向治疗,期间疗效评价:PR。为进一步明确患者2018年右肺病变与2020 年左肺病变是否存在关联性,将患者两次组织标本进行免疫组化染色,2018 年右肺标本:PCK(点状+),CK7(-),TTF-1(+),CGA(+),Syn(+),CD56(+),P63(-),LCA(-),Ki-67(+,约75%);2020 年纵隔淋巴结:CK7(+),CK5/6(灶+),TTF-1(+),NapsinA(-),CgA(-),CD56(-),Syn(-),Ki67(+,约50%),P40(灶+),PAX8(-),SP-B(-)。2020 年标本组织病理学对比2018 年标本在细胞形态(图3)及免疫组化(图4)、基因表型方面均有很大差异。
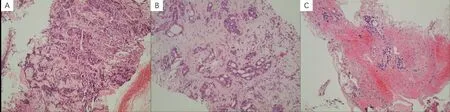
图3 本例患者的组织病理学图片Figure 3.Histopathological Images of This Case
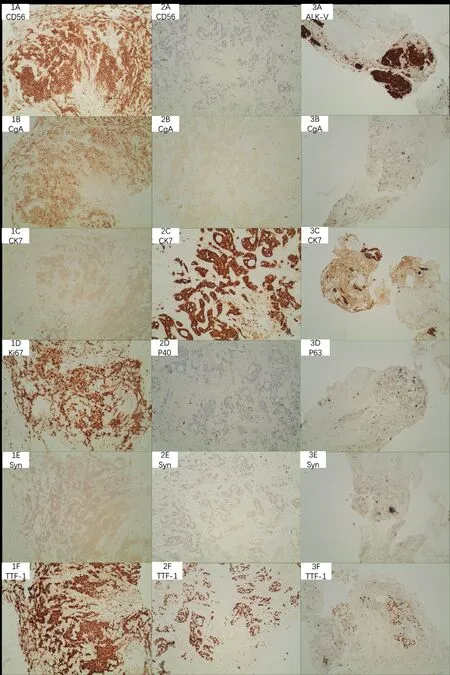
图4 本例患者的免疫组化图片Figure 4.Immunohistological Images of This Case
2021 年8 月23 日肿瘤标志物血清CA-125 明显增高:381.8 U/mL,定期随访患者治疗期间肿瘤标志物NSE、CA125 变化情况(图5)。2021 年10月27 日胸部增强CT:左肺门区及左肺上叶纵隔旁软组织增厚伴邻近实变不张炎变影,范围较前稍增大;心包微量积液,左侧胸腔少-中量积液,均较前增多;右侧胸腔微量积液,较前新增。复查结果提示肿瘤进展伴胸腔积液,疗效评价:PD。2021 年11月02 日颅脑增强MR:右岛叶及小脑半球强化类结节影,较前新增;脑白质脱髓鞘改变,颅内散在小缺血灶,较前稍明显。患者脑转移待排,无任何症状,继续定期每隔3~6 月复查头颅MRI 随访,无明显变化。2021 年11 月3 日骨扫描:未见明显异常。2021 年11 月3 日<胸水液基>:查见肿瘤细胞,倾向腺癌。病理补充诊断:肿瘤细胞免疫表型:CR(-), Vimentin(-), EA(+), TTF-1(+), Napsin A(-),提示肺来源腺癌可能性大;其中:ALK(D5F3)N(-),ALK(D5F3)P(+), PD-L1 22C3(-)。2021 年11 月12 日基因检测(燃石医学):EML4-ALK(E6:A20)融合基因突变;ALK-p.G1202R(+)。因劳拉替尼尚未在国内上市,建议患者可考虑恩沙替尼靶向治疗,患者因经费原因拒绝。故于2021 年11 月23 日至2022 年1 月19 日行3 周期“贝伐珠单抗+培美曲塞+卡铂”方案治疗,疗效评价:SD。胸腔积液控制良好,可测量病灶稳定状态。
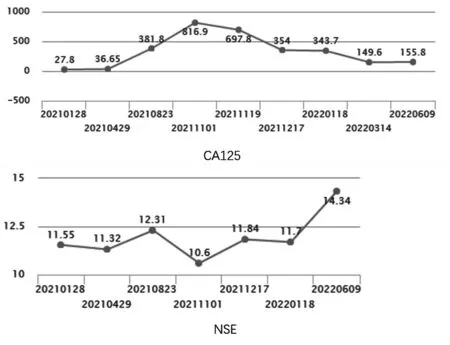
图5 血清糖类抗原125(U/mL)及神经元特异性烯醇化酶(ng/mL)水平Figure 5.CA-125 (U/mL) and NSE (ng/mL) Levels in Serum
由于患者为老年女性,已接受多程抗肿瘤治疗,ECOG 2 分,并且患者对化疗耐受性差,拒绝继续治疗,故后续于2022 年2 月10 日开始自行购买“劳拉替尼(孟加拉版)”靶向治疗至今。门诊随访中患者一般情况可,2023 年3 月3 日末次电话随访联系患者家属,告知患者继续服用劳拉替尼抗肿瘤治疗。
2 讨 论
在淋巴结穿刺查见癌细胞后,为明确患者是原发二重癌、小细胞癌与肺腺癌混杂成分、亦或小细胞肺癌发生腺癌转化,我们再次进行纤支镜检查,发现右肺支气管通畅,未见新生物;给予纵隔淋巴结EBUS 活检(提示肺腺癌,未见小细胞成分),并将患者初诊左肺小细胞肺癌标本、左颈部转移性肺腺癌标本与纵隔淋巴结标本进行HE 染色、免疫组化及基因检测。拟从细胞形态学、免疫组化表型及基因状态三方面分析相继两年出现的左右两侧肺部肿瘤的相关性:
(1)形态学上。2018 年初诊右肺标本肿瘤细胞胞浆稀少,核染色质细腻,无核仁,呈圆形、卵圆形或成角,部分区挤压明显,可见坏死,核分裂易见。而2020 年左颈部淋巴结及纵隔淋巴结活检标本在形态学方面与前者存在很大不同,肿瘤细胞胞浆丰富红染,细胞核染色质拉空,部分可见核仁,腺样分化明显。
(2)免疫组化表型。2018 年4 月19 日右下肺:PCK(点状+),CK7(-),TTF-1(+),CGA(+),Syn(+),CD56(+),P63(-),LCA(-),Ki-67(+约75%),活检组织:小细胞癌。2020 年4 月28 日左颈4L 淋巴结:CK7(+),CK5/6(灶+),TTF-1(+),NapsinA(-),CgA(-),CD56(-),Syn(-),Ki67(+,约50%),P40(灶+),PAX8(-),SP-B(-);首先考虑为腺癌,免疫组化提示肺来源可能性大。2020年5月20日2R淋巴结:TTF-1(+),NapsinA(-),CK5/6(-),p63(-),CgA(-),Syn(-),ALK-V(+),ROS1(-),ERCC(个别阳性),SPB(-),CK7(+),KI67(40%),较倾向为腺癌。
(3)基因同源性分析。据文献报道[11],3%~10%的EGFR 突变型NSCLC 患者会发生SCLC 转化,其分子机制尚不明确,该EGFR-TKIs 获得性耐药机制对预后有明显不良影响。此患者初诊右肺小细胞癌与2 年后确诊的肺腺癌是否在基因层面上有相关性呢?经患者知情同意后,我们将患者前后两次标本进行了520 基因NGS 检测(患者免费),2020 年7 月4 日肺穿刺切片基因检测(燃石医学)提示:2018 年标本:RB1基因:p.E313D(丰度13.39%)、TP53基因:p.V157F(丰度16.31%)。2020 年标本:ALK基因:EML4-ALK(E6:A20)(丰度7.49%)、RB1基因:p.E79*(丰度8.77%)、TP53基因:p.P152fs(丰度12.40%)。综上,患者2020 年右肺病变与2018 年左肺病变无相关性,此患者系肺部二重癌。
此病例给我们以下几点启示:
首先,患者初诊小细胞肺癌局限期,根据NCCN及CSCO 指南,给予标准根治性放化疗及PCI 治疗,2018 年随访至今,未见小细胞肺癌复发转移征象。明确病理诊断和临床分期,并遵循循证医学原则给予相应治疗是患者长生存的必要保障。提高肿瘤治疗前临床TNM 分期也是国家卫健委2021 年十大医疗质量改进目标之一。
其次,鉴别原发肺癌的复发转移与多原发肺癌时,组织病理学的方法是目前最简单可靠的方式之一[12]。Girard 等[13]在2009 年提出综合组织学评估的方法,通过更详细评估多个病变之间病理特征的差异来区分多原发与转移。如果肿瘤间的主要组织学类型和其他亚型比例相同或基质特征百分比相似,则认为是肿瘤内转移;如果肿瘤间为不同的组织学类型或其主要亚型不同(即腺泡、乳头),或者当其一肿瘤为鳞状细胞癌时,细胞和基质特征不同,则认为肿瘤是多原发肺癌。不过该方法只能应用于术后标本。第一原发癌病灶(first primary cancer,FPC)与第二原发癌病灶(second primary cancer,SPC)通常关系密切,相关研究发现,FPC 为肺癌的患者,其SPC常常分布于胃肠道、泌尿系统及甲状腺等[14-15]。本例患者为较为少见的FPC 及SPC 均为肺癌。在既往传统治疗时代,病理学检查就可以基本确诊多原发或继发转移肿瘤,我们认为病理学类型一旦确定,不会再发生相关转化。但在靶向及免疫精准治疗时代,病理学类型转化已成为耐药机制的一种,单纯应用组织病理学已无法满足复杂的临床需求。此例患者在右肺及左肺相继出现肿瘤性病变,引起了我们的高度关注,为明确诊断并给予患者精准治疗,我们免费为患者做了前后病理标本的病理学及基因同源性分析,最终确认患者为双原发肺癌,并在基因指导下给予ALK TKI 阿来替尼靶向治疗。在阿来替尼靶向治疗后1 年余耐药,行第二次基因检测后明确系因ALK 激酶域基因发生G1202R 突变而产生耐药,在含铂双药化疗联合贝伐疗效欠佳,且耐受性差后选择劳拉替尼继续靶向治疗,疗效评价为PR,且明显提高了患者的生存质量。劳拉替尼作为第三代ALK 抑制剂,低剂量对ALK G1202R 突变的患者起作用,具有ALK 和ROS 突变的双重抑制作用[16],劳拉替尼的研发,成为解决第二代ALK 抑制剂耐药的方法。后续,我们也将对此患者进行持续随访。
第三,肿瘤标志物虽然不是确诊的必要条件,但在病理类型发生转化的肺癌患者中,NSE、CEA、CA125 等项目的随访可在影像及病理之前给予临床医师一些提示作用[17]。
最后,通过对本例患者的治疗经过分析及相关文献复习,本文在双重癌及同一肿瘤病理类型转化方面进行了深入探索,强调多次组织活检及多次基因检测的重要性,精准检测指导下的精准治疗,才能最大程度的避免误诊,使患者获得更长很好的生存。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

