α-常春藤皂苷通过激活和稳定p53/Noxa信号诱导肝癌细胞凋亡*
陈晓静,周莉,刘凯琪,段菊凤,刘明,李洪亮,汪选斌,2,3
[1.湖北医药学院附属人民医院药学部和药学院,十堰 442000;2.湖北医药学院生物医药研究院,十堰 442000;3.武当特色中药研究湖北省重点实验室(湖北医药学院),十堰 442000]
预知子(AkebiaeFructus)为湖北武当山地区特色中药,α-常春藤皂苷(α-hederin)为其主要活性成分,也是其质量标志物[1-2]。α-常春藤皂苷可体外抑制胰腺癌、肺腺癌、喉癌、结肠癌、组织细胞淋巴瘤、急性单核白血病等细胞的增殖[3-4],在体内亦可抑制肝细胞癌(hepatocellular carcinoma,HCC)的生长和转移[5],可导致HCC胞膜孔隙形成[4,6],使活性氧自由基(reactive oxygen species,ROS)升高,膜渗透性增加,产生凋亡[5,7-9],抑制HCC转移[10]。但α-常春藤皂苷诱导HCC凋亡的机制尚不完全清楚。笔者在本研究将α-常春藤皂苷作用于HCC,研究其诱导凋亡可能的机制,以期为解释预知子抗肝癌作用机制提供依据。
1 材料与方法
1.1实验动物 6~8周龄雄性Balb/c裸鼠10只,无特定病原体(specific pathogen free,SPF)级,购买于斯贝福(北京)生物技术有限公司,饲养于湖北医药学院动物中心,实验动物生产许可证号:SCXK(京)2019-0010。实验符合动物实验伦理规定[伦理审查批件编号:TY20222505,湖北医药学院动(福)第2022-实090号]。
1.2药品与试剂 α-常春藤皂苷购于成都埃法生物科技有限公司(货号:AB1189,含量>98%);阳性对照药喜树碱(camptothecin,CPT)购于Selleck公司(上海),货号:S1288;噻唑蓝[3-(4,5)-dimethylthiahiazo (-z-y1)-3,MTT]购于合肥Biosharp公司(货号:3580GR001);PI/Annexin V 凋亡检测试剂盒购于BD生命科学(美国Becton,Dickinson and Company,货号:556547);Noxa单抗隆一抗(兔抗人,1:1 000,货号:14766S)、p-p53单抗隆一抗(兔抗人,1:1 000,货号:9287T),p53单抗隆一抗(兔抗人,1:1 000,货号:2527S)、Bcl-2单抗隆一抗(小鼠抗人,1:1 000,货号:3498T)、Bax单抗隆一抗(兔抗人,1:1 000,货号:5023)、Cytc单抗隆一抗(小鼠抗人,1:1 000,货号:4280T)、caspase 3单抗隆一抗(小鼠抗人,1:1 000,货号:9662)、Cleaved-caspase3单抗隆一抗(兔抗人,1:1 000,货号:9579)、caspase9单抗隆一抗(小鼠抗人,1:1 000,货号:9504)、Cleaved-caspase9单抗隆一抗(兔抗人,1:1 000,货号:9509)、PARP单抗隆一抗(兔抗人,1:1 000,货号:9532)、Cleaved-PARP单抗隆一抗(兔抗人,1:1 000,货号:5625)以及相应二抗均购自美国Cell Signaling Technology公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate delydrogenase,GAPDH)单克隆一抗(小鼠抗人,1:1 000)购自Proteintech(美国蛋白质技术公司,货号:60004)。小干扰RNA干扰siRNA Noxa购自美国Santa Cruze公司(货号:14766S),小干扰RNA干扰siRNA p53购自美国Santa Cruze公司(货号:K0816)。
1.3仪器 酶标仪(瑞士TECAN公司,型号:A5082);流式细胞分析仪(美国Beckman Coulter公司,型号:CytoFLEX);二氧化碳(CO2)培养箱(美国Thermo公司,型号:Model 3111);凝胶成像仪(美国Bio-Rad公司,型号:ChemiDocTM XRS+)。
1.4细胞及培养 人肝癌细胞系Bel-7402和HepG2来自湖北医药学院附属人民医院中药药理实验室。细胞以含10%胎牛血清的RPMI-1640培养基培养于37 ℃、5%CO2环境中。
1.5MTT检测 参照文献检测α-常春藤皂苷对HCC的体外抑制作用[12],将HCC细胞分别与0(对照组,Control组)、10、15、20和30 μmol·L-1α-常春藤皂苷共培养0、24和48 h。5 mg·mL-1MTT染色,酶标仪于波长490 nm处读取吸光度值,计算细胞抑制率。
1.6流式细胞术(flow cytometry,FCM)检测 以Annexin V-FITC/PI染色,并以FCM检测凋亡率[12]。即将Bel-7402和HepG2细胞接种到6孔板,24 h后加入0(对照组,Control组)、10、20、30 μmol·L-1α-常春藤皂苷。按试剂盒说明书进行:Annexin V(1.25%,5 μL)-FITC/PI(20 μg·mL-1,5 μL)于室温下避光染色5 min,流式细胞分析仪上检测凋亡。
1.7转录组学分析 将0(对照组,s0)、10(s10)、20(s20)和30(s30) μmol·L-1α-常春藤皂苷作用于HCC 24 h。收集样品并送上海Bioin生物技术有限公司进行转录组学检测。
1.8RNA干扰 将Bel-7402细胞分为对照组、siRNA干扰空白组(Con siRNA)、siRNA组(p53 siRNA或Noxa siRNA)和siRNA-p53/Noxa+α-hederin组(siRNA-p53+α-hederin 30 μmol·L-1或siRNA-Noxa+α-hederin 30 μmol·L-1)。HCC细胞于对数生长期置于6孔板,CO2培养箱培养24 h。将脂质体3000(lipofectamine 3000,美国Invitrogen公司)加入Opti-MEM培养基稀释,稀释比例1:1。加入细胞转染48~72 h,以蛋白免疫印迹(western blotting,WB)检测蛋白表达变化。
1.9实时荧光定量多聚核苷酸链式反应(real-time quantitative polymerase chain reaction,qRT-PCR) 为检测α-常春藤皂苷及RNA干扰对HCC基因的影响,以qRT-PCR检测mRNA的表达[11](表1)。

表1 qRT-PCR引物序列
1.10WB实验 在α-常春藤皂苷(10、20和30 μmol·L-1),喜树碱(阳性对照,10 μmol·L-1),脂质体-质粒干预HCC细胞24 h前后进行WB实验[11],于凝胶成像仪检测蛋白条带。
1.11蛋白稳定性实验 以放线菌酮(cycloheximide,CHX,50 μg·mL-1)和(或)α-常春藤皂苷作用于Bel-7402及HepG2细胞0(对照组,Control组)、1、2、4、6和8 h[12],WB检测蛋白表达量。
1.12体内移植瘤实验 取生长良好的对数生长期Bel-7402细胞,于裸鼠前肢右侧腋下接种0.2 mL(细胞密度1×106个·mL-1)。造模24 h后每2 d观察瘤体生长情况,约1周后,接种的裸鼠均出现圆形或椭圆形、直径约11 mm皮下质硬结节,即为造模成功。将造模成功的小鼠正常喂养,随机分为模型组(DMSO)和给药组(α-常春藤皂苷10 mg·kg-1),每组5只,腹腔注射给药。小鼠称体质量,检测瘤体大小,观察22 d内裸鼠肿瘤体积变化,给药完毕后处死裸鼠,剥离肿瘤并称质量,瘤体置-80 ℃冰箱备用。
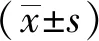
2 结果
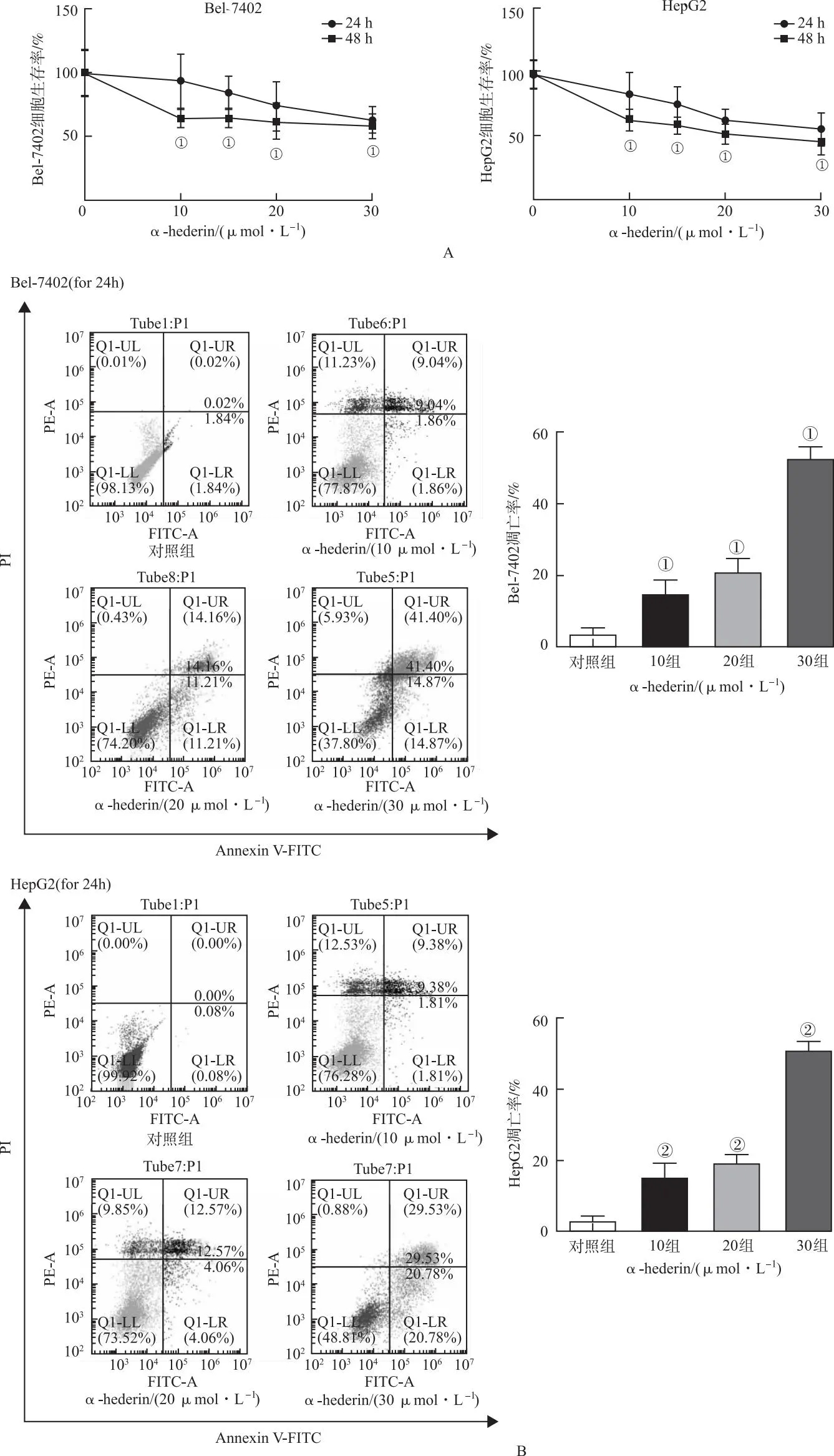
2.1α-常春藤皂苷诱导HCC细胞凋亡 以不同浓度α-常春藤皂苷[0(对照组)、10、15、20和30 μmol·L-1]干预Bel-7402和HepG2细胞24、48 h后,细胞存活率均呈时间和剂量依赖性下降(图1A)。FCM结果显示,HCC细胞呈剂量依赖性凋亡(图1B)。WB结果显示,裂解态凋亡蛋白比例增加,提示α-常春藤皂苷可上调Bel-7402和HepG2细胞中凋亡蛋白PARP、Caspase9和Caspase3活性(图2)。
A.α-常春藤皂苷干预后肝癌细胞生存率曲线;B.流式细胞术检测肝癌细胞的凋亡情况。①与对照组比较,t=1.667~29.33,P<0.05;②与对照组比较,t=-49.06~-11.27,P<0.01。
A.α-常春藤皂苷对Bel-7402中凋亡蛋白的影响;B.α-常春藤皂苷对HepG2中凋亡蛋白的影响。CPT为阳性对照。①与α-常春藤皂苷浓度为0组比较,t=-0.880 0~0.123 3,P<0.01。
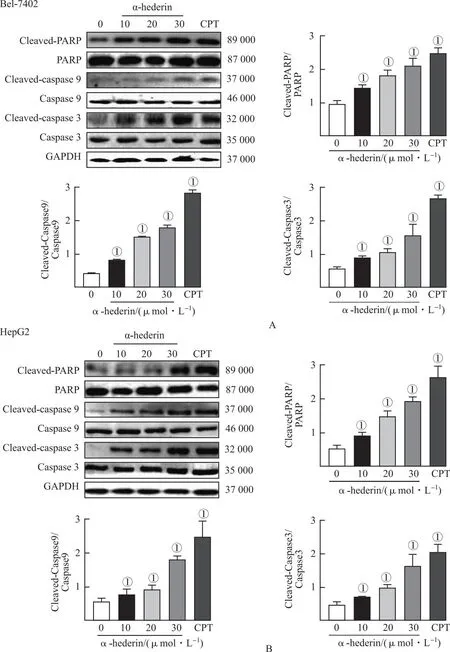
2.2α-常春藤皂苷激活HCC细胞的p53/Noxa通路 见图3。转录组学结果发现,作用于Bel-7402细胞24 h后,α-常春藤皂苷10 μmol·L-1组较对照组(s0组)上调基因365个,下调基因122个;而α-常春藤皂苷20 μmol·L-1组(s20组)和30 μmol·L-1组(s30组)分别上调基因336和2 596个,下调基因155和2 226个(图3A)。
A.α-常春藤皂苷干预Bel-7402细胞差异基因的韦恩图;B、C.α-常春藤皂苷干预Bel-7402细胞差异基因的热图;D.α-常春藤皂苷干预Bel-7402细胞差异基因的信号通路图;E.KEGG分析Noxa与凋亡、p53信号的相关性。s0:空白对照组;s10.α-常春藤皂苷10 μmol·L-1组;s20.α-常春藤皂苷20 μmol·L-1组;s30.α-常春藤皂苷30 μmol·L-1组。
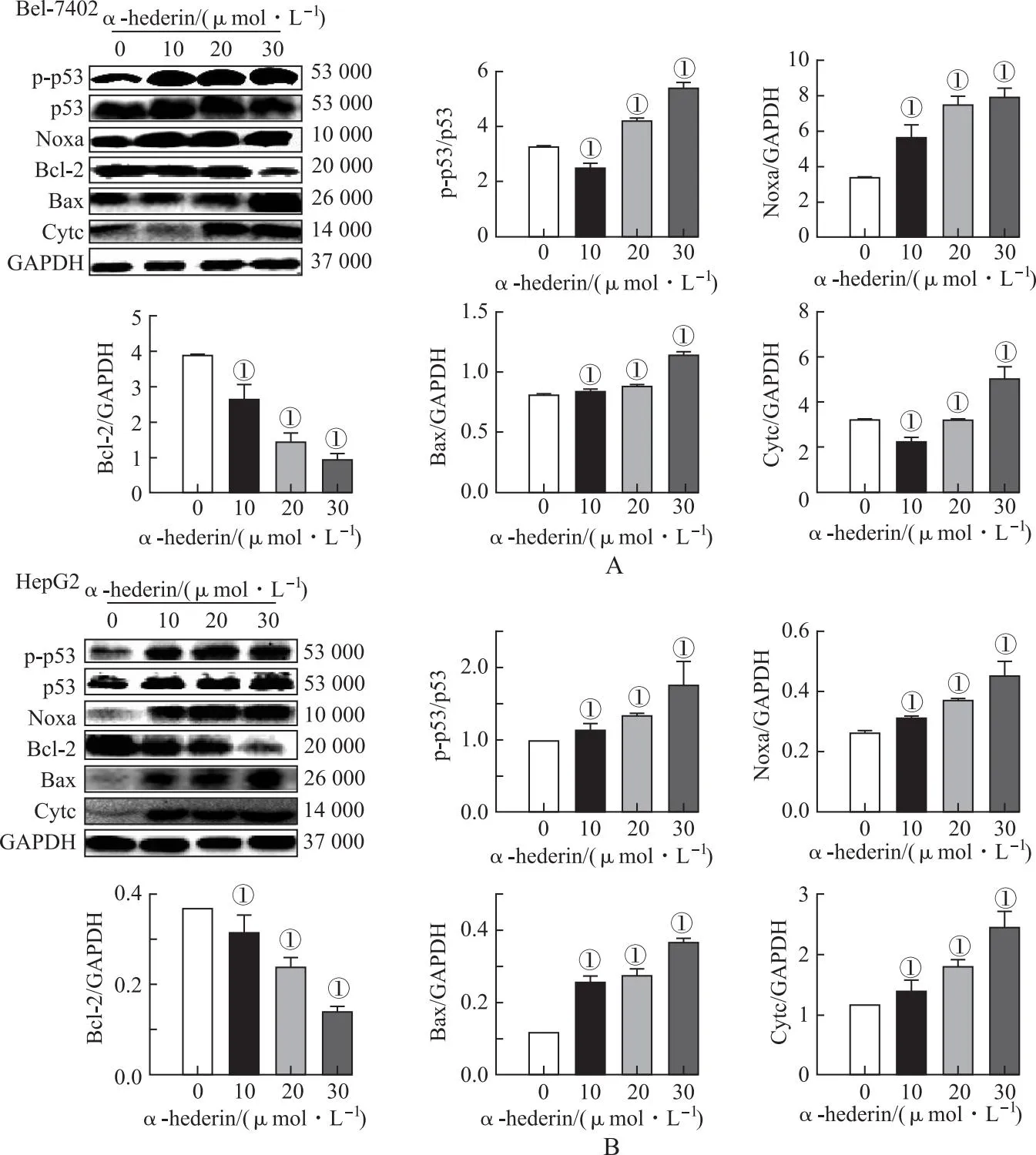
A.α-常春藤皂苷对Bel-7402细胞p53/Noxa通路蛋白表达的影响;B.α-常春藤皂苷对HepG2细胞p53/Noxa通路蛋白表达的影响。①与α-常春藤皂苷浓度为0 μmol·L-1时比较,t=-1.313~0.21,P<0.01。
α-常春藤皂苷30 μmol·L-1组与对照组(Control)热图比较,差异显著(图3B),显示Bax、PMIAP1(Noxa)、Cytc和TP53(p53)表达上调(图3C)。将158个差异基因在京都基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)和基因本体(Gene Ontology,GO)数据库进行功能富集分析,发现p53为重要信号之一(图3D)。α-常春藤皂苷还可上调HCC类固醇/萜类骨架生物合成信号(图3B)。通过癌症基因组图谱(the cancer genome atlas,TCGA)数据库基因集富集分析(gene set enrichment analysis,GSEA)检测发现p53信号与Noxa mRNA水平关系密切,提示与促凋亡正相关(图3E)。WB结果也发现α-常春藤皂苷增加了p-p53、Noxa、Bax和Cytc蛋白的表达,下调了Bcl-2蛋白的表达,与转录组学结果近似,提示α-常春藤皂苷增加了Noxa表达,并可提高p53活性(图4)。
2.3Noxa/p53是α-常春藤皂苷诱导HCC细胞凋亡的重要信号 以siRNA敲低p53和Noxa,siRNA-Noxa可减少Noxa的mRNA和蛋白表达(图5A和5B);siRNA-p53可减少p53的mRNA和蛋白表达(图5C和5D),提示α-常春藤皂苷可激活p53/Noxa信号。α-常春藤皂苷可逆转siRNA-Noxa和siRNA-p53所致的低凋亡率(图6)。
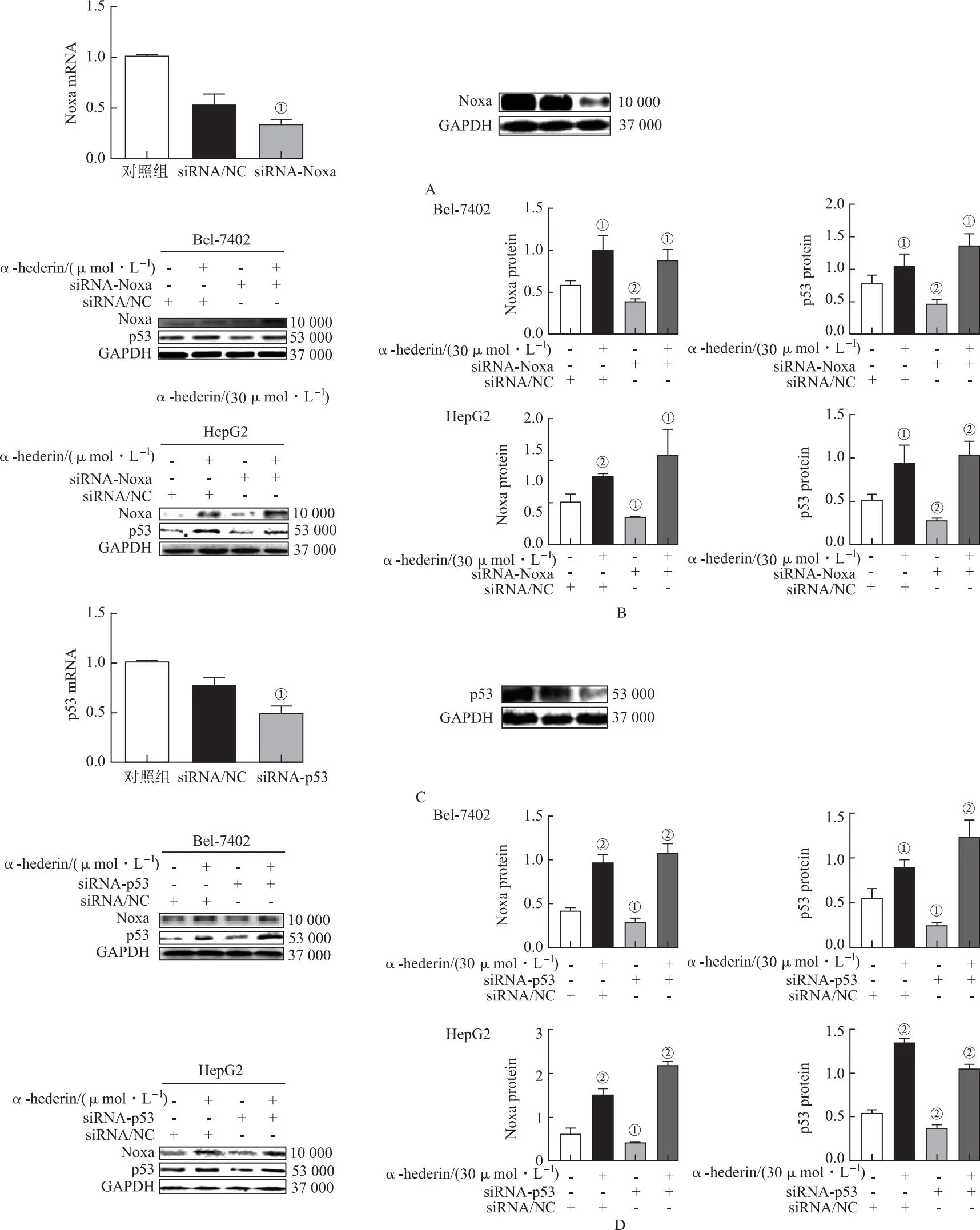
A.Noxa siRNA转染的HCC细胞中Noxa mRNA和蛋白的表达;B.α-常春藤皂苷对Noxa siRNA转染的HCC细胞中p53/Noxa蛋白表达的影响;C.p53 siRNA转染的HCC细胞中Noxa mRNA和蛋白的表达;D.α-常春藤皂苷对p53 siRNA转染的HCC细胞中p53/Noxa蛋白表达的影响。siRNA/NC表示转染空白质粒。①与siRNA/NC比较,t=-0.050 0~0.206 7,P<0.05;②与siRNA/NC比较,t=-1.463~1.237,P<0.01。
2.4α-常春藤皂苷增加HCC细胞中p53/Noxa蛋白稳定性 CHX干预结果提示,p53和Noxa蛋白水平呈时间依赖性下降,给予α-常春藤皂苷后,p53和Noxa蛋白降解延迟(图7)。
2.5α-常春藤皂苷抑制体内移植瘤的生长 与模型组比较,α-常春藤皂苷可抑制肝癌体内移植瘤生长,该结果与体外细胞抑制结果相符(图8)。
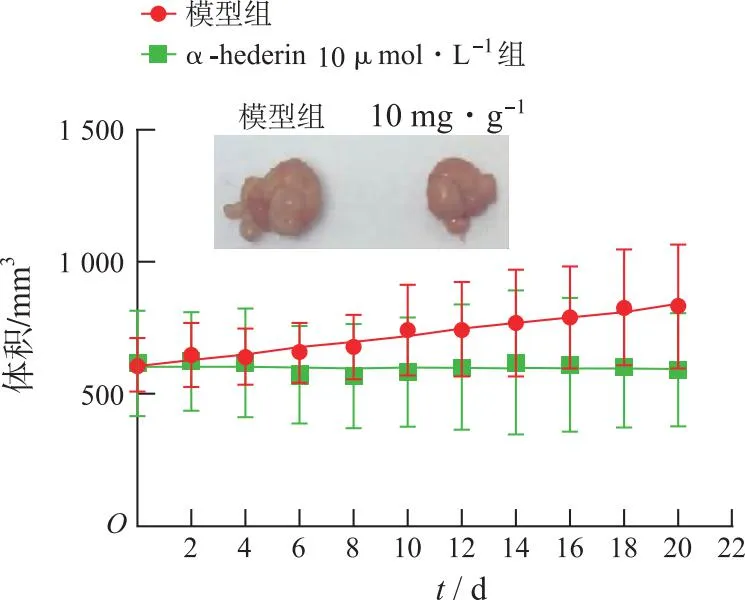
图8 α-常春藤皂苷对肝癌体内移植瘤的抑制作用
3 讨论
HCC是预后差的恶性肿瘤[13-14]。近年来,中药抗肝癌研究日益引起研究者的兴趣[15-16]。α-常春藤皂苷是武当特色中药预知子的活性成分和《中华人民共和国药典》规定的预知子质量标志物,具有抗病毒、抗炎和抗肿瘤作用[17-19]。但α-常春藤皂苷是否通过Bcl-2相关的信号p53/Noxa发挥作用尚不明确。本研究中,α-常春藤皂苷可呈时间和剂量依赖性地降低HCC细胞存活率,增加凋亡级联反应蛋白活化,提示发生了凋亡。
转录组学结果发现,α-常春藤皂苷干预后肝癌细胞Bax/Bcl-2、PMIAP1(Noxa)、Cytc和TP53(p53)表达增加[20]。KEGG分析发现Noxa与p53相关的凋亡信号密切相关。WB和RNA干扰结果也发现,α-常春藤皂苷干预后肝癌细胞p53/Noxa信号激活。由于Noxa属于仅含有BH3的Bcl-2家族蛋白,包括了启动区-155到-174位的p53潜在识别序列[21],本研究通过α-常春藤皂苷诱导肝癌细胞凋亡,进一步证实了激活p53/Noxa与凋亡的关系(图9)[22]。前人文献发现α-常春藤皂苷与人类组织细胞淋巴瘤U973和人急性单细胞性白血病细胞THP-1的膜胆固醇存在相互作用而导致孔隙形成[4]。笔者的研究也发现,α-常春藤皂苷可上调肝癌细胞类固醇/萜类骨架生物合成信号,与前人研究结果近似,值得进一步探讨。
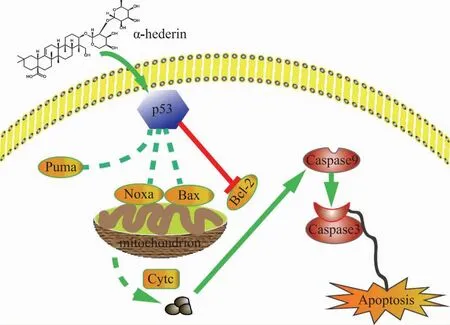
图9 α-常春藤皂苷诱导肝癌细胞凋亡机制示意图
p53激活凋亡通路与其磷酸化[23-24]和转录后泛素化降解程度[25]相关。笔者在本研究中发现,α-常春藤皂苷可上调p53磷酸化蛋白表达,并逆转敲低p53/Noxa信号引起的凋亡减少,且阻碍了p53/Noxa蛋白降解,提示α-常春藤皂苷是通过上调p53/Noxa信号、稳定p53/Noxa蛋白水平[25-27]而发挥诱导凋亡作用。值得注意的是,由图4A结果可见,α-常春藤皂苷干预后,p53总蛋白无变化,但由于磷酸化水平(p-p53)升高,故p-p53/p53比值增加,提示α-常春藤皂苷干预可增加p53活性。但同样给予30 μmol·L-1α-常春藤皂苷,图5与图4相比,p53蛋白总量增高,这可能由于RNA干扰实验中加入了空白质粒(siRNA/NC)的干扰或实验条件改变所致。
此外,p53存在野生型和突变型。野生型主要功能是维持细胞基因组稳定性,负调节细胞生长和诱导凋亡,而突变型则刺激和促进肿瘤发生。在人类肿瘤中,p53突变型至少占50%。在肝癌中,p53外显子7的突变概率是8.4%。超过36%的突变在249位密码子第3碱基[28]。人肝癌细胞系常用于体内外肝细胞癌的研究。本研究中使用的细胞系为Bel-7402[29]和HepG2[30-31],其p53基因均为野生型,因此在本研究中适用。
关于α-常春藤皂苷体外浓度问题,文献报道α-常春藤皂苷对HepG2、SMMC-7721和Huh-7肝癌细胞的半数抑制浓度(IC50)折算成摩尔浓度分别为18.5~103.35、17.72~123.84和21.89 μmol·L-1[5,31],使用CD147抗体和壳聚糖纳米粒(α-Hed-CS-CD147-NPs)可提高抑制率而降低IC50值(对HepG2细胞由103.35 μmol·L-1降至42.19 μmol·L-1;对SMMC-7721细胞由123.84 μmol·L-1降至43.52 μmol·L-1)[31]。另有文献报道,α-常春藤皂苷抑制HepG2和Hcclm3迁移和侵袭的浓度为5 μmol·L-1(非细胞毒性浓度),α-常春藤皂苷体内剂量为5 mg·kg-1[10]。本研究中,笔者发现10~30 μmol·L-1α-常春藤皂苷可诱导肝癌细胞凋亡,体内则为剂量10 mg·kg-1,与文献结果类似。
综上所述,α-常春藤皂苷通过激活和稳定p53/Noxa信号而诱导肝癌细胞凋亡,其机制值得深入探讨(图9)。

