肿瘤相关高血压的血压管理的研究进展
蒋弼瀛 黄佳宇 陈文佳
(哈尔滨医科大学附属第一医院心内科,黑龙江 哈尔滨 150001)
心血管疾病和肿瘤的发病率在全球范围内不断增加。心血管疾病目前是肿瘤患者生存率降低和死亡的第二大原因[1]。近年来,高血压与肿瘤的关系一直是研究的热点。一方面,肿瘤疾病本身及抗肿瘤药会导致高血压;另一方面,众多研究证实高血压及抗高血压药也会增加肿瘤的发生。同样,抗肿瘤治疗相关高血压的血压管理也是一个具有挑战性的临床问题,现主要总结肿瘤与高血压的关系以及抗肿瘤药相关高血压患者的血压管理,为该类患者提供个体化降压治疗方案,以改善患者生活质量和延长生存期。
1 肿瘤可引起高血压的发生
神经内分泌性肿瘤是一种相对罕见且可纠正的高血压病因,手术切除该类肿瘤可使血压恢复正常。嗜铬细胞瘤和副神经节瘤是一种罕见的产生儿茶酚胺的神经内分泌肿瘤,过量的儿茶酚胺会导致与出汗、头痛和心悸相关的继发性高血压,尽管该类肿瘤大多数是良性的,但10%~15%的嗜铬细胞瘤和20%~50%的副神经节瘤也可能是恶性的[2]。原发性醛固酮增多症也是继发性高血压的常见病因,在一项纳入1 125例原发性醛固酮增多症患者的前瞻性研究[3]中,4.8%的新诊断高血压患者发现了醛固酮腺瘤。库欣综合征是一种罕见的由于皮质-肾上腺腺瘤分泌皮质醇增多所产生的多形性临床综合征,极高水平的皮质醇可与盐皮质激素受体结合,导致钠潴留、容量扩张和高血压[4]。神经内分泌肿瘤最具代表性的临床特征是类癌综合征,它主要与胃肠道类癌、支气管类癌以及胰腺类癌有关,很少与肾脏或卵巢类癌有关,其中,高血压危象是类癌综合征的典型特征之一[5]。原发性甲状旁腺功能亢进症通常可归因于甲状旁腺腺瘤或增生导致的自主分泌甲状旁腺激素过多。Schiffl等[6]研究发现,甲状旁腺腺瘤导致的高血压可通过甲状旁腺切除术治愈。
2 抗肿瘤治疗相关高血压
随着不同抗肿瘤药治疗方案的出现,肿瘤患者的生存率不断升高。但随之而来的心脏毒性也越来越明显,大多数研究认为高血压发病风险的增加可能主要与抗肿瘤治疗有关,而非肿瘤本身(表1)。在对25 000多例不同类型肿瘤患者的回顾性分析[7]中,大约1/3的患者在随访期间出现了新发高血压,在所有类型的肿瘤中,抗肿瘤治疗会使高血压发病风险增加2.0~3.5倍。因此,高血压是抗肿瘤药治疗过程中最常见的并发症,抗肿瘤药通过多种途径导致高血压的发生(图1)。
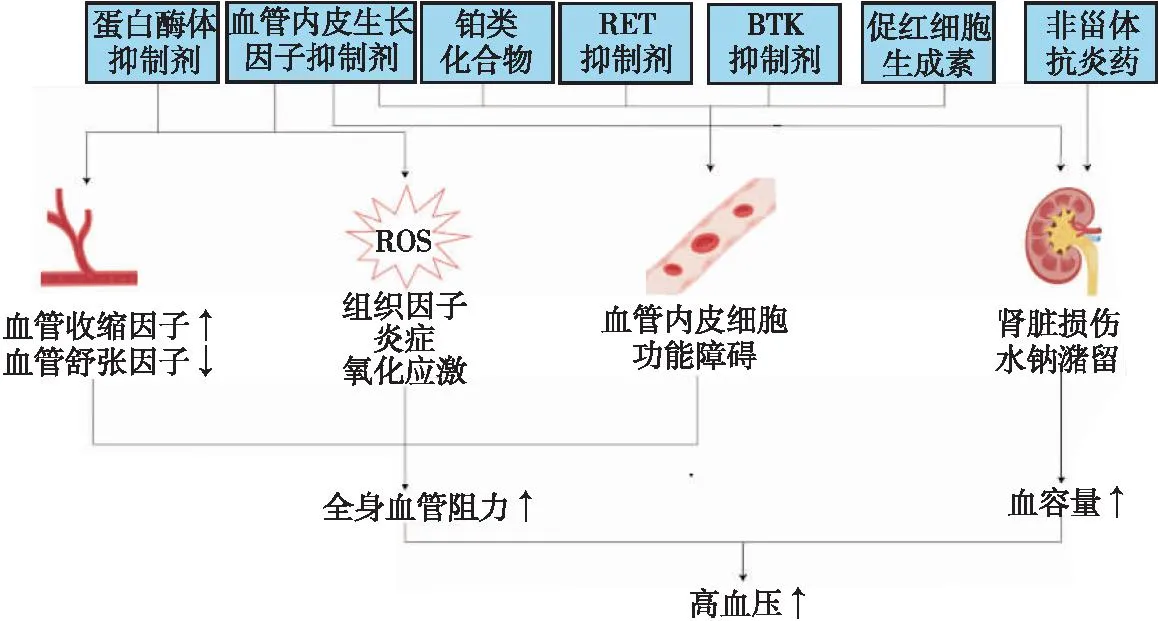
注:RET,受体酪氨酸;BTK,Bruton酪氨酸激酶;ROS,活性氧。图1 各类抗肿瘤药和辅助治疗致高血压的作用机制
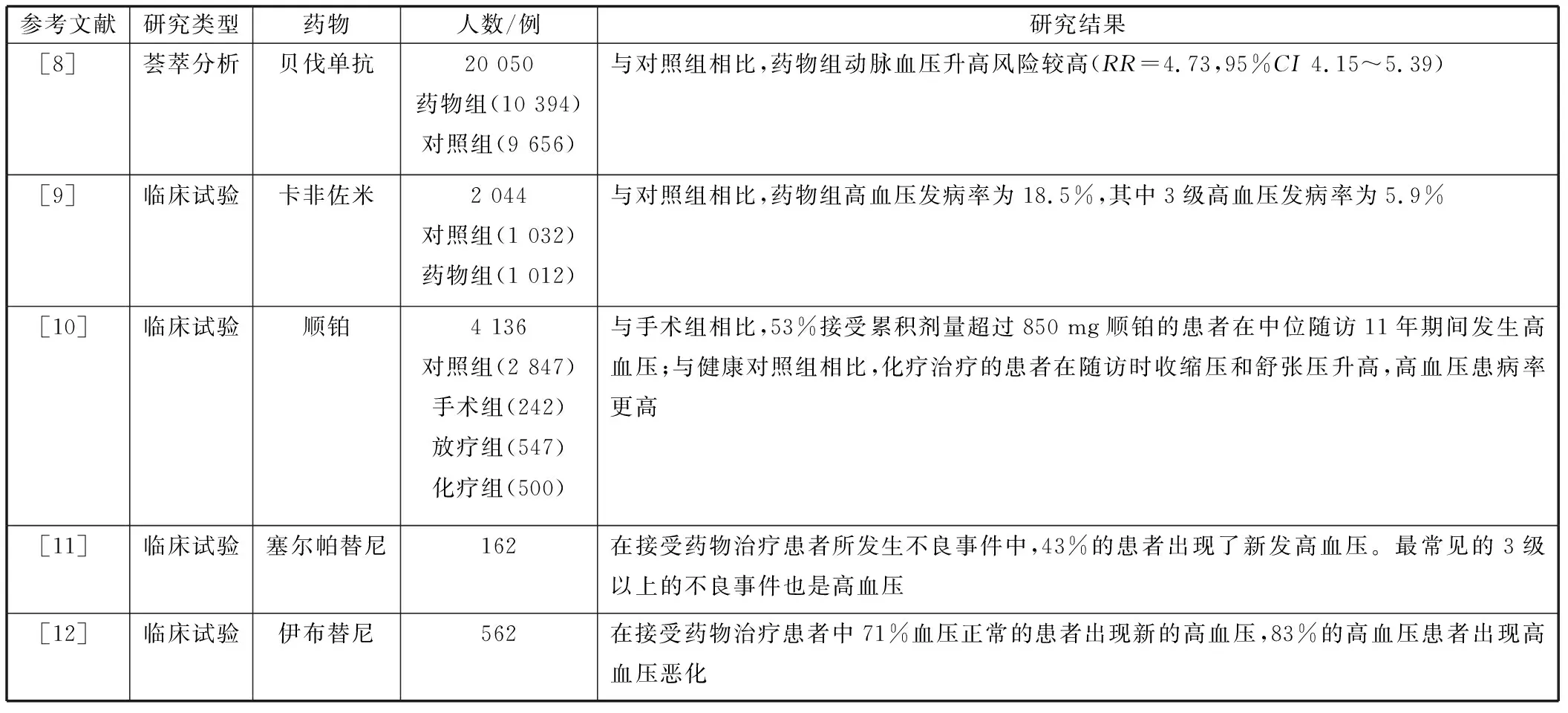
表1 抗肿瘤治疗相关高血压的临床研究
2.1 血管内皮生长因子抑制剂与高血压
在大多数恶性肿瘤患者中,血管内皮生长因子(vascular endothelial growth factor,VEGF)抑制剂是最常用的抗肿瘤药。一项纳入约20 000例不同肿瘤类型患者的荟萃分析[8]结果显示,服用高剂量贝伐单抗方案的患者发生更多的心血管不良事件,多以显著的血压升高为主,在所有类型的肿瘤中高血压的风险都有所增加,其中乳腺癌的相对风险最高。目前认为VEGF抑制剂主要通过导致血管收缩因子内皮素-1增加,而血管舒张因子(NO)减少而引起血压升高。此外还会同时引起氧化应激、微血管稀薄、肾损伤和淋巴管生成减少等,这些都会造成血压升高[13]。
2.2 蛋白酶体抑制剂与高血压
蛋白酶体抑制剂通过破坏蛋白酶体的活性诱导肿瘤细胞死亡,作为靶向化疗药物可显著提高多发性骨髓瘤患者的生存率。然而,蛋白酶体抑制剂在治疗肿瘤的同时也会增加高血压的患病风险。在一项分析评估2 000多例使用卡非佐米的多发性骨髓瘤患者心血管不良事件发生率的临床试验[9]中,接受卡非佐米治疗的患者高血压发生率显著升高,其中3级高血压发生率为5.9%。有研究[14]认为蛋白酶体功能受损可增加细胞内氧化应激,并且影响血管舒张,这可能是蛋白酶体抑制剂导致高血压的原因。
2.3 铂类化合物与高血压
铂类化合物(顺铂、卡铂和奥沙利铂)广泛用于睾丸癌、卵巢癌、结直肠癌、膀胱癌、肺癌以及间皮瘤的治疗。一项纳入1 289例单侧睾丸癌患者的研究[10]中,与其他治疗方式的患者和健康组相比,在5~20年后,使用顺铂为基础化疗治疗的治愈患者高血压患病率显著升高。但目前对于铂类化合物与高血压的大多数相关研究主要局限于治疗数年后,而尚无在应用铂类抗肿瘤治疗期间或在治疗不久后对血压的影响的研究。尽管针对铂类化合物致高血压机制的研究[15]多是在体外观察,更需在临床研究中进行验证,但这些机制都可能与内皮功能障碍相关,从而导致高血压。
2.4 其他抗肿瘤药与高血压
在甲状腺癌症和非小细胞肺癌中发现了受体酪氨酸(receptor tyrosine,RET)的突变,这是一种潜在的治疗靶点。在一项对162例RET异常甲状腺癌患者应用RET抑制剂治疗的研究[11]中,43%的患者出现了新发高血压。Bruton酪氨酸激酶(Bruton’s tyrosine kinase,BTK)抑制剂用于各种B细胞恶性肿瘤,在一项包括562例接受BTK抑制剂治疗的患者的研究[12]中,71%血压正常的患者出现新发高血压,83%的高血压患者出现高血压恶化。但这两类抑制剂导致高血压的潜在机制还有待进一步研究。目前已有多种抗肿瘤药应用于临床,但其他类型抗肿瘤药是否会导致高血压的发生尚未被研究,因此,针对不同肿瘤类型及不同抗肿瘤药的致高血压作用仍需大量的临床研究。
2.5 抗肿瘤辅助药物与高血压
抗肿瘤的一些辅助药物治疗主要有皮质类固醇、促红细胞生成素(erythropoietin,EPO)、非甾体抗炎药、钙调磷酸酶抑制剂等,这些辅助药物与抗肿瘤药同时使用时,可促进高血压的发展或加重已控制的高血压。临床上EPO可用于肿瘤化疗导致贫血的治疗,研究证明EPO受体在血管内皮细胞和平滑肌细胞上表达,因此应用期间可导致血管收缩引起血压升高[16]。非甾体抗炎药临床上可用于癌痛等的治疗,其可通过引起水钠潴留、导致肾损伤和降低前列腺素水平而引起血压升高[17]。因此,当这些药物用于抗肿瘤治疗方案时,需特别注意是否可与导致血压升高的抗肿瘤药联合使用,并定期监测血压。
3 抗肿瘤治疗相关高血压的管理
3.1 抗肿瘤治疗相关高血压的分级
不同于原发性高血压的分级,目前抗肿瘤治疗相关高血压分级主要依据美国国家癌症研究所提出的常见不良事件评价标准5.0版本[18],高血压的分级诊断标准分别为:1级高血压指收缩压(systolic blood pressure,SBP)为120~139 mm Hg(1 mm Hg=0.133 3 kPa)或舒张压(diastolic blood pressure,DBP)为80~90 mm Hg。2级高血压指(1)SBP为140~159 mm Hg或DBP为90~99 mm Hg(治疗前血压正常);(2)反复或持续(≥24 h)症状性DBP升高>20 mm Hg或血压>140/90 mm Hg;(3)需单药治疗。3级高血压指SBP≥160 mm Hg或DBP≥100 mm Hg以及需多种药物联合或强化降压治疗。4级高血压指血压升高已威胁生命(如恶性高血压、一过性或持久性神经功能受损、高血压危象),需紧急治疗。5级高血压指血压升高导致死亡。
3.2 抗肿瘤治疗相关高血压的降压靶值
越来越多的肿瘤患者在治疗过程中出现心血管事件特别是血压升高,这也促进了一些心脏肿瘤学立场的声明和指南的发展。《中国高血压防治指南(2018年修订版)》[19]指出,抗肿瘤药本身或该药物与其他药物之间发生相互作用而引起血压升高,当血压>140/90 mm Hg时即考虑药物性高血压。原则上,一旦确诊高血压与用药有关,应尽量停用这类药物或启动抗高血压药治疗。2010年美国国家癌症研究所关于VEGF抑制剂治疗患者血压的初始评估、监测和管理提出建议[20],在开始抗肿瘤治疗之前,所有患者都应进行全面的心血管健康评估,应用VEGF抑制剂的患者起始降压阈值为140/90 mm Hg,并且在抗肿瘤治疗开始前应努力达到这一血压目标。对于高血压合并糖尿病和/或慢性肾脏病的患者,目前的公共卫生指南建议目标血压应低于130/80 mm Hg。同样,2016年《加拿大心血管学会癌症治疗心血管并发症评价和管理指南》[21]提出,对于已有高血压的患者或肿瘤治疗相关高血压患者,开始、维持或强化降压治疗至关重要。所有患者目标血压均应小于140/90 mm Hg,糖尿病患者应小于130/80 mm Hg。2016年欧洲心脏病学会[22]提出如果启动抗高血压药治疗后血压未得到控制,可考虑调整降压治疗方案或停用抗肿瘤药。一旦血压得到控制,就可重新开始使用抗肿瘤药,以达到最大的抗肿瘤效果。
3.3 抗肿瘤治疗相关高血压的抗高血压药选择
对于存在其他心血管危险因素的血压正常的肿瘤患者,或使用心脏毒性化疗药物治疗使血压升高,但不超过140/90 mm Hg且无额外心血管危险因素的患者,可进行生活方式干预,尤其是限制钠盐的摄入[23]。目前对于抗肿瘤治疗相关高血压的常用抗高血压药包括血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、钙通道阻滞剂(calcium channel blocker,CCB)、利尿剂和β受体阻滞剂,此外也有证据[24]表明硝酸酯类药物也可用于降压治疗。虽然有人担心使用ACEI等药物理论上降低血压的同时会抵消VEGF抑制剂的抗肿瘤作用,但在临床实践中尚未观察到这一点,因此建议对肿瘤合并高血压患者进行降压治疗[23]。
ACEI通常作为抗肿瘤治疗相关高血压的首选,特别是合并有心力衰竭或蛋白尿的患者。在一项纳入303例接受舒尼替尼或帕佐帕尼治疗的转移性肾细胞癌患者的研究[25]中,应用ACEI治疗肿瘤相关高血压可提高患者的生存率。事实上,蛋白尿是VEGF抑制剂一种相对常见的不良反应,ACEI可显著改善VEGF抑制剂引起的结构性或功能性血管稀疏,以及肾小球滤过率下降和肾脏水钠潴留增加。CCB由于能促进多种肿瘤细胞的凋亡、抑制增殖和防止侵袭转移,也常作为治疗肿瘤相关高血压的一线选择[26]。二氢吡啶类CCB如氨氯地平,可降低血管中动脉平滑肌细胞的收缩能力,并且可有效地抵消VEGF抑制剂导致的NO生成减少。但应避免应用非二氢吡啶类CCB,因为非二氢吡啶类CCB如地尔硫或维拉帕米,可加速代谢VEGF抑制剂,导致血浆中VEGF水平的潜在升高[27]。同样,也有研究[28]证明,二氢吡啶类CCB在治疗与顺铂等烷化剂相关的高血压中最为有效。对于抗肿瘤治疗相关高血压患者,噻嗪类利尿剂的单一治疗往往不足以达到最佳的血压控制。一项观察应用抗肿瘤药而出现高血压的患者应用抗高血压药的回顾性队列研究[29]发现,虽然噻嗪类利尿剂是最常用的初始药物,但患者往往需额外的抗高血压药治疗。并且VEGF抑制剂可产生严重的腹泻和潜在的脱水风险,同时利尿剂又有消耗电解质和出现QT间期延长的风险,因此建议谨慎使用利尿剂,不应将其作为一线治疗。目前关于β受体阻滞剂治疗肿瘤相关高血压的临床研究较少,有研究[30]证明,在肿瘤和免疫细胞上可检测到β肾上腺素能受体,β受体阻滞剂可能通过改变肿瘤微环境来对抗疾病的进展和转移,对肿瘤患者发挥保护作用。此外有研究认为硝酸酯类药物可通过产生NO而使血管舒张,并在肿瘤相关高血压中发挥较强的降压作用。有病例报告[31]报道了使用硝酸异山梨酯成功治疗VEGF抑制剂诱发的难治性高血压,但对于抗肿瘤治疗中加入口服硝酸盐是否会影响其抗肿瘤效果,有待于进一步研究。从理论上讲,硝酸盐可通过增加NO的释放来逆转VEGF抑制剂导致的NO信号通路的抑制,但考虑到其他选择的可能性,应避免这类特殊的抗高血压药与抗肿瘤药长期服用。
3.4 抗肿瘤治疗相关高血压的随访
在积极接受抗肿瘤药治疗的患者中,血压升高可能在几小时或几天内发生,也可能需1年的时间才会发现。因此,在高血压的诊断和管理过程中,诊室血压测量、家庭血压监测和24小时动态血压监测是常选用的3种方式。目前建议在第一个抗肿瘤治疗周期或第一期治疗期间,家庭血压监测为首选方式。自我评估血压监测可有效控制血压或降低血压,常见的家庭血压监测评估方式应基于早晚分别测量2次血压(至少间隔1 min进行的2次测量),至少7 d的监测期。对于每个监测期,应获取所有SBP和DBP读数的平均值以评估血压。如果血压保持在正常范围内,在整个治疗期间监测的频率可降低到每周1~3次[32]。动态血压监测可提供24 h的平均血压值,评估24 h内血压变异性,且稳定性和重复性均较高。使用24小时动态血压监测可早期发现未控制的高血压,一项前瞻性研究[33]对使用舒尼替尼治疗第一个周期的患者进行24小时动态血压监测,发现动态血压监测可提高晚期肾癌患者高血压诊断的准确性,从而协助患者尽早开始启动降压治疗或调整抗高血压药的联合应用,并有效预防了抗肿瘤治疗相关高血压导致的一系列急性并发症,同时也防止抗肿瘤治疗的不必要中断。研究[34]表明,在肿瘤患者中,白大衣高血压和隐匿性高血压的患病率可能更高。白大衣高血压患病率的增加被认为是与肿瘤诊断相关的高度焦虑和对预后的恐惧。隐蔽性高血压患病率增加的原因可能是抗肿瘤治疗的不良反应延迟。因此,在肿瘤患者的管理中纳入动态血压监测和家庭血压监测至关重要。
4 总结与展望
高血压和肿瘤之间有着密切的关系。随着新的抗肿瘤治疗方案的快速发展,为对抗肿瘤的生长和扩散,并延长患者的寿命,迫切需解决影响抗肿瘤治疗成功相关的合并症(如高血压)。已有大量的研究表明肿瘤本身及抗肿瘤治疗药物会不同程度地增加患者发生高血压的风险。因此,对潜在的肿瘤和非肿瘤合并症的管理必须齐头并进。目前,关于肿瘤患者的降压治疗在降低心血管风险方面的益处还缺乏相关的证据,未来需肿瘤科医生和心内科医生共同努力,通过跨学科合作来确定肿瘤患者最佳的血压控制目标,正确管理血压。