基于1,4-双(2-甲基-1H-咪唑-1-基)苯的2 例d10 金属配合物的合成、结构和性能研究
王仕友,王玉娜,邵娅婷,谢惠定,马钰璐
(昆明医科大学 药学院暨天然药物药理重点实验室,云南 昆明 650500)
配合物(CPs)作为一种多孔功能材料,因其具有永久孔隙率、高比表面积、丰富结构、独特发光性、吸附性、导电性、磁性等特点受到研究人员的广泛关注[1-5].其中基于d10过渡金属的CPs 因荧光性质良好,已作为潜在的发光材料对金属阳离子[6]、无机阴离子[7]、有机小分子[8]、药物分子[9]等表现出迷人的荧光传感性能.然而构建具有特定特征和可预测结构的CPs 仍然十分困难,有机配体、金属盐、溶剂、物质比例、pH 值、温度等影响因素都会对最终产物造成影响[8].作为CPs 的重要组成部分,金属中心由于具有多种配位数及配位模式,对CPs结构的多样化至关重要.因此,有必要研究金属中心与CPs 结构之间的相关性,以探讨CPs 的自组装规律.
众多有机配体中,咪唑类配体已被广泛用于CPs 的构筑.咪唑环N 原子的孤对电子使其易与各类金属中心配位[10],同时也可促成π···π 相互作用的形成,在提高CPs 成功构建可能性的同时,增加体系的共轭程度,以便提高材料的发光性能[11].其中刚性咪唑类配体由于自身结构难以自由旋转,能在一定程度上防止CPs 结构的塌陷.但由于其空间位阻大,构型变化小,难以由其单独构筑结构多样的CPs.引入配位模式多变的多羧酸类辅助配体,将其与咪唑类配体结合已被证明是构建结构丰富且功能多样的CPs 的有效方法[12].
本文采用含2 个咪唑环的刚性配体1,4-双(2-甲基-1H-咪唑-1-基)苯 (bmib) 及二羧酸配体2,5-噻吩二羧酸(H2tdc)为混合配体,与d10过渡金属离子Zn2+和Cd2+在溶剂热条件下合成得到2 个新型配合物[Zn(bmib)(HCOO)2]·3H2O(1)和[Cd(bmib)0.5(tdc)(DMF)(H2O)](2).通过X 射线单晶衍射、粉末衍射、元素分析、热失重分析、红外光谱等对配合物结构进行了表征,并对它们的固体荧光性质进行了研究.配体bmib 和H2tdc 结构见图1.
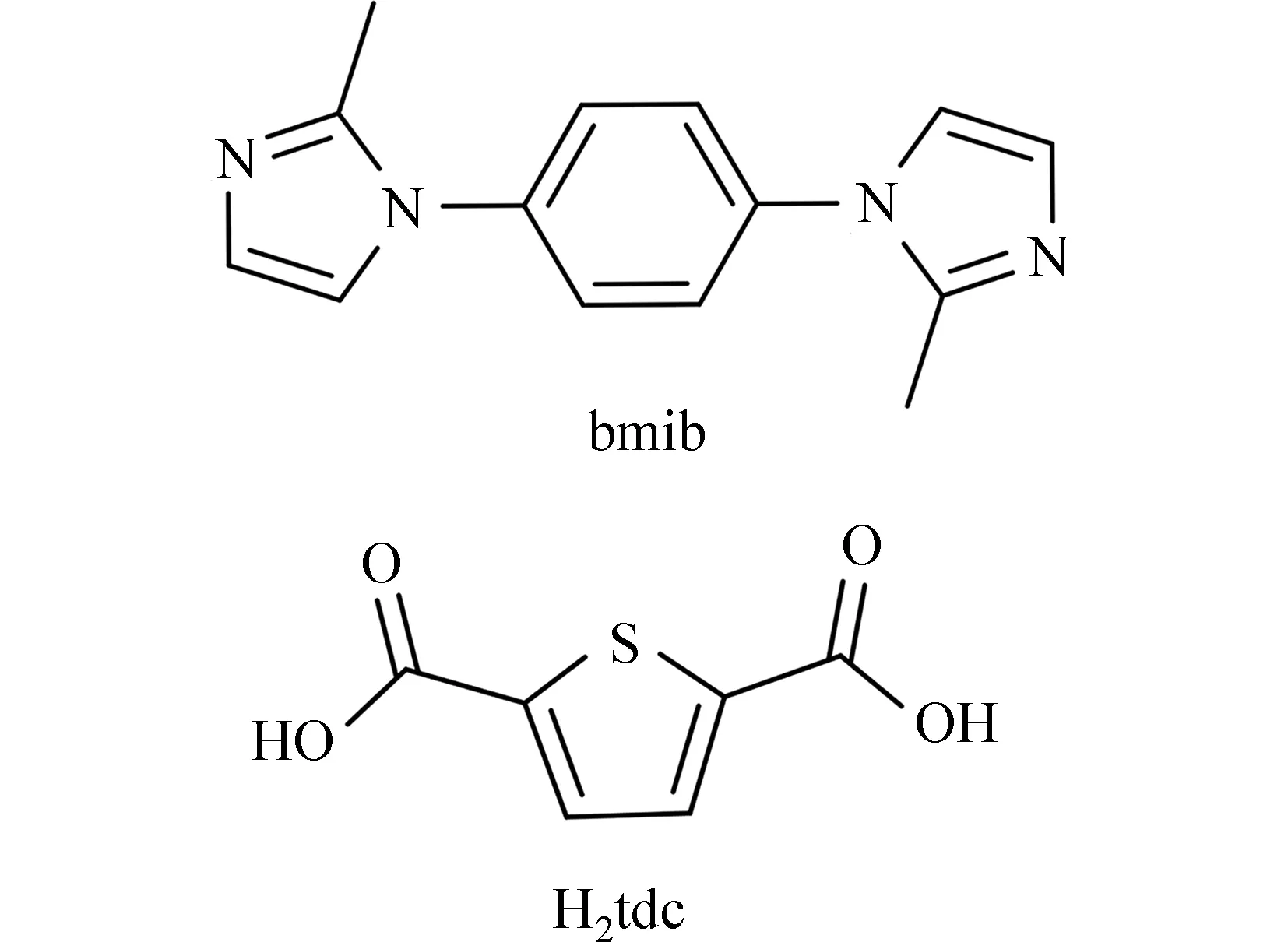
图1 配体bmib 和H2tdc 结构图Fig.1 Structure of ligand bmib and H2tdc
1 实验部分
1.1 试剂及仪器ZnSO4·7H2O、Cd(ClO4)2·6H2O、1,4-双(2-甲基-1H-咪唑-1-基)苯(bmib)、N,N 二甲基甲酰胺(DMF)、2,5-噻吩二羧酸(H2tdc)均为市售分析纯试剂,未经纯化直接使用.Bruker APEX-Ⅱ X-单晶衍射仪用于收集单晶数据;粉末衍射结果由RigakuRU200 粉末衍射仪测试得到;STA449F31热失重分析仪用于收集热失重数据;荧光光谱通过Hitachi FL-7000 型荧光仪得到;C、H 和N 的元素分析在Elementar Vario ELⅢ型元素分析仪上确定;红外光谱数据利用NICOLET-IS10 型红外光谱仪获得.
1.2 配合物[Zn(bmib)(HCOO)2]·3H2O (1)的 合成称取ZnSO4·7H2O(0.02 mmol)溶于DMF/水(1.5 mL,体积比1∶1)溶剂中,室温搅拌5 min 后加入配体bmib(0.02 mmol)和H2tdc(0.02 mmol),超声反应10 min.得到的混合液密封放于加热炉中,在100 ℃的条件下晶化48 h,自然冷却至室温后得到无色块状晶体.以DMF/水(体积比1∶1)混合液洗涤晶体,自然干燥,得到配合物1,产率:31.5%(基于配体bmib).元素分析(w/%,C16H22N4O7Zn),理论计算值:C 42.92%,H 4.95%,N 12.51%;实测值:C 41.87%,H 5.03%,N 12.26%.IR(KBr 压片,cm-1)ν:3 411.56(m),3 112.26(s),2 828.49(s),1 608.89(vs),1 518.17(vs),1 423.66(vs),1 365.86(vs),1 321.18(vs),1 175.66(s),1 149.66(s),1 012.22(s),851.93(s),773.67(s),675.29(m),619.16(w),568.04(w).
1.3 配合物[Cd(bmib)0.5(tdc)(DMF)(H2O)](2)的合成配合物2 的合成条件与1 基本一致,只是将金属盐替换为Cd(ClO4)2·6H2O.配合物2 产物为无色块状晶体,产率:37.7%(基于配体bmib).元素分析(w/%,C16H18CdN3O6S),理论计算值:C 39.00%,H 3.68%,N 8.53%;实验值:C 37.98%,H 3.77%,N 8.34%.IR(KBr 压片,cm-1)ν:3 372.09(s),1 651.00(vs),1 563.72(vs),1 523.98(vs),1 385.40(vs),1 154.66(m),1 106.37(s),1 008.49(m),852.21(m),821.10(m),781.72(s),666.03(m),629.99(w),600.08(w),568.93(s).
1.4 晶体的结构测定选取大小适宜的单晶,利用Bruker APEX-Ⅱ型X 射线单晶衍射仪,以MoKα(λ=0.071 073 nm)为辐射源,采取ω/2θ变速扫描的方式收集衍射数据.经吸收校正和还原后,采用Olex2 1.3 软件中的SHELXT-2018/3 及SHELXL-2018/3 程序对晶体结构进行解析及精修,非氢原子坐标采用全矩阵最小二乘法进行各项异性修正,氢原子通过理论加氢法获得.配合物1 中无序排列的游离溶剂分子采用SQUEEZE 命令予以去除,其具体分子式结合单晶结构解析、热重和元素分析结果予以确定.配合物的晶体学数据及结构解析方法如表1 所示,主要的键长键角列于表2.配合物1和2 的CCDC 号分别为2259264 和2259265.

表1 配合物1 和2 的晶体学数据和精修参数Tab.1 Crystallographic data and refinement results for complex 1 and 2

表2 配合物 1 和2 的部分键长和键角Tab.2 Selected bond lengths and angles for complex 1 and 2
2 结果与讨论
2.1 配合物的晶体结构[Zn(bmib)(HCOO)2]·3H2O(1):X 射线单晶衍射结果表明配合物1结晶为三斜晶系,Pī空间群.其每个不对称结构单元包含1 个Zn2+离子、1 个bmib 配体和2 个来自于分解DMF的HCOO-阴离子[图2(a)].3 个晶格水分子在结构中无序排列,难以固定,只能利用SQUEEZE 命令予以去除,其具体个数结合热重及元素分析结果确定.Zn2+金属中心以变形四面体构型与来自于2 个不同bmib 配体的2 个N 原子(N1 和N2),以及来自于2 个HCOO-的2 个O 原子(O1 和O3)配位,形成[ZnN2O2]基本单元.Zn—O 的键长为0.194(5)和0.194(8) nm,Zn—N 的键长则分别为0.202(1)和0.203(9) nm.在该配合物中,刚性的bmib 配体连接2 个[ZnO2N2]基本单元形成“Z”字形一维链,其中相邻Zn···Zn 间以1.359(8)、1.366(8) nm 及1.962(1)nm 的距离存在,与同一个Zn2+中心相连的2 个bmib 配体间成99.59(14)°夹角[图2(b)].如图2(c)所示,平行排列的一维链间通过bmib 配体苯环与咪唑环间丰富的π···π 相互作用扩展为二维层状结构[质心-质心间的距离为0.455(7) nm].层与层间又通过咪唑环与HCOO-间的C—H···O 氢键相互作用组装得到配合物1的三维超分子结构,具体氢键如表3 所示.

表3 配合物1 和2 氢键的键长和键角Tab.3 The hydrogen bond lengths and bond angles of complex 1 and 2

图2 配合物1 结构图Fig.2 The structure of the complex 1
[Cd(bmib)0.5(tdc)(DMF)(H2O)] (2):配合物2结晶于三斜晶系Pī空间群.如配位环境图[图3(a)]所示,配合物2的每个不对称结构单元中包括1 个独立的Cd2+阳离子、0.5 个bmib 配体、1 个完全去质子化的tdc2-阴离子、1 个配位DMF 分子以及1个配位水分子.Cd2+中心采取六配位的模式,与来bmib 配体的氮原子N2,2 个不同tdc2-配体的3 个氧原子O1、O3A、O4A,DMF 中的氧原子O5 以及配位水中的氧原子O6 配位,形成1 个变形八面体几何构型的[CdNO5]基本单元.其中Cd—O 键的键长在0.218(1)~0.261(4) nm 范围内,Cd—N 的键长为0.224(2) nm.在该配合物中tdc2-配体的2 个羧基分别采取双齿螯合μ1-η1η1以及单齿桥连μ1-η1的方式连接相邻[CdNO5]基本单元形成沿b轴延伸的直链,Cd···Cd 间的距离为1.044(2) nm.同时相邻2 条链间的金属中心又由bmib 配体连接(Cd···Cd 间的距离为1.403(2) nm),构成配合物2的一维梯形链状结构[图3(b)].如图3(c)所示,一维链上tdc2-羧酸根及DMF 中的O 原子作为受体,分别与相邻一维链bmib 配体咪唑环及苯环中的C—H 相互作用形成C—H···O 氢键,并在氢键的作用下扩展为二维层.而后,如图3(d)所示,二维层间又通过噻吩环间的π···π 相互作用自组装成三维超分子结构[质心-质心之间的距离为0.363(6) nm].

图3 配合物2 结构图Fig.3 The structure of the complex 2
通过晶体结构解析可以看出,虽然配合物1和2的合成条件除了金属盐不同外其余基本一致,但2 个配合物的晶体结构却有着明显的差异.当金属盐采用Zn2+盐时得到配合物1,其在合成时虽然也加入了H2tdc 配体,但最终H2tdc 配体并未参与配位,且DMF 受热分解,分解后的HCOO-阴离子与金属中心Zn2+单齿桥连.配合物1主体结构为bmib 配体与[ZnO2N2]基本单元连接形成的“Z”字形一维链.当金属盐替换为Cd2+盐时得到配合物2,在该配合物中2 个配体bmib 和H2tdc 均参与了配位,且DMF 以完整的溶剂分子形式与中心金属相连.配合物2的主体结构为由bmib 配体连接2 条平行双链(由tdc2-与[CdNO5]组成)后构成的一维梯形链.对比后发现,合成条件一致时,金属盐的不同可能会导致配合物结构的不同,因此配合物的合成中金属盐的合理选择值得关注.
2.2 粉末衍射和热失重分析为检验配合物的纯度,室温下对宏量合成的配合物1和2进行了X 射线粉末衍射(PXRD)测试.结果如图4 所示,配合物1和2的实测衍射峰位置与理论模拟的峰位置匹配度较好,且未出现杂峰,表明合成的配合物1和2均是单晶结构所代表的物质,且纯度较高,可进行性质测试.为进一步研究配合物1和2的热稳定性,在N2保护下对它们分别进行了热失重分析(TGA)测试,热重曲线如图5 所示.配合物1有3个阶段的失重过程,70~130 ℃发生首次重量损失,对应于3 个游离水分子的失去(w,实验值:12.8%,理论计算值:12.1%);150~245 ℃发生第二次失重,可归因于配位甲酸根离子的失去(w,实验值:20.0%,理论计算值:20.1%);350 ℃以后,出现急剧失重现象,配合物骨架迅速坍塌分解;660 ℃后曲线趋于稳定,剩余ZnO 和配体碳化物.配合物2有两个阶段的失重过程,第一段失重发生在125~250 ℃,可归因于配位水分子和配位DMF 的失去(w,实验值:18.1%,理论计算值:18.5%);318 ℃后,急剧失重,配合物开始分解,直至800 ℃失重仍在持续,最终剩余CdO 和配体碳化物.

图4 配合物1 和2 的X 射线粉末衍射图Fig.4 The powder X-ray diffraction patterns of complex 1 and 2

图5 配合物1 和2 的热失重曲线Fig.5 The TGA curves of complex 1 and 2
2.3 固体荧光分析考虑到d10金属的CPs 具有良好的荧光性质,可成为潜在的发光材料,因此我们对配体bmib、H2tdc、配合物1和2室温下的固体荧光进行了研究.结果如图6 所示,配体bmib 在波长为270 nm 的激发光作用下,在315 nm 处有明显的荧光发射峰;配体H2tdc 在330 nm 的激发光下,在390 nm 处有最强荧光发射,但荧光强度较弱.2 个配体的荧光发射峰均可归因于配体内部的π*-n 或π*-π 电子跃迁[6].配合物1在365 nm 激发光的作用下,在460 nm 处有较强荧光发射,峰型与bmib 相似,荧光强度增强,但发生了明显红移.配合物2在370 nm 的激发光作用下,在470 nm 左右出现最强荧光发射.与配体的发射光谱对比,配合物2的荧光是由配体bmib 与H2tdc 共同作用引起的,其荧光强度也有所增强,且同样发生了明显的红移.由于d10的Zn2+或Cd2+金属离子较难被氧化或还原,其荧光发射峰的红移可归因于配体内或配体间的电荷转移跃迁[13].

图6 配体bmib(a),H2tdc(b),配合物1 (c)和2 (d)的室温固体荧光谱图Fig.6 The fluorescent spectra of bmib(a),H2tdc (b) and complex 1(c) and 2(d) in solid-state at room temperature
3 结论
以含咪唑环刚性bmib 为主配体,结合H2tdc,采用溶剂热法合成了2 例新型d10金属配合物:[Zn(bmib)(HCOO)2]·3H2O(1)和[Cd(bmib)0.5(tdc)(DMF)(H2O)](2).除采用的金属盐不同外,其他合成条件均相同,但2 例配合物的结构却存在明显差异.单晶结构解析表明,配合物1和2均结晶于三斜晶系的Pī空间群,但配合物1中H2tdc 并未与金属中心配位,其主体结构为bmib 配体与四配位的Zn2+连接形成的“Z”字形一维链.配合物2中金属中心Cd2+采取六配位的模式,同时与bmib 和H2tdc 配体配位,最终构成一维的梯形链.由此可见金属离子对配合物结构的重要性.热重分析表明2 例配合物具有较好的热稳定性.固体荧光分析表明2 例配合物的荧光主要来自于有机配体,均为潜在发光材料.

