雷公藤红素-氨基葡萄糖酰胺偶联物的合成及其减毒调脂作用
毕 晨,游清徽
江西师范大学生命科学学院,江西 南昌 330022
雷公藤TripterygiumwilfordiiHook. f.是一种传统中药,拥有悠久的药用历史。现有研究明确指出,雷公藤具有多种药理作用,包括抗肿瘤、抗炎、抗肥胖、治疗自身免疫疾病和糖尿病等功能。此外,雷公藤还显示出神经保护、预防心血管和代谢相关疾病的效果[1-5]。雷公藤红素(celastrol,Cel)是从雷公藤植物根部提取得到的一种五环三萜类化合物,具有抗炎和抗肿瘤等良好效果[6-8]。近年来的相关研究发现,Cel 还参与机体脂质代谢的调控,并具有一定的减肥效果。刘伯宇等[9]研究发现,Cel通过提高瘦素敏感性,对于高脂饮食诱导的肥胖(diet-induced obesity,DIO)小鼠可以降低其食欲并明显减轻其体质量。然而,对于缺乏瘦素及瘦素受体的小鼠,并未观察到明显的减肥效果。另外,研究显示Cel 可以通过下调转录因子过氧化物酶体增殖物激活受体γ2(peroxisome proliferators-activated receptors,PPARγ2)和CCAAT 增强子结合蛋白α(CCAAT enhancer binding protein,C/EBPα)的表达,降低早期脂肪基因的表达,并有效抑制小鼠胚胎呈纤维细胞(3T3-swiss albino,3T3-L1)向脂肪细胞的终末分化[10]。尽管Cel 具有显著的药理活性,但其对肝脏、肾脏、心脑血管等也存在强烈的不良反应,并具有较差的水溶性,从而限制了其在临床中的应用[11]。
近年来,偶联药物技术的发展使得Cel 的临床应用成为可能。为了解决Cel 本身理化性质限制以及随剂量增加而引发的药物毒性等问题,研究人员已经开发了多种药物制剂,如纳米递药系统[12-13]、聚合物胶[14]、聚合物前药[15]、脂质体[16-17]等被研发出来以提高Cel 的生物利用度。然而,Cel 相关制剂目前仍处于研发阶段,并未有产品上市。
用于聚合物-药物偶联物的材料需要具备无毒、低免疫反应以及良好的水溶性等特点,例如N-(2-羟丙基)甲基丙烯酰胺[18]、聚乙二醇以及部分多糖聚合物(如壳聚糖、葡聚糖、透明质酸等)均为常用药物辅料。葡聚糖阿霉素前药是第1 个进入临床试验阶段的葡聚糖偶联药物,但后续研究证明其具有一定的肝毒性、会引起血小板减少等不良症状[19]。聚谷氨酸是一种人工合成的聚合物具有低免疫反应和无毒性等特点,但也存在制备成本高昂,无法普及的问题。氨基葡萄糖(glucosamine,GlcN)是一种含有氨基的己糖,具有改善软骨关节代谢、抗菌、抗氧化、抗炎和保肝的作用。现有临床试验证明,氨基葡萄糖没有急性毒性、亚急性毒性和遗传毒性方面的问题,其盐酸盐形式被美国国家食品营养协会(National Nutritional Foods Association,NNFA)批准为膳食补充剂[20]。
本实验研发了一种Cel-GlcN 酰胺偶联物,合成工艺见图1,并从理化性质、药物毒性和抗脂效果等方面评价该复合物。研究结果显示,该复合物的水溶性、药物毒性和氧化应激水平等方面均优于原始药物Cel。
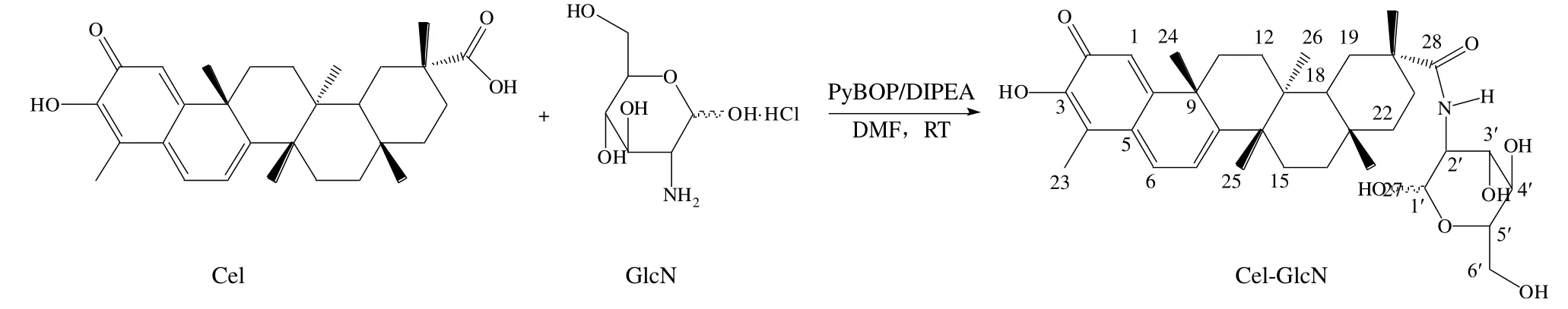
图1 Cel-GlcN 的合成工艺Fig. 1 Cel-GlcN synthesis process
1 仪器与材料
1.1 仪器
CKX 53 型倒置光学显微镜,日本Olympus 公司;MCO-15AC 型二氧化碳细胞培养箱,日本Sanyo公司;Agilent-API4500 型液质联用仪,美国AB Sciex 公司;FW-4A 型粉末压片机,天津市拓普仪器有限公司;Spectra Max M5 型酶标仪,美国Molecular Devices 公司;Nicolet iN10 MX 型傅里叶变换红外光谱仪,美国Thermo Nicolet 公司。
1.2 材料与试剂
DMEM 细胞培养基、胰蛋白酶、胎牛血清、非必需氨基酸、胎牛血清蛋白、油酸、棕榈酸均购自北京索莱宝科技有限公司;GlcN 购自上海源叶生物科技有限公司;乙腈购自Sigma-Aldrich 西格玛奥德里奇(上海)贸易有限公司;Cel 购自成都普思生物科技股份有限公司;N,N-乙基二异丙胺(N,Ndiisopropylethylamine,DIPEA)、二氯甲烷、1H-苯并三唑-1-基氧三吡咯烷基鏻六氟磷酸盐(benzotriazol-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate,PyBOP)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride,EDC·HCl]、N-羟基苯并三氮唑(1-hydroxybenzotriazole,HOBt)均购自Adamas 上海泰坦科技股份有限公司;HepG2 细胞系购自美森细胞生物科技有限公司;总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)试剂盒、2,2-联喹啉-4,4-二甲酸二钠(bicinchonininc acid,BCA)试剂盒均购自上海生工生物工程有限公司。
1.3 细胞培养
将人肝癌HepG2 细胞(美森细胞生物科技有限公司)置于含有15%胎牛血清、1%青霉素和链霉素的高糖DMEM 培养基,于37 ℃、5% CO2培养箱中培养。
2 方法与结果
2.1 Cel-GlcN 的合成与表征
2.1.1 基于DMF 体系Cel-GlcN 的合成 在常温条件下,将Cel(100 mg、0.22 mmol)、PyBOP(57 mg、0.11 mmol)溶解于5 mL DMF(99.5%)溶剂中,随后将反应液置于冰水混合物中冷却30 min。在搅拌的条件下,缓慢滴入DIPEA(71 mg、0.55 mmol)至反应溶液中,待反应溶液恢复至室温后逐滴加入氨基葡萄糖溶液(92 mg、0.44 mol/L),持续搅拌48 h 直至反应完全。然后收集反应液,使用二氯甲烷和饱和食盐水萃取3 次(15 mL×3),有机层用无水硫酸钠干燥。在40 ℃下减压旋蒸完全后,通过硅胶柱色谱进行纯化(洗脱剂为二氯甲烷-甲醇12∶1)。最终得到棕红色固体粉末82.3 mg(61.4%)。收集所得样品后,通过LC-MS 确定其相对分子质量,使用1H-NMR、13C-NMR 对其结构进行鉴定,并通过压片法对产物进行傅里叶红外光谱(FTIR)表征。
2.1.2 基于二氯甲烷体系Cel-GlcN 的合成 在氮气氛围下,将HOBt(42.4 mg、0.22 mmol)和EDC·HCl(63 mg、0.33 mmol)加入到溶解有Cel(100 mg、0.22 mmol)的二氯甲烷溶液中,并在0 ℃的条件下搅拌15 min,待反应溶液恢复至室温后逐滴加入氨基葡萄糖溶液(92 mg、0.44 mol/L),搅拌过夜至反应完全。收集反应液,直接加入饱和食盐水洗涤3 次(15 mL×3),有机层用无水硫酸钠干燥,40 ℃下减压旋蒸完全后,通过硅胶柱色谱进行纯化(洗脱剂为二氯甲烷-甲醇14∶1)。最终得到棕红色固体粉末60.4 mg(40.5%),其表征方式与“2.1.1”项一致。
2.1.3 FTIR分析 FTIR参数:光谱范围4 000~500 cm-1;分辨率0.5 cm-1;扫描次数64;信噪比50 000∶1。Cel-GlcN 是由Cel 的羧基与GlcN 的氨基之间形成酰胺键而合成(如图1 所示),通过FTIR(图2)对酰胺键进行了验证,在Cel-GlcN 的FTIR 谱图中,1 647 cm-1处的吸收峰对应酰胺I 谱带C=O 的伸缩振动,1 586 cm-1处的强吸收则对应酰胺II 谱带中N-H 的弯曲振动,同时,在Cel-GlcN 中观察到Cel中由C=O 在1 702 cm-1处的伸缩振动吸收峰消失,表明酰胺键的成功引入。
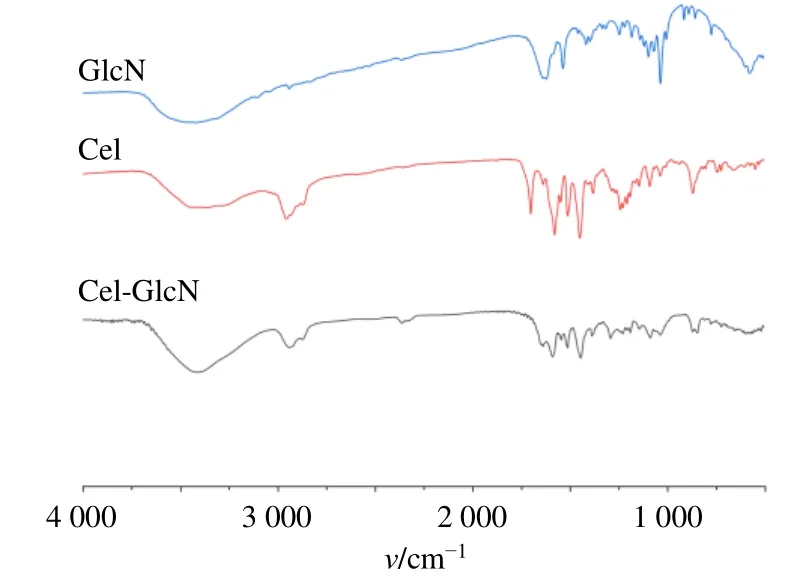
图2 Cel-GlcN 的红外光谱图Fig. 2 Infrared spectra of Cel-GlcN
2.1.4 LC-MS 检测分析
(1)色谱条件:色谱柱为Agilent Zorbax SB-C18为(250 mm×4.6 mm,5 μm);流动相为乙腈-水;柱温25 ℃;进样量20 μL;体积流量1 mL/min;检测波长200~600 nm。洗脱条件:0~18 min,30%~100%乙腈;18~28 min,100%乙腈;28~30 min,100%~30%乙腈。
(2)质谱条件:电喷雾离子源(ESI),扫描方式为负离子模式;喷嘴电压4 kV;鞘气温度250 ℃;鞘气体积流量8 L/min;干燥气体积流量6 L/min;干燥器温度250 ℃;锥孔电压100 V;扫描范围m/z100~1 700。
通过LC-MS 梯度分析结果(图3、4),观察到无论是DMF 还是二氯甲烷体系中均有目标产物Cel-GlcN 的液相峰,对比分析可知,在二氯甲烷体系中不光有目标产物,同时还生成了2 种副产物(tR分别为23.891、24.916 min),其相对分子质量与目标产物Cel-GlcN 不符,Cel(tR=21.848 min)具有较小的极性,只在纯有机相乙腈洗脱后被紫外检测器检测到。GlcN 因其结构上具有多个羟基,表现出良好的水溶性和较大的极性。在Cel 与GlcN 共价结合生成Cel-GlcN(tR=12.819 min)后,结合物的分子极性增加,水溶性得到改善,峰出现时间也提前。同时,在对目标峰Cel-GlcN(tR=12.819 min)进行质谱分析时(图5),初步判断其相对分子质量约为611(可能含有奇数氮化合物),基本与Cel(Mr=450)和GlcN(Mr=179)共价结合后去除1 个水分子后的相对分子质量相符,因而本实验在后续的实验中选择使用高产率的DMF 溶剂作为反应体系。

图4 基于二氯甲烷体系的Cel-GlcN 经LC-MS 分析的液相色谱图Fig. 4 LC-MS LC chromatogram of Cel-GlcN based on dichloromethane system
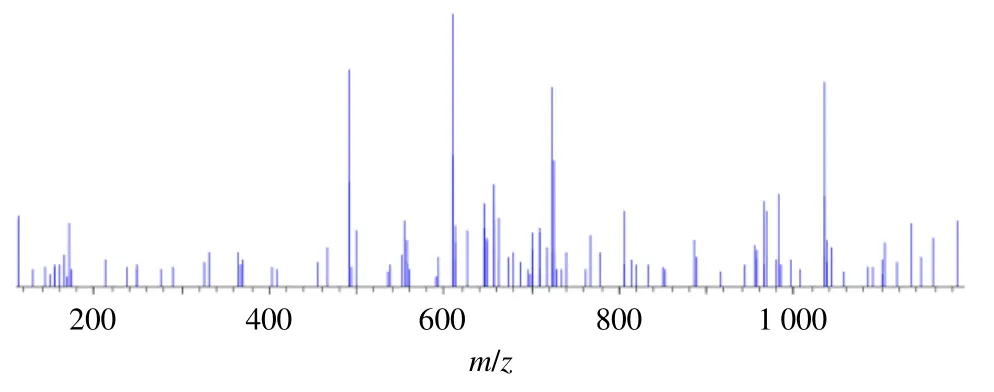
图5 Cel-GlcN 经LC-MS 分析的质谱图Fig. 5 Mass spectra of Cel-GlcN analyzed by LC-MS
2.1.51H-NMR、13C-NMR 检测
(1)氢谱参数:温度298.0 K;谱宽10 000 Hz;脉冲宽度11.11 μs;弛豫时间2 s;采样点数65 536;采样时间3 s;扫描次数16。
(2)碳谱参数:温度296.2 K;谱宽22 045.7 Hz;脉冲时间16 μs;采样时间3.65 s;弛豫时间2.0 s;采样数据点65 536;扫描次数50。
1H-NMR (400 MHz, MeOD)δ: 7.20 (2H, s), 6.49(2H, d,J= 10.2 Hz), 6.45~6.41 (1H, m), 3.79~3.69(7H, m), 3.69~3.64 (2H, m), 3.48 (1H, d,J= 6.6 Hz),3.31 (3H, s), 2.47 (2H, d,J= 15.4 Hz), 2.21 (2H, s),2.19 (6H, s), 2.15 (3H, s), 1.93~1.80 (7H, m), 1.74(7H, dt,J= 15.6, 7.5 Hz), 1.50 (7H, d,J= 14.0 Hz),1.42 (5H, s), 1.35 (4H, dd,J= 7.2, 3.7 Hz), 1.27 (9H,d,J= 6.2 Hz), 1.19 (6H, s), 1.13 (7H, s), 0.96 (3H, d,J= 15.3 Hz), 0.72 (5H, s)。
13C-NMR (100 MHz, MeOD)δ: 181.14 (C-29),180.03 (C-2), 172.56 (C-8), 166.42 (C-10), 147.75(C-3), 136.55 (C-6), 128.49 (C-5), 120.61 (C-4),119.98 (C-7), 119.61 (C-1), 92.36 (C-1′), 73.08 (C-3′),72.64 (C-4′), 72.52 (C-5′), 62.79 (C-6′), 56.11 (C-2′),46.27 (C-14), 45.83 (C-18), 44.30 (C-9), 41.53 (C-13),40.77 (C-20), 38.87 (C-24), 37.61 (C-22), 36.08(C-16), 34.73 (C-11), 34.39 (C-25), 32.07 (C-27),32.00 (C-19), 31.71 (C-15), 30.94 (C-17), 30.47(C-12), 29.75 (C-21), 22.27 (C-29), 19.69 (C-26),10.37 (C-23)。
ESI-HRMS: 分子式(C35H49NO8-),m/z610.937 6,出峰时间12.819 min,检测波长425 nm。Cel-GlcN质量分数95.46%。
2.2 水溶性及稳定性测试
精密称取3 mg 经DMF 体系合成纯化后的Cel-GlcN,溶于1 mL 去离子水中,在室温下进行漩涡震荡5 min,然后超声2 min 使其充分溶解。最后,在14 000 r/min、4 ℃下冷冻离心(离心半径5 cm)10 min,取上清液,并使用紫外分光光度计读取其在425 nm 处的吸光度(A)值。将10 mg 的Cel-GlcN分别置于50 mL 的PBS(pH 7.4)、DMEM 细胞培养基(10% FBS)、模拟胃液(SGF,0.32%胃蛋白酶,pH 1.2)和模拟肠液(SIF,1%胰酶,pH 7.5)中,以37 ℃孵育24 h。之后,在1、2、4、8、12、24 h 分别取200 μL 溶液,经醋酸乙酯萃取后进HPLC 定量分析[色谱条件:流动相为乙腈-超纯水(90∶10);使用Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm);体积流量为1.0 mL/min;温度为25 ℃;检测波长为425 nm]。
根据425 nm 处的A值数据,相比于Cel 微弱的水溶性(1.23 μg/mL),Cel-GlcN 在水中的溶解度极大地改善,达到了226 μg/mL。
如图6 所示,Cel-GlcN 在PBS 水溶液(pH 7.4)中常温保存24 h,只检测到极少量的Cel(5.5%),这表明合成的Cel-GlcN 是一个高度稳定的化合物。而在DMEM 细胞培养基、模拟胃液(SGF,pH 1.2)及SIF(pH 7.5)中常温保存24 h,检测到Cel 在SGF、SIF、DMEM 细胞培养基中的质量分数分别为23.5%、35.7%、51.1%,其水解程度均有所提高,这表明Cel-GlcN 的酰胺键可以被其中的蛋白酶或者肽酶催化水解。此外,在SGF 条件下GEL 的释放趋近于稳定,而在DMEM 细胞培养基中,12 h内释放了大量的游离Cel(48.3%),且在随后的12 h内呈缓慢上升的趋势。这表明Cel-GlcN 在DMEM细胞培养基中的释放效率更高,可能与其中胎牛血清中所含复杂的蛋白质相关。另外,在SGF 的酸性条件下,Cel-GlcN 的释放效率较低。考虑到实际情况下,药物在胃液中的转运时间约为3 h,此时间段释放的微量Cel 对药物转运并没有实际意义,说明Cel-GlcN 很可能在肠道运输中被摄取吸收,并部分转运至毛细血管。

图6 Cel-GlcN 在PBS、SGF (pH 1.2)、SIF (pH 7.5)、DMEM(10% FBS) 培养基中孵育时Cel 累积释放率随时间变化的控释曲线Fig. 6 Controlled-release curve of Cel cumulative release rate over time of Cel-GlcN incubated in PBS, SGF (pH 1.2),SIF (pH 7.5), DMEM (10% FBS) medium
2.3 Cel-GlcN 细胞毒性评价
2.3.1 细胞培养 将HepG2 细胞置于含有15%胎牛血清、1%青霉素和链霉素的高糖DMEM 培养基,37 ℃、5% CO2浓度的培养箱中传代培养,保持细胞处于对数生长期。
2.3.2 MTT 检测细胞毒性 将对数生长期的HepG2 细胞经胰蛋白酶消化后,以1×105个/mL 的密度接种于96 孔板中,每孔体积为100 μL。在37 ℃、5% CO2浓度的培养箱中孵育24 h。待细胞贴壁后,分别加入0.125、0.250、0.500、1.000、2.000、4.000、8.000 μmol/L 的Cel 和Cel-GlcN,并设置对照组(仅含有细胞及培养基)和空白组(无细胞)。每组设置4 个复孔。继续培养48 h 后,每孔加入100 μL MTT 溶液(终质量浓度为0.5 mg/mL)。在培养箱中孵育4 h 后,弃去上清液,并加入150 μL DMSO进行着色。振荡10 min 后,使用酶标仪在490 nm处读取每孔的A值。随后,按以下公式计算细胞存活率。
细胞存活率=(A实验-A空白)/(A对照-A空白)
以HepG2 细胞评估了Cel 和Cel-GlcN 的体外细胞毒性。结果(表2)显示,培养至24 h 时,Cel和Cel-GlcN 的IC50值分别为(1.68±0.37)μmol/L和(2.75±0.11)μmol/L;而培养至48 h,它们的IC50值分别为(0.96±0.23)μmol/L 和(1.82±0.56)μmol/L。与原始药物Cel 相比,偶联物Cel-GlcN 对HepG2 细胞的毒性明显较弱。当载药量质量浓度相同时,偶联药物Cel-GlcN 在相同时间对HepG2 细胞活力的抑制均低于Cel。这可能是由于偶联药物中的酰胺键在培养基中逐渐断裂,缓慢释放出游离的Cel,从而减轻药物的不良反应。

表2 Cel 及Cel-GlcN 在24、48 h 内的体外细胞存活率Table 2 In vitro cell viability of Cel and Cel-GlcN within 24 h and 48 h
2.3.3 高血脂细胞模型建立与检测 根据文献报道的方法[21],制备游离脂肪酸(free fatty acids,FFA)。按以下条件制备FFA,精密称取适量的油酸和棕榈酸,按照2∶1 的比例溶解在1 mol/L KOH 溶液中,并在室温下搅拌过夜。缓慢滴入含有10% BSA 蛋白的PBS 溶液中,并调节pH 值至7.4。经过0.22 μm滤膜滤过后,得到含有10% BSA 蛋白的20 倍母液(FFA-BSA 8∶1,所有实验组的BSA 蛋白质量分数均控制在0.5%)。使用0.8 mmol/L 浓度的FFA 诱导细胞体外脂肪变性24 h,以建立非酒精性脂肪肝(nonalcoholic fatty liver,NAFLD)细胞模型。将细胞分为模型组、对照组以及实验组(分为Cel 和Cel-GlcN 处理组)。经过药物处理48 h 后,弃去细胞上清液,使用PBS 洗涤2 次,然后用200 μL RIPA裂解液破碎细胞。待裂解完全后,取100 μL 裂解液转移至新的EP 管中,使用TC、TG 试剂盒检测细胞中的TC 和TG 含量。剩余的细胞裂解液使用BCA试剂盒进行蛋白定量。
肝脏中脂肪的积聚是导致NAFLD 的一个重要因素,与多种疾病有关。0.6 mmol/L 的FFA 成功诱导了体外高脂细胞模型(如表3 所示)。与对照组相比较,在24 h 内,模型组的TG 含量增加了220%(P<0.001),TC 含量增加了280%(P<0.001),二者差异显著,这预示着高血脂模型的成功建立。在对模型组细胞使用不同浓度的Cel 和Cel-GlcN 处理后,实验组的TC 和TG 含量均有不同程度的减少。1 μmol/L 的Cel 在处理FFA 诱导的高脂模型时,相对于模型组,TG 水平显著降低(P<0.05),但TC含量与模型组没有明显差异。随着Cel 浓度增加,TG 和TC 的含量显著下降(P<0.05、0.01)。因此,本实验确定2 μmol/L 的Cel 为最低调脂药物浓度。
表3 不同浓度Cel 和Cel-GlcN 干预FFA-HepG2 细胞后TC、TG 含量变化 (±s, n = 4)Table 3 Changes of TC and TG contents of FFA-HepG2 cells after different concentrations of Cel intervention(±s, n = 4)

表3 不同浓度Cel 和Cel-GlcN 干预FFA-HepG2 细胞后TC、TG 含量变化 (±s, n = 4)Table 3 Changes of TC and TG contents of FFA-HepG2 cells after different concentrations of Cel intervention(±s, n = 4)
与对照组比较:###P<0.001;与FFA 组比较:*P<0.05 **P<0.01。###P < 0.001 vs control group; *P < 0.05 **P < 0.01 vs FFA group.
药物 浓度/(μmol·L-1)TG/(μmol·μg-1 protein)TC/(mmol·g-1 protein)对照 - 0.756±0.061 0.061±0.009 FFA - 1.553±0.045### 0.145±0.004###FFA+Cel 1 1.451±0.036* 0.138±0.008 2 1.252±0.055** 0.126±0.005*4 1.216±0.085** 0.113±0.002**FFA+Cel-GlcN 1 1.511±0.087 0.141±0.006 2 1.336±0.050** 0.133±0.004*4 1.296±0.075** 0.118±0.003**
根据表3 可以得知,1 μmol/L 的Cel-GlcN 对模型组细胞的血脂水平下降并不显著,但2、4 μmol/L浓度的Cel-GlcN 干预后,总体TG 和TC 水平呈现较小范围的梯度下降,呈现浓度相关性。这也预示着与Cel 相比,Cel-GlcN 在24 h 内对高脂细胞模型组血脂水平的降低程度较低,极可能是由于游离的Cel 没有完全释放,需要更持续的发挥Cel-GlcN 的缓慢释放效果。
2.3.4 细胞内脂滴形态观测 经药物处理后的细胞弃去培养液,经PBS 洗涤2 次后使用4%多聚甲醛固定30 min。除去多聚甲醛后,使用PBS 再次清洗细胞。每孔加入0.5 mL 油红工作液(油红溶于异丙醇制备0.5%的储备液,与蒸馏水以6∶4 的比例混匀后滤过至液体澄清),染色30 min。用60%异丙醇清洗至无明显浮沫后快速晾干。倒置显微镜下观察细胞形态。相比于对照组,高脂模型组的HepG2细胞形态发生了明显的变化,由图7 可知,经FFA处理后的模型组细胞内出现大量的脂滴,且整个细胞形态有变圆的趋势,团聚现象也更加明显,在经过Cel 和Cel-GlcN 进行药物干预后,细胞脂滴逐渐减小,红色区域面积也与Cel-GlcN 的浓度呈剂量依赖性减少,表明Cel、Cel-GlcN 可有效减少细胞内脂滴数量,降低脂肪的沉积程度,同时,随着浓度的增大,细胞表面的脂滴大小及面积也呈现梯度的减少,具有剂量相关性。Cel 或Cel-GlcN 在1、2 μmol/L 的浓度下,Cel 与Cel-GlcN 对于细胞脂滴形态、红色脂滴面积的改善效果并不明显,但随着浓度达到4 μmol/L 时,可观察到Cel 对红色脂滴面积的改善作用更加明显,团聚现象减弱。
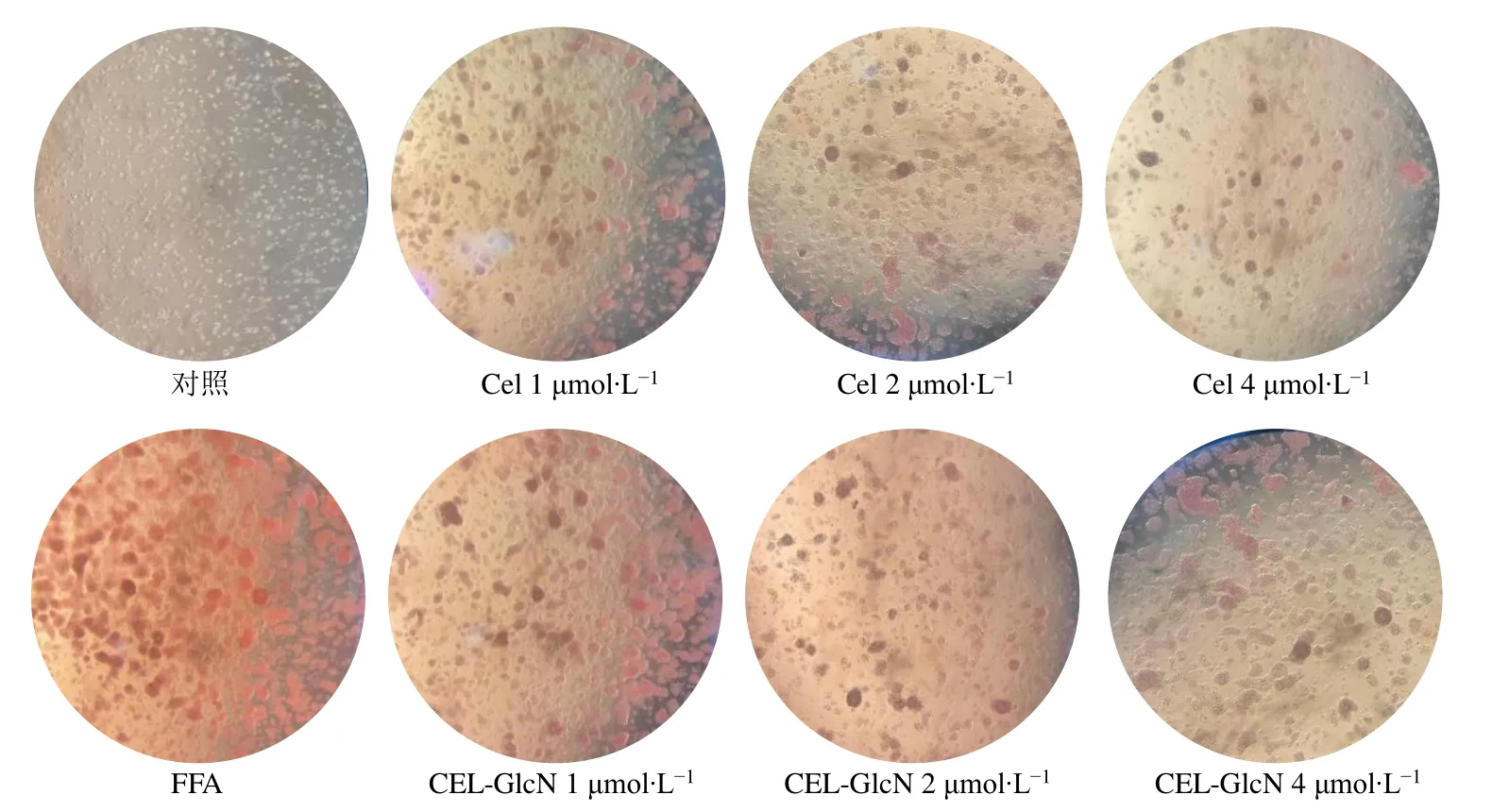
图7 Cel、Cel-GlcN 干预后各实验组细胞油红染色细胞图 (×200)Fig. 7 Diagram of oil red stained cells in each experimental group after Cel and Cel-GlcN intervention (× 200)
2.3.5 Cel、Cel-GlcN 对肝脏氧化应激的影响 使用荧光探针DCFH-DA 测定细胞内活性氧(reactive oxygen species,ROS)相对含量。将DCF-DA 母液通过DMSO 制备为50 mmol,并使用无血清细胞培养血液DMEM 稀释为10 μmol/L。加入各组细胞后,在37 ℃的培养箱中孵育20 min。使用PBS 清洗2次去除未反应的DCFH-DA 探针。在特定的时间点(1、2、4、8、12、24 h),使用酶标仪读取每个孔在激发波长488 nm、发射波长525 nm 下的荧光强度(fluorescence intensity,F),按公式计算ROS 相对含量。
ROS 相对含量=(F实验-F空白)/(F对照-F空白)
肥胖是一种多因素引起的慢性疾病。其中,脂肪组织分泌的脂肪因子可以诱导ROS 的产生。当细胞内的ROS 增多而无法及时清除时,就会导致细胞氧化损伤,这被称为氧化应激(oxidative stress,OS),OS 被认为是引发高脂血症等一系列代谢疾病的关键因素[22]。当人体摄入过多的FFA 时,摄入能量远大于消耗的能量,导致原本在线粒体上正常进行的β-氧化部分转化为过氧化物酶体中的β-氧化和内质网上的ω-氧化。这不仅降低了脂肪代谢效率,还会产生更多的ROS,引发机体氧化应激反应。本研究通过对比不同浓度的Cel 和Cel-GlcN 作用于高脂细胞模型后的ROS 水平,其动力学曲线见图8,发现Cel和Cel-GlcN 对细胞内ROS 产生呈现剂量相关性增加。
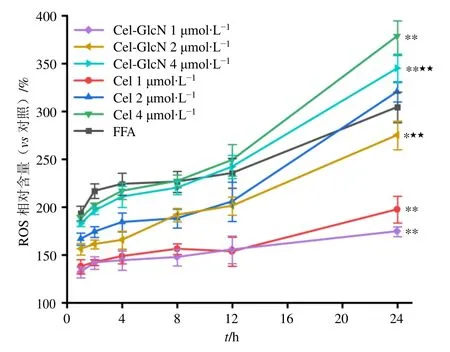
图8 Cel 及Cel-GlcN 对细胞ROS 产生随时间变化的动力学曲线 (±s, n = 4)Fig. 8 Kinetic curves of Cel and Cel-GlcN on cellular ROS over time (±s, n = 4)
值得注意的是,Cel 在单独作用时同样也会引发细胞内的氧化应激反应[23],低剂量组1 μmol/L Cel和Cel-GlcN 产生的ROS 水平位于空白组和模型组之间,与FFA 模型组之间差异呈显著性(P<0.01),表明Cel 和Cel-GlcN 均具有一定抑制机体氧化应激,降低ROS 水平作用,相比于原始药物Cel,Cel-GlcN 能更小程度减弱相关氧化应激反应。推测其可能与Cel-GlcN 释放游离Cel 介导提高超氧化物歧化酶(superoxide dismutase,SOD)活性、激活过氧化物酶体增殖物激活受体γ 辅助活化因子1(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1)活性相关[24]。在使用2 μmol/L Cel 和Cel-GlcN 处理后,Cel 组的细胞中ROS 水平与FFA 诱导的高脂模型细胞相当,Cel-GlcN 组所产生的ROS水平,与模型组相比较低具有显著性差异(P<0.05)。经过高浓度组4 μmol/L Cel 和Cel-GlcN 处理后,ROS 水平均高于FFA 模型组(P<0.01),表明高浓度组的Cel 和Cel-GlcN 所引发的氧化应激反应较模型组更加剧烈,但4 μmol/L Cel-GlcN 相比于同浓度组的Cel,诱发的ROS 水平更低(P<0.01)。具体结果如表4 所示,因此,体外研究表明,在使用Cel-GlcN 作为药物干预时,不仅可以发挥Cel 和GlcN的调脂、抗炎保肝及抗肿瘤等活性,还可在等浓度条件下减弱由原始药物Cel 诱发的氧化应激反应。
表4 Cel、Cel-GlcN 干预诱导HepG2 细胞24 h 后ROS 含量 (±s, n = 4)Table 4 ROS content in HepG2 cells induced by Cel and Cel-GlcN intervention for 24 h (±s, n = 4)

表4 Cel、Cel-GlcN 干预诱导HepG2 细胞24 h 后ROS 含量 (±s, n = 4)Table 4 ROS content in HepG2 cells induced by Cel and Cel-GlcN intervention for 24 h (±s, n = 4)
与对照组比较:###P<0.001;与FFA 组比较:*P<0.05 **P<0.01;与同剂量Cel 组比较:★★P<0.01。###P < 0.001 vs control group; *P < 0.05 **P < 0.01 vs FFA group; ★★P <0.01 vs same dose Cel group.
组别 浓度/(μmol·L-1) ROS 相对含量/%对照 - 100.0 FFA - 304.3±16.1###Cel 1 197.3±14.1**2 320.5±10.6 4 378.6±20.0**Cel-GlcN 1 174.3±5.1**2 275.0±15.5*★★4 345.2±15.7**★★
3 讨论
虽然Cel 可以与多个疾病靶点相互作用产生强烈药理学活性,在治疗各种疾病中方面具有巨大潜力,但鉴于其微弱的水溶性(常温下为1.23 μg/mL),较低的生物利用度(SD 大鼠中17%)尤其是对各种器官具有明显的不良反应,Cel 临床应用面对的这些问题也是研究人员重点关注的对象,因而对Cel 进行结构修饰,筛选出药理活性更为突出的衍生物成为了目前研究的热点。
作为一种五环三萜类结构,Cel 具有多个活泼基团,主要包括A/B 环的醌甲基、C-3 位羟基和C-20位羧基,因此,结构修饰大多集中在这些位置。其中,基于第20 位的羧酸基团进行结构修饰,可以通过酰化和酯化反应引入合适的基团从而生成酰胺类、酯类及脲类衍生物。以往对Cel 的酯类衍生物研究中发现,Cel 醌甲基部位为其发挥药理活性的必要部位,一旦改变醌甲基的结构,药物活性就会减弱。单伟光等[23]通过对Cel 第20 位羧酸基团的修饰(添加卤素元素、苯环、六环以及羟基),合成了一系列酯类衍生物(化合物1~10,图9)。这些衍生物中,化合物1~4 和6~8 的极性明显大于Cel,水溶性也更好。其中,化合物4 和8 显示出最强的药物活性,在体外HepG2 细胞实验中表现出最好的效果,这表明羟基的引入可能对Cel 的极性和药理活性有很大改善作用。Zhang 等[24]通过对C-20 羧基修饰后引入胺和三唑类衍生物,发现酰胺键的引入可以提高Cel 的抗增殖活性(化合物11~14)。在哌嗪衍生物类(化合物15~20)中,含氮杂环化合物也同样显示出良好的抗增殖活性,这表明Cel的活性增加可能与引入的含氮基团有关。
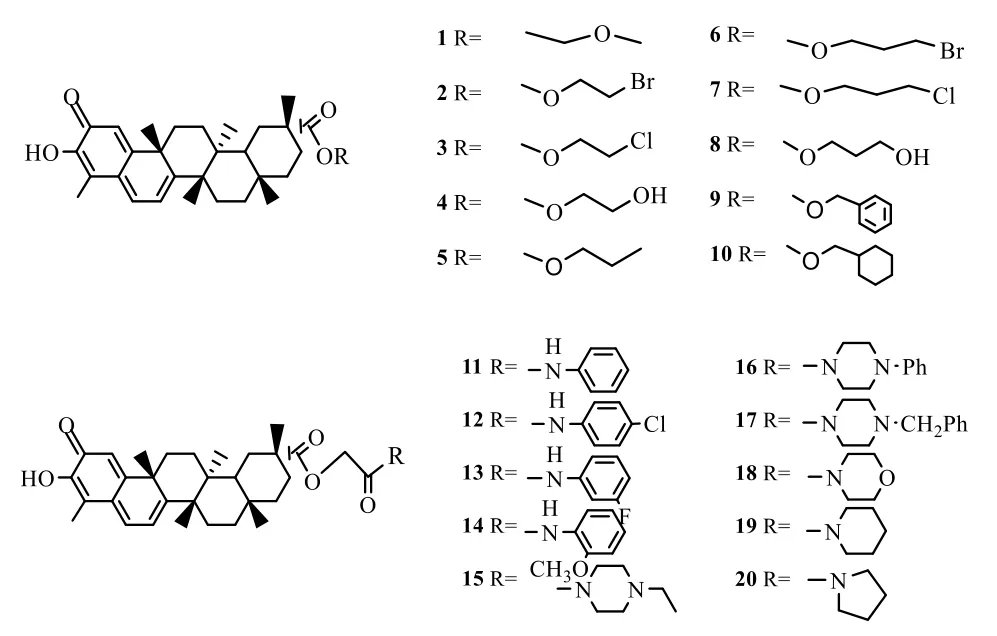
图9 Cel 酯类、酰胺类衍生物Fig. 9 Esters and amide derivatives of Cel
GlcN 分子为含氮原子的六元环结构,具有多个羟基,水溶性较好且安全无毒,易于与Cel 分子的活性基团羧基发生酰胺化反应。因此,为降低Cel的药物毒性,本实验选择了GlcN 与Cel 进行酰胺化缩合,在对比2 种不同的反应体系DMF、二氯甲烷后,选择了产率及质量分数均更高的DMF 体系进行小批量酰胺缩合制备Cel-GlcN,相比于Tian 等[11]的研究,该反应无需对Cel 的碳链进行延伸分步与伯胺缩合来实现酰胺化。此外,部分学者为保证酰胺化反应中目标产物的产率,会将羧酸反应为酰氯,经醇淬灭后再与胺反应来提高该反应的效率[25],本研究方案使用高活性催化剂PyBOP 在DMF 溶剂中完成了该反应,极大地减少了反应副产物生成,同时也保证了具有良好的产率。
肥胖是一种代谢疾病,若不及时干预,可能引发糖尿病、高血压和高血脂症等风险。Cel 作为一种具有多种生物活性的天然产物,在提供显著的减肥功效的同时,其不良反应也是不可忽视的因素。本研究通过对Cel 分子的羧酸基团进行修饰合成了Cel-GlcN 这一衍生物,大大改善了Cel 的溶解性(达到226 μg/mL)。通过比较Cel 和Cel-GlcN 在体外细胞试验中的活性,结果验证了在相同剂量水平下,Cel-GlcN 与Cel 具有相似的减肥调脂活性。此外,Cel-GlcN 可能通过缓控释方式释放游离的Cel,从而减轻其对细胞的毒性和机体内的氧化应激水平。相较于天然产物Cel,Cel-GlcN 很可能减轻其对肝脏、肾脏和心脑血管的不良反应,为Cel 在临床应用上提供了有价值的线索。本研究结果表明,Cel-GlcN 很可能是改善Cel 水溶性和不良反应的重要化合物,并为相关药物的研发提供了参考依据。
利益冲突所有作者均声明不存在利益冲突

