茯苓多糖在秀丽隐杆线虫中的抗氧化和抗衰老作用及其作用机制
宋祯彦,黄亚琦#,王也彤,邓 嘉,甄达贵,谭年花,成绍武*
1. 湖南中医药大学中西医结合学院 中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208
2. 靖州苗族侗族自治县质量计量检验检测中心,湖南 怀化 418400
衰老是以生物机能的下降和适应性、抵抗力的减退为特征的退行性生理过程,其中氧化应激损伤与衰老密切相关[1]。正常情况下机体维持着“氧化-抗氧化”之间的动态平衡,但这种平衡可随着年龄增长被打破,伴随年龄增长的是自由基过剩和(或)抗氧化剂的缺失,进而导致生物膜结构被破坏、细胞器功能出现障碍,蛋白质、脂质等生物大分子物质出现损伤[2]。在机体衰老的有氧代谢中,自由基增加或抗氧化剂缺失使得细胞毒性增加和机体抗氧化能力下降,这种变化将造成生物膜、氨基酸链及DNA 分子结构的不可逆损害,诱发机体衰老相关退行性疾病的产生,加速衰老进程[3]。
秀丽隐杆线虫是研究机体衰老基本机制的绝佳模型,因其具有寿命短、细胞模式简单、繁殖迅速、后代数多、行为反应模式稳定、结果灵敏可靠等特点,可表现出具有一系列类似于哺乳动物的衰老特征[4]。线虫中高达60%~80%的基因与人类基因组具有同源性,为人类遗传分析提供了有利条件。其中BZIP 结构域蛋白1(protein skinhead-1,skn-1)与哺乳动物的核因子E2 相关转录因子2(nuclear factor E2 related factor 2,Nrf2)蛋白在功能上具有一致性,可在体内发挥相似的抗氧化应激作用[5]。
Kelch 样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)/Nrf2 通路是体内氧化还原平衡的细胞防御机制和重要调控途径[6]。Keap1 是Nrf2 的主要负调节因子,生理状态下可介导Nrf2 的泛素化及降解。在氧化应激状态下,Keap1通过氧化还原反应被修饰,构象发生变化,从而与Nrf2 解离。Nrf2 被激活进入细胞核内,与肌肉腱膜纤维肉瘤(musculoaponeurotic fibrosarcoma,MAF)结合为异质二聚体后,启动抗氧化反应元件(antioxidant response elements,ARE),增加细胞对于氧化应激的抵抗力,并减少细胞凋亡以提高存活率,从而恢复内稳态。已有研究证明,Nrf2 活性水平与物种寿命之间存在正向相关,且会随着年龄的增长而逐渐降低[7-8]。
为实现健康老龄化,衰老医学将目标投向衰老相关疾病的早期干预和预防,其中干细胞移植、促进抗衰老因子表达、中医治疗、针灸、膳食补充剂等最新治疗方法的研究,为衰老相关疾病的治疗提供了新的方向[9]。中医药因其宏观辩证,用药精当,不良反应较少,逐渐得到国际认可,在抗衰老研究与治疗中发挥越来越重要的作用。常用药食两用传统中药茯苓为多孔菌科真菌茯苓Poriacocos(Schw.) Wolf 的干燥菌核。茯苓性味甘、平、淡,归心、肺、脾、肾经,具有利水渗湿、和胃健脾、宁心安神的功效。茯苓自古为延年益寿佳品,在《神农本草经》中谓其“久服安魂养神,不饥延年。”现代药理学研究表明,茯苓具有抗肿瘤、调节免疫功能、保肝健脾、镇静安神、利水消肿、抗炎抑菌、抗衰老、抗突变等多方面的药理作用[10-11]。目前,从茯苓中已成功分离提取出茯苓多糖、三萜类、甾醇类、挥发油类、蛋白质等成分,其中茯苓多糖作为茯苓的主要生物活性成分之一,具有抗氧化、抗衰老、抗炎、免疫调节、抑菌、保肝及抗癌等生物学功能[12-14]。茯苓作为当归芍药散的主要成分之一,已被证明对衰老相关疾病阿尔茨海默症具有较好的疗效[12-13]。因此茯苓的主要成分茯苓多糖将在延缓衰老和预防衰老方面的表现出巨大的潜力。本研究基于科学理论支持和相关研究基础,构建线虫模型,揭示茯苓多糖通过调控skn-1 信号通路延缓衰老的分子机制,进一步证明中药在延缓衰老中的价值,并为药食同源理念提供新依据。
1 材料
1.1 线虫
所有线虫品系和菌株均购自美国隐杆线虫遗传中心(Caenorhabditis Genetics Center,CGC),包括野生型N2、CB1370[daf-2(e1370)]、DA116[eat-2(ad1116)]、EU1[skn-1(zu67)]、LD1(ldIs7[skn-1b/c:GFP+rol-6(su1006)])和埃希氏大肠杆菌OP50(Escherichiacoli)。
1.2 药品与试剂
靖州茯苓(批号2022081201)由靖州苗族侗族自治县质量计量检验检测中心提供并经甄达贵副高级工程师鉴定为多孔菌科真菌茯苓P.cocos(Schw.)Wolf 的干燥菌核;葡萄糖标准品(批号PHR1000)购自美国 Sigma-Aldrich 公司;百草枯(批号M106760)购自上海阿拉丁公司;盐酸左旋咪唑(批号L8230)购自北京索莱宝科技有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒(批号S0033S)购自碧云天生物工程有限公司;引物由上海生工生物工程有限公司合成;逆转录试剂盒(批号0521751)购自苏州近岸蛋白质科技股份有限公司;快速抗体染料法定量 PCR 预混液(批号MQ10401S)购自莫纳生物科技有限公司。
1.3 仪器
Medifuge™小型台式离心机(美国Thermo Fisher Scientific 公司);Cytation3 多功能酶标仪(美国BioTek公司);T100TM型qRT-PCR 仪(美国Bio-Rad 公司);Axio Vert.A1 倒置荧光显微镜(德国Zeiss 公司)。
2 方法
2.1 茯苓多糖的提取和鉴定
参考李晓洁等[15]的研究方法,挑选色泽均匀、无霉斑的茯苓块于50 ℃烘箱中烘干,经粉碎机粉碎后过50 目筛得茯苓粉,封存,备用。取1 g 茯苓粉,按照不同料液比1∶50(g∶mL),加入0.6 mol/L的NaOH 溶液,在恒温水浴锅中进行浸提1.0 h,浸提后的溶液用0.5 mol/L 的HCl 中和,8 000 r/min 离心10 min,取沉淀。将沉淀放入透析袋中,在水中透析7 d,透析完毕后,离心出尽可能多的水,最后通过真空冷冻干燥得到茯苓多糖。使用葡萄糖标准品,采用酶标仪于490 nm 最大吸收波长处测定吸光度(A)值,绘制多糖浓度(x)与A值(y)的标准曲线。配制0.1 mg/mL 茯苓多糖溶液,测定茯苓多糖含量[16]。
2.2 线虫与大肠杆菌OP50 培养条件
在所有实验中,用碱性次氯酸盐处理受精的雌雄同体[17],使线虫同步。将实验线虫保存在含有大肠杆菌OP50 的线虫生长培养基(NGM)板上培养,温度为20 ℃。
2.3 毒理实验
将同期化L4 期野生型N2 线虫转移到含有不同质量浓度(10、20、40、80、160、320、640、1 280 μg/mL)的茯苓多糖和空白含菌培养皿中培养。培养48、72 h 后观察线虫存活情况。以铂丝轻碰触秀丽线虫后10 s 无反应判断线虫死亡。意外死亡、逃逸(爬壁干燥死亡)、囊袋虫、内部孵育[18]线虫,剔除判断。
2.4 寿命实验
将L4 期N2 线虫转移到含(10、20、40 μg/mL)茯苓多糖组和空白组的含菌培养皿中,每组50 只。为了确保药物在整个实验过程中不失效,每天将线虫转至新的培养皿,并使用铂金丝轻轻刺激,记录存活线虫数量,持续到最后1 条线虫死亡[19]。
2.5 抗逆性实验
为检测对百草枯的抗性,将L4 期N2 线虫分组同上,每组50 只,处理3 天后进行氧化应激处理,则将其移至含有10 mmol/L 百草枯的培养皿,此时记为第0 天,每12 小时记录线虫存活数量及死亡数量,直至最后1 条线虫死亡[20]。为评价对紫外和高温的抗性,将L4 期N2 线虫分组同“2.4”项,每组40 只。将各组线虫分别转移至未加OP50 的NGM培养皿中,紫外应激处理是置于超净台中开盖紫外灯光照射2 h,高温应激处理则将其置于35 ℃恒温培养箱中开盖静置2 h,然后将线虫分别转入对应浓度的含菌培养皿中继续培养,每天记录存活线虫的数量,持续到最后1 条线虫死亡[19]。
2.6 脂褐素分析
将L4 期N2 线虫分别转移到含(10、20 μg/mL)茯苓多糖各1 组,40 μg/mL 茯苓多糖和空白组各2组的含菌培养皿中,每组20 只,处理7 d 后将1 组空白组和1 组40 μg/mL 茯苓多糖组的线虫挑到含10 mmol/L 百草枯的培养皿中,其余组不变,12 h后,将线虫挑至含2%琼脂糖凝胶的载玻片上,用10µL 浓度为10 mmol/L 的盐酸左旋咪唑溶液麻醉后,压片。在倒置荧光显微镜下进行观察,Image-Pro Plus 软件定量分析荧光强度[20]。
2.7 生理机能实验
2.7.1 吞咽频率测定 将L4 期N2 线虫分组同“2.4”项,每组50 只,此时记为第0 天。分别在给药培养后的第3、6、9、12 天,每组选取生长状态良好且状态相近的5 条线虫移至无OP50 的NGM培养皿中,适应1 min 后,观察并记录30 s 内单条线虫吞咽泵完成跳动的次数。线虫摄取食物主要通过吞咽泵完成,当其吞咽泵分别向上和向下各进行1 次跳动,即为完成1 次跳动[21]。
2.7.2 虫体摆动频率测定 每组选取生长状态良好且状态相近的5 条线虫观察并记录虫体摆动状况,向载玻片上滴加M9 溶液10 μL,每次随机挑取1 只线虫置于M9 溶液中,使其在M9 溶液中适应1 min,然后记录线虫虫体30 s 内摆动的次数,将其头部和尾部摆动到同一侧的线虫运动被计为1 次摆动[22]。
2.7.3 生殖测定 将L4 期N2 线虫分组同“2.4”项,每组5 条。每板1 条,为方便统计产卵数量,采用直径35 mm 培养皿。每天同一时间将成虫转移至新的培养基继续产卵,连续转4 d(产卵高峰期)。所有含有虫卵的培养皿置于20 ℃培养箱中,待发育至幼虫期即培养2 d 后计数各组子代的数目[21]。
2.8 突变体线虫应激与寿命实验
选取同期化L4 期daf-2、eat-2、skn-1 3 种突变体线虫和N2 野生型线虫转移到含有40 μg/mL 茯苓多糖的药物组和空白组的含菌培养皿中,每组50 条,按照“2.5”项下方法进行抗氧化应激实验[22]。选取L4 期skn-1 突变体线虫和L4 期N2 线虫分组同上,每组50 条,按照“2.4”项下方法进行寿命实验。
2.9 线虫skn-1 绿色荧光蛋白的细胞定位检测
选取L4 期skn-1b/c:GFP 线虫转入2 组含有40 μg/mL 茯苓多糖的药物组和2 组空白组的含菌培养基中,每组50 条,处理7 d 后将1 组空白组和1 组40 μg/mL 茯苓多糖的药物组转至含10 mmol/L 百草枯的培养基培养,其余组不变,处理12 h 后,每组各取40 条线虫将线虫挑至含2%琼脂糖凝胶的载玻片,用10 µL 浓度为10 mmol/L 的盐酸左旋咪唑溶液麻醉后,压片。在倒置荧光显微镜下进行观察。计取skn-1 绿色荧光蛋白全部和部分进入肠道细胞核以及未进入肠道细胞核的线虫的数目,并拍照保存。高表达表示在线虫的从头到尾大部分肠道细胞核中都能观察到强烈的skn-1b/c:GFP 信号;中表达表示在线虫的头和尾部的肠道细胞核中能观察到skn-1b/c:GFP 信号或者在所有肠核中都观察到微弱的skn-1b/c:GFP 信号;低表达表示在线虫的头部至尾部几乎检测不到skn-1b/c:GFP 信号,用Image-Pro Plus 软件处理图像并进行数据的统计与分析[23]。
2.10 qRT-PCR 实验
将L4 期N2 线虫分组及处理同“2.6”项,每组100 只,按照试剂盒说明书提取线虫RNA,测定浓度后进行逆转录,采用SYBR Green 染料法在Realtime qPCR 仪上进行扩增,反应程序为95 ℃、5 min,95 ℃、30 s,58 ℃、30 s,40 个循环。以GAPDH为参比基因,采用2-ΔΔCt法进行数据分析。抗氧化基因谷胱甘肽S-转移酶4(glutathione S-transferase 4,gst-4)、gst-7、超氧化物歧化酶3(superoxide dismutase-3,sod-3)、热休克蛋白16.2(heat shock protein Hsp-16.2,hsp16.2)引物序列(表1)参照Wang 等[23]的研究。同时选取L4 期skn-1 突变体线虫分组及处理同“2.9”项,采用上述同样处理后检测各基因的表达水平。

表1 引物序列Table 1 Primer sequences
2.11 ROS 水平检测
将L4 期N2 线虫分组及处理同“2.6”项,每组30 只,用M9 缓冲液收集各组线虫并清洗后,放入含有200 μL PBS 缓冲液的EP 管中,在冰上超声破碎后,4 ℃、12 000 r/min 离心,取上清,移入黑色96 孔板中每个孔中(每组平行3 孔,每孔加入50µL 上清液),再加入50 µL 提前稀释好的100 µmol/L H2DCF-DA 荧光探针,设置不加线虫和DCFH-DA溶液的空白组,只加线虫不加DCFH-DA 溶液的对照组,将加样后的96 孔黑板室温避光孵育30 min,酶标仪检测荧光,每5 分钟读1 次数,读60 min,激发光为485 nm,发射光为528 nm,测定荧光强度,从而确定ROS 水平[19]。同时选取L4 期skn-1突变体线虫分组及处理同“2.9”项,采用上述同样处理后检测ROS 水平。
2.12 统计学分析
实验结果采用Prism GraphPad 8统计软件分析,生存曲线实验结果采用Log-Rank 检验进行分析,其余实验采用方差分析进行两组间比较。
3 结果
3.1 茯苓多糖提取物多糖含量和毒性检测
葡萄糖标准曲线线性方程为y=3.608 6x+0.086 8(R2=0.991 9),葡萄糖质量浓度为0.02~0.10 mg/mL,A值与其呈良好线性关系,提取物中总多糖质量分数为276.746 mg/g。茯苓多糖对秀丽隐杆线虫的毒理实验结果表明,质量浓度在1.28 mg/mL 以下的茯苓多糖对秀丽隐杆线虫均无毒性作用,40 μg/mL 以上的质量浓度茯苓多糖对秀丽隐杆线虫寿命影响无显著差异,故选取10、20、40 μg/mL 的茯苓多糖开展后续实验(表2)。

表2 茯苓多糖对秀丽隐杆线虫的毒性作用Table 2 Toxic effect of Poria cocos polysaccharides on C.elegans
3.2 茯苓多糖延长秀丽隐杆线虫的寿命并提高抗衰老能力
寿命的长短是衡量线虫衰老最重要的指标。茯苓多糖对线虫寿命的影响见图1-A,在正常的实验条件下,N2 线虫的平均寿命为(11.420±0.635)d,在给予10、20、40 μg/mL 茯苓多糖后,平均寿命分别增加到(12.130±0.469)、(13.261±0.475)、(14.247±0.719)d。与N2 组比较,10、20、40 μg/mL茯苓多糖组的寿命分别增加 6.21%、16.12%、24.75%,寿命以茯苓多糖剂量相关性的方式增加,说明茯苓多糖具有延长成年线虫寿命的效应。蠕虫的寿命与其在各种应激源下的存活率呈正相关[24]。在紫外应激条件下线虫寿命如图1-B 所示,与N2组比较,20、40 μg/mL 茯苓多糖延长了线虫生存时间。在35 ℃热休克条件下线虫寿命如图1-C 所示,N2 组平均生存时间为(4.570±0.528)d,而40 μg/mL茯苓多糖延长线虫生存时间到(5.416±0.532)d,综上,提示茯苓多糖能增加对紫外照射的耐受性和提高线虫的耐热性。
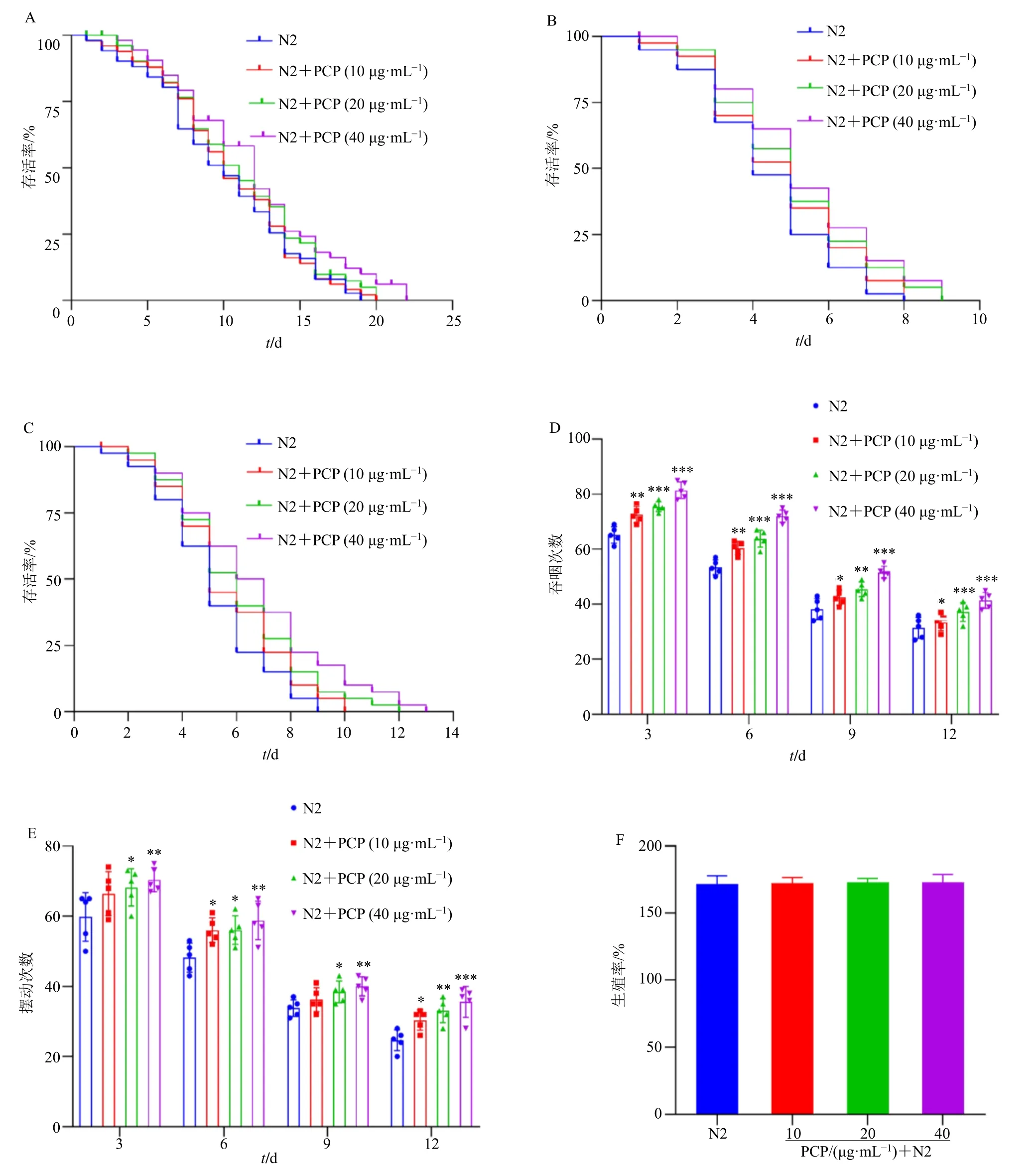
图1 茯苓多糖延长秀丽隐杆线虫的寿命并提高抗衰老能力 (±s, n = 50)Fig. 1 P. cocos polysaccharides extends lifespan of C. elegans and enhances anti-aging abilities (±s, n = 50)
线虫的进食是通过头部后端的吞咽泵跳动完成的,咽泵速在整个发育幼虫期逐渐增加,在L4 期达到峰值,然后在衰老期间逐渐降低[22]。茯苓多糖能够显著提高野生型N2 成虫给药后第3、6、9、12 天的吞咽次数(P<0.05、0.01、0.001,图1-D)。观察M9 液体中线虫在一定时间内的弯曲次数,可评价线虫衰老进程[22]。茯苓多糖给药培养后的第3、6、9、12 天线虫弯曲次数均高于N2 组(P<0.05、0.01、0.001,图1-E)。线虫的产卵数量是反映线虫生理能力强弱的一个重要指标[20]。各质量浓度的茯苓多糖均对线虫的产卵数量无显著影响(图1-F),说明药物质量浓度并不影响线虫正常繁殖。综上,提示茯苓多糖能够延缓野生型N2 线虫的衰老进程,增强抗衰老能力,其中40 μg/mL 茯苓多糖干预后效果最显著。
3.3 茯苓多糖降低秀丽隐杆线虫脂褐素和ROS 的含量,促进抗氧化基因表达
随着机体的老化,细胞的新陈代谢被破坏,产生大量自由基,可能与不饱和脂肪酸发生反应,导致脂褐素的产生[25]。如图2-A、B 所示,与N2 组比较,20、40 μg/mL 茯苓多糖组线虫体内的脂褐素荧光强度显著降低(P<0.001),提示茯苓多糖能减轻衰老过程中的脂褐素生成。在正常衰老过程中会不断产生ROS,ROS 具有很强的氧化能力,因此ROS被认为是引起衰老的主要原因[26]。本实验采用H2DCF-DA 荧光探针法检测茯苓多糖对线虫内源性ROS 水平的影响。如图2-D 所示,与N2 组比较,40 μg/mL 茯苓多糖处理后N2 线虫内源性ROS水平显著降低(P<0.01),而较低的ROS 水平可能与提高抗氧化应激能力和延长寿命相关。在生理条件下,采用qRT-PCR 检测N2 线虫中抗氧化基因gst-4、gst-7、sod-3和hsp-16.2的mRNA 表达。如图2-C 所示,与N2 组比较,40 μg/mL 茯苓多糖干预后gst-4、gst-7表达水平显著升高(P<0.01)。gst-4的转录激活通常被用来考察skn-1 活性[27]。
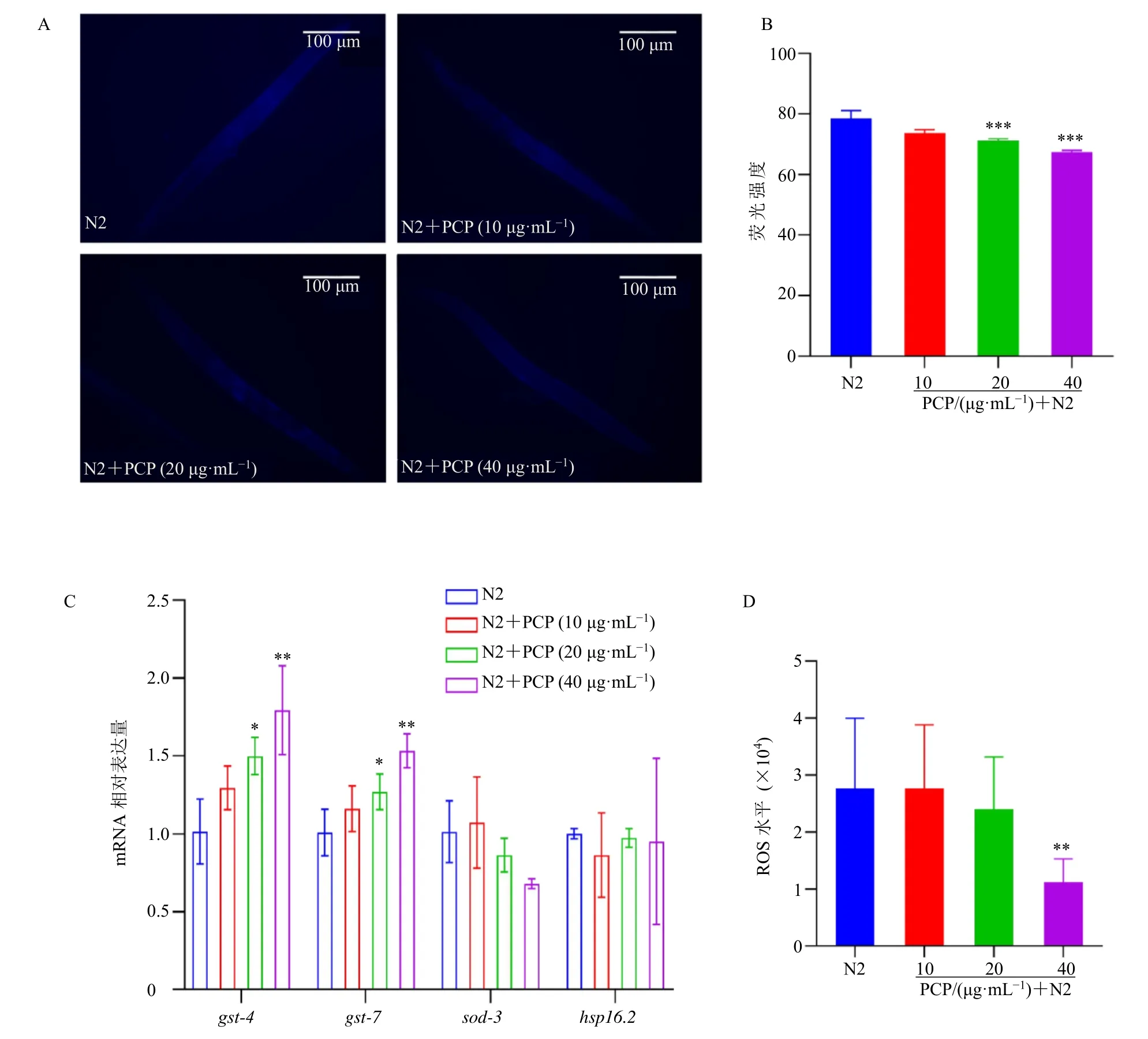
图2 茯苓多糖降低秀丽隐杆线虫脂褐素和ROS 的含量,促进抗氧化基因表达 (±s, n = 50)Fig. 2 P. cocos polysaccharides reduces lipofuscin and ROS levels, promotes expression of antioxidant genes in C. elegans(±s, n = 50)
3.4 茯苓多糖诱导秀丽隐杆线虫抗氧化应激,减少损伤
利用百草枯建立氧化损伤模型,该模型会诱导线虫产生大量的ROS,ROS 是一种高活性氧分子,可诱导遗传毒性和生理损伤,破坏抗逆性的先天机制,可能导致DNA 损伤、基因表达改变、细胞信号紊乱、脂质过氧化和蛋白质稳态失衡,最终导致细胞衰老和死亡[28]。如图3-A 所示,与模型组比较,20、40 μg/mL 茯苓多糖在氧化应激条件下能延长线虫寿命,提高其抗氧化应激能力。在氧化应激条件下测定脂褐素,与模型组比较,40 μg/mL 茯苓多糖在氧化应激条件下能显著降低线虫体内脂褐素荧光强度(P<0.001,图3-B、C)。同时在氧化应激条件下,与模型组比较,40 μg/mL 茯苓多糖组线虫体内抗氧化相关基因gst-4、gst-7表达水平均显著升高(P<0.01、0.001,图3-D)。ROS 的生成与氧化损伤密切相关,如图3-E 所示,与模型组比较,在氧化应激条件下40 μg/mL 茯苓多糖处理的N2 线虫体内ROS 水平显著降低(P<0.01)。综上提示,茯苓多糖能延长线虫在氧化应激状态下的寿命,具有抗氧化活性,茯苓多糖能减少线虫氧化应激状态下ROS的产生,调控抗氧化基因抑制内源性ROS 产生可能与茯苓多糖的抗氧化活性相关。
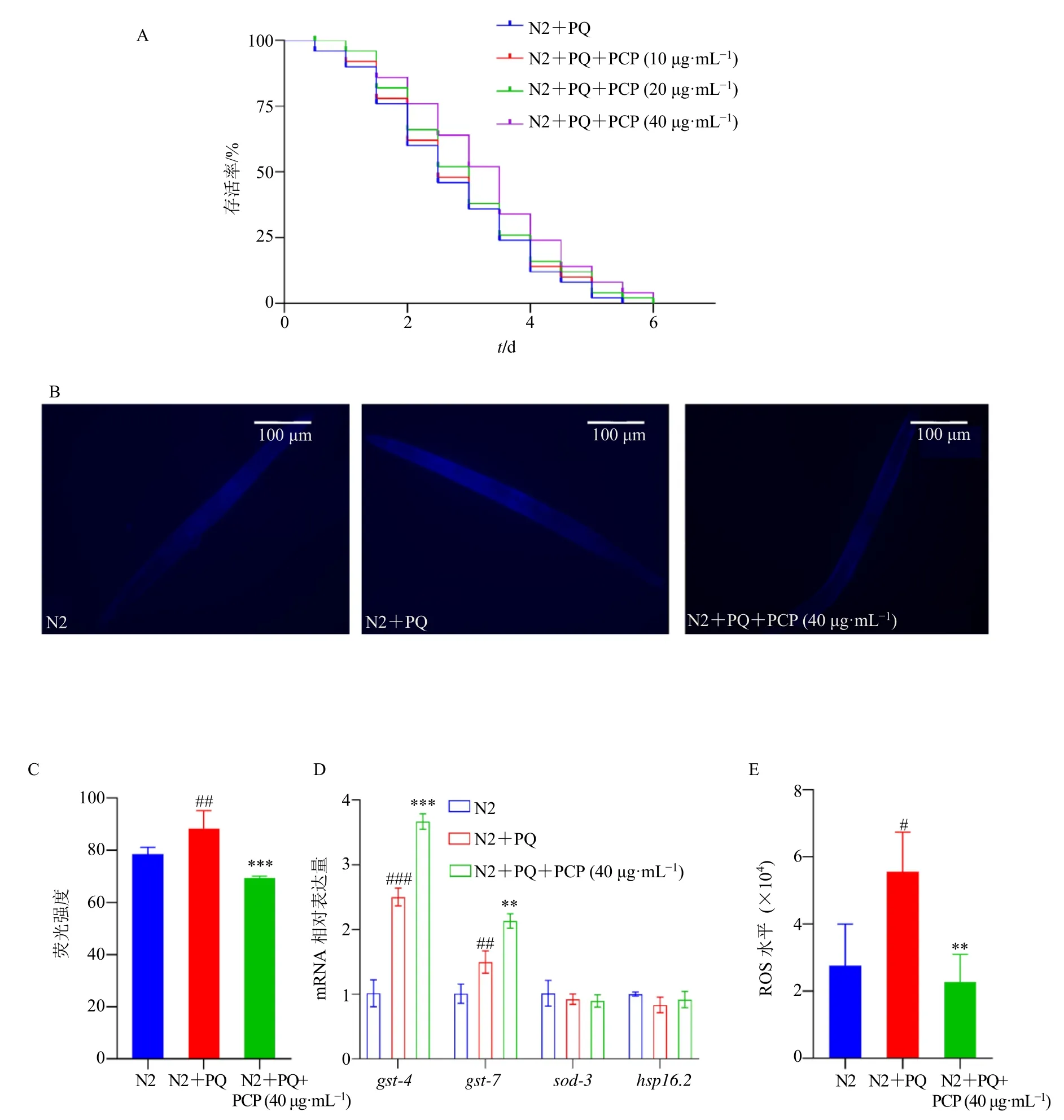
图3 茯苓多糖诱导秀丽隐杆线虫抗氧化应激并减少损伤 (±s, n = 40)Fig. 3 P. cocos polysaccharides induces antioxidant stress in C. elegans and reduce damage (±s, n = 40)
3.5 茯苓多糖诱导秀丽隐杆线虫体内的氧化应激抗性需要skn-1
利用与衰老相关的胰岛素信号通路daf-2 突变体线虫、饮食限制信号通路eat-2 和skn-1 转录因子skn-1 突变体线虫,探究茯苓多糖在体内的抗氧化作用途径[23]。如图4 所示,40 μg/mL 茯苓多糖可以延长氧化应激下胰岛素样受体β 亚基(insulin-like receptor subunit beta,daf-2)和神经元乙酰胆碱受体亚基eat-2(neuronal acetylcholine receptor subunit eat-2,eat-2)突变体线虫的寿命,但不能延长skn-1 突变体线虫的寿命。而在生理情况下40 μg/mL 茯苓多糖能延长N2 线虫寿命,但不能延长skn-1 突变体线虫的寿命,提示茯苓多糖延长线虫寿命与调控skn-1 信号通路抗氧化有关,而非daf-2 和eat-2 途径介导。
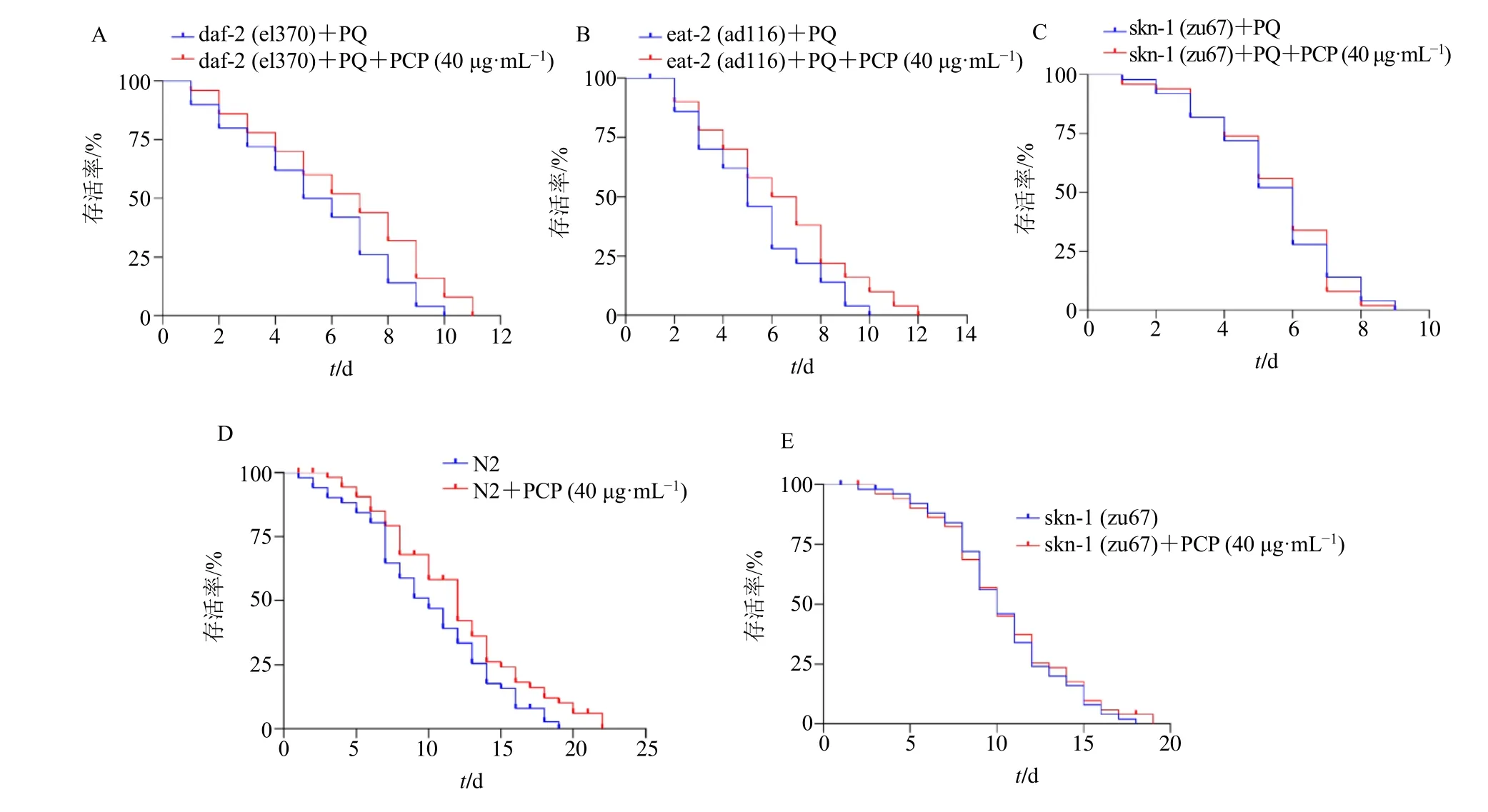
图4 茯苓多糖诱导秀丽隐杆线虫体内的氧化应激抗性需要skn-1 (±s, n = 40)Fig. 4 P. cocos polysaccharides require skn-1 for induction of oxidative stress resistance in C. elegans (±s, n = 40)
3.6 茯苓多糖通过skn-1 信号通路诱导氧化应激抵抗
skn-1 是哺乳动物抗氧化酶调节基因Nrf2 在秀丽隐杆线虫的同源基因,可促进线虫氧化应激抵抗力,帮助延长长寿[29]。为进一步检测skn-1 活性,检测了skn-1b/c:GFP 线虫中skn-1 的核定位情况,结果显示40 μg/mL 茯苓多糖明显促进了skn-1 的入核(P<0.05,图5-A、B);在氧化应激条件下,40 μg/mL 茯苓多糖也能促进skn-1 的入核(P<0.05,图5-C),提示skn-1 的入核激活下游转录发挥抗氧化作用。skn-1/Nrf2 信号通路在秀丽隐杆线虫衰老过程中起着至关重要的作用[30]。为了确定茯苓多糖是否通过这一机制发挥作用,分析了skn-1 突变体线虫中gst-4、gst-7、sod-3和hsp16.2的mRNA 表达。结果显示,在skn-1 突变体线虫中,40 μg/mL茯苓多糖干预后skn-1 转录因子下游的抗氧化基因gst-4、gst-7、sod-3和hsp16.2的表达水平均无明显差异(图5-D),而在氧化应激条件下茯苓多糖对skn-1 转录因子下游的抗氧化基因gst-4、gst-7、sod-3和hsp16.2的表达也均无明显影响(图5-E),说明茯苓多糖的抗氧化活性可能与调控skn-1 转录因子及其下游的抗氧化基因gst-4、gst-7有关。进一步提示茯苓多糖可能通过skn-1 转录因子调控下游抗氧化基因gst-4和gst-7来延长N2 线虫寿命。为研究ROS 的减少是否与skn-1/Nrf2 信号通路有关,使用skn-1 突变体线虫进行研究,发现40 μg/mL 茯苓多糖处理后内源性ROS 水平没有显著性(图5-F),说明茯苓多糖降低线虫内源性ROS 水平可能是由skn-1 转录因子调控的。而在氧化应激条件下,40 μg/mL 茯苓多糖处理SKN-1 突变体线虫后内源性ROS 水平也没有显著性(图5-G),提示线虫降低ROS 的产生可能是由skn-1 转录因子调控的。综上,茯苓多糖能延长线虫寿命,其机制可能是通过调控skn-1 转录因子提高抗氧化能力从而减少内源性ROS 的产生。

图5 茯苓多糖通过skn-1 信号通路诱导氧化应激抵抗 (±s, n = 50)Fig. 5 P. cocos polysaccharides induce oxidative stress resistance via skn-1 signaling pathway (±s, n = 50)
4 讨论
中药多糖发挥抗氧化作用主要体现在清除自由基和调控抗氧化酶或氧化酶活性2 方面。现代研究表明,茯苓多糖是高效的抗氧化剂,可通过破坏反应链,清除羟自由基、过氧化氢、超氧阴离子、一氧化氮等易诱导细胞氧化损伤的自由基,缓解机体氧化应激反应,同时茯苓多糖可有效提高超氧化物歧化酶、谷胱甘肽还原酶、过氧化氢酶和谷胱甘肽过氧化物酶等抗氧化酶的活性,增加谷胱甘肽水平,限制脂质过氧化和超氧阴离子的产生,降低氧化损伤,茯苓多糖为茯苓发挥抗氧化的主要药效基础,具有保护生物膜和延缓衰老的作用[31-32]。本研究发现,从茯苓中提取的茯苓多糖在秀丽隐杆线虫中具有显著的抗衰老活性。茯苓多糖处理后N2 线虫的脂褐素、吞咽次数、虫体摆动次数和对紫外辐射以及热应激抵抗能力等衰老指标显著提高,寿命显著延长,体现出显著的抗衰老作用。
在衰老的支持细胞中存在着多种改变,如ROS水平升高、炎症状态、DNA 受损、自噬受损、线粒体功能障碍等[33]。其中,氧化应激和炎症是中心环节。在本研究中,茯苓多糖处理线虫后在氧化应激条件下的存活时间显著延长,脂褐素表达明显下降,线虫体内ROS 水平显著降低,说明茯苓多糖可能通过降低ROS 水平来调控秀丽隐杆线虫抗衰老。
据报道,细胞对氧化应激的防御反应受到许多转录因子的调节,包括skn-1 和daf-16[34-35]。茯苓多糖可以延长氧化应激条件下daf-2、eat-2 2 种突变体线虫的寿命,仅skn-1 突变体线虫寿命未得到改善。结果表明,胰岛素信号传导(daf-2)、热量限制(eat-2)与茯苓多糖的抗氧化活性无关。由外源性氧化剂或环境条件引起的ROS 生成和清除失衡被称为氧化应激,以秀丽隐杆线虫死亡为特征。鉴于秀丽隐杆线虫寿命的延长通常伴随着抗应激能力的增强,本研究进行了抗氧化应激和解毒基因的qRT-PCR检测。sod-3 刺激线粒体呼吸体中的蛋白质异构化、活性和超氧自由基的清除[36],gst-4 是一种谷胱甘肽S-转移酶,可促进II 期解毒过程[37]。其表达受daf-16 和skn-1 调控[38],gst-7 增加谷胱甘肽转移酶活性,参与谷胱甘肽的制造和代谢,减少ROS 水平,通过解毒氧化应激副产物对抗氧化应激[39],hsp16.2是由hsf-1 控制的热休克蛋白,hsf-1 转录因子通过控制伴侣型热休克蛋白的表达和在热应激下保持蛋白稳态来保护机体免受热休克,hsp16.2 的增加降低了谷胱甘肽水平,增强了未折叠蛋白结合活性,提高了抗热应激能力[40]。在秀丽隐杆线虫中这些抗氧化基因与skn-1/Nrf2 途径调控有关。已有研究表明,铁皮石斛水提物通过激活skn-1 转录因子延长秀丽隐杆线虫寿命作用及机制研究[41]。本研究结果表明,茯苓多糖能诱导生理和氧化应激条件下skn-1从细胞质到细胞核的易位,并激活下游抗氧化基因gst-4 和gst-7 的表达,这可能与延长寿命有关。但茯苓多糖不能促进生理和氧化应激情况下skn-1 突变体线虫下游gst-4 和gst-7 表达,也不能降低ROS的水平,进一步证明茯苓多糖抗衰老的机制与调控skn-1/Nrf2 经典抗氧化途径有关。
综上,茯苓多糖具有延长秀丽隐杆线虫寿命,增强抗衰老的能力。机制研究表明,茯苓多糖可以促使skn-1 入核,上调相关抗氧化基因的表达,降低线虫体内活性氧自由基水平进而增强其抗氧化应激能力,延缓衰老速度,提示其很可能是一种有前景的天然抗衰老成分,值得进一步研究。然而,在模式生物秀丽线虫模型下的研究结果仍然是局限的,需要在哺乳动物和临床试验中进一步证实茯苓多糖的抗衰老效应。
利益冲突所有作者均声明不存在利益冲突

