山羊睾丸细胞 LGALS1 基因的克隆及序列分析
张煜杭, 郑维豪, 姬格金, 葛佳仪, 鲜思美
(1. 贵州大学动物科学学院,贵州 贵阳 550025;2. 贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025)
半乳糖凝集素1(LGALS1/Galectin-1)是 Galectins家族的 15 个成员之一,大小约15 ku,是第1个被研究并报道的哺乳动物半乳糖凝集素,能在多种免疫细胞中表达,如:树突状细胞、T细胞、巨噬细胞、单核细胞等[1]。LGALS1是1种β-半乳糖苷结合蛋白,可调节免疫反应及炎症反应等过程,还可通过结合病毒蛋白或调节细胞内途径从而介导宿主与病毒的相互作用,对病毒感染有抑制作用[2]。例如:LGALS1与猪繁殖和呼吸综合征病毒(PRRSV)的E蛋白相互作用可抑制PRRSV的复制[3];LGALS1特异性结合尼帕病毒(NiV)糖蛋白NiV-F和NiV-G(促进细胞间融合和合胞体形成),从而阻断病毒感染[4];LGALS1与塞卡病毒E蛋白结合时下调LGALS1表达量,可减少塞卡病毒的吸附与侵入等[5]。为进一步了解LGALS1基因的遗传进化情况,本试验以山羊为研究对象,从山羊睾丸细胞中克隆得到LGALS1基因,并对LGALS1基因的遗传进化进行初步分析,以期为进一步研究羊源LGALS1基因的功能奠定基础。
1 材料与方法
1.1 主要试剂
Trizol试剂、PrimeSTAR Max Premix(2×)、pMD19-T载体、DNA 连接酶、限制性核酸内切酶BamHⅠ、XhoⅠ(购自 TaKaRa 公司),Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)逆转录试剂盒(购自翌圣生物科技有限公司),DH5a感受态细胞、2×PCR Master Mix、SanPrep 柱式 DNA 胶回收试剂盒[购自生工生物工程(上海)股份有限公司],DNA Marker DL 2 000、DL 5 000(购自Vazyme公司)。
1.2 主要仪器
PCR仪[型号:TC-96/G/H(b)B,BIOER公司]、电泳仪(型号:EPS300,Tanon公司)、凝胶成像仪(型号:Tanon-1600,Tanon公司)、台式高速冷冻离心机(型号:ScanSpeed 1730R,LA-BOGENE公司)、分光光度计(型号:NanoDrop One,Thermo Fisher公司)。
1.3 引物设计与合成
根据Genbank中登录的山羊LGALS1基因序列(登录号:XM_018048739.1),应用Primer Primier 5.0软件设计1对带酶切位点的特异引物[生工生物工程(上海)股份有限公司合成],下划线部分分别为BamHⅠ、XhoⅠ酶切位点。引物信息见表1。
1.4 山羊睾丸细胞总RNA提取及cDNA第一链合成
采用Trizol法提取山羊睾丸细胞的总RNA,使用分光光度计测定其浓度与纯度并记录数值,将A260 nm/A280 nm比值在1.8~2.1间的RNA使用Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)逆转录试剂盒逆转录合成cDNA第一链。反转录体系20 μL:5×gDNA digester Mix 3 μL,RNA模板2 μL,RNase-Free H2O 10 μL,4× Hifair®Ⅲ SuperMix plus 5 μL。反应程序:25 ℃孵育5 min,55 ℃孵育15 min,85 ℃孵育5 min。反应结束后将产物于 -20℃冰箱保存备用。
1.5 山羊睾丸细胞LGALS1基因PCR扩增
将反转录产物进行PCR扩增。PCR反应体系50 μL:PrimeSTAR Max Premix(2×)25 μL,上、下游引物(10 μmol/L)各2 μL,模板cDNA 1 μL,ddH2O 20 μL。PCR扩增条件:98 ℃ 变性10 s,60 ℃退火5 s,72 ℃延伸60 s,共35个循环。取扩增产物于1.2%琼脂糖凝胶中电泳,凝胶成像仪观察结果。
1.6 山羊睾丸细胞LGALS1基因的克隆与鉴定
采用SanPrep 柱式 DNA 胶回收试剂盒对LGALS1目的基因进行胶回收,将目的基因与pMD19-T载体连接,在PCR反应管中建立连接体系20 μL:pMD19-T载体2 μL,SolutionⅠ10 μL,回收目的DNA 8 μL。充分混匀,置于金属恒温仪16 ℃连接过夜。将重组质粒pMD19-T-LGALS1转化至大肠杆菌DH5a感受态细胞,步骤如下:(1)取出大肠杆菌DH5a感受态细胞100 μL,冰上溶解后加入连接产物10 μL(连接产物不超过感受态细胞的1/10),轻摇混匀后冰上放置30 min,每10 min轻弹1次,42 ℃热击90 s冰上放置1 min。(2)加入预热的LB液体培养基900 μL,混匀后37 ℃摇床培养1 h。(3)将菌液4 ℃ 8 000 r/min离心2 min,弃去上清800 μL。(4)重悬菌体沉淀,将其涂布于含有氨苄西林(终浓度100 μg/mL)的LB平板培养基,正面放置,待完全吸收后倒置培养皿,37 ℃恒温培养12~16 h,进行阳性克隆挑选。(5)挑选菌进行质粒PCR验证(方法同1.4),并使用限制性内切酶BamHⅠ、XhoⅠ进行质粒双酶切验证(阳性重组质粒约3 110 bp,pMD19-T空载体约2 700 bp,目的基因约400 bp),在PCR反应管中建立酶切体系50 μL:BamHⅠ1 μL,XhoⅠ1 μL,缓冲液25 μL,pMD19-T-LGALS15 μL,ddH2O 18 μL。轻轻混匀后瞬时离心,37 ℃保温15 min。将鉴定为阳性的重组质粒送上海生物工程有限公司进行测序验证。
1.7 山羊睾丸细胞LGALS1基因序列分析
使用DNAStar的MEGA 5.0软件将克隆的山羊LGALS1基因与Genbank中其他14个物种(见表2)的LGALS1基因序列进行核苷酸同源性分析并绘制系统进化树。
2 结果与分析
2.1 山羊睾丸细胞LGALS1基因的PCR扩增结果
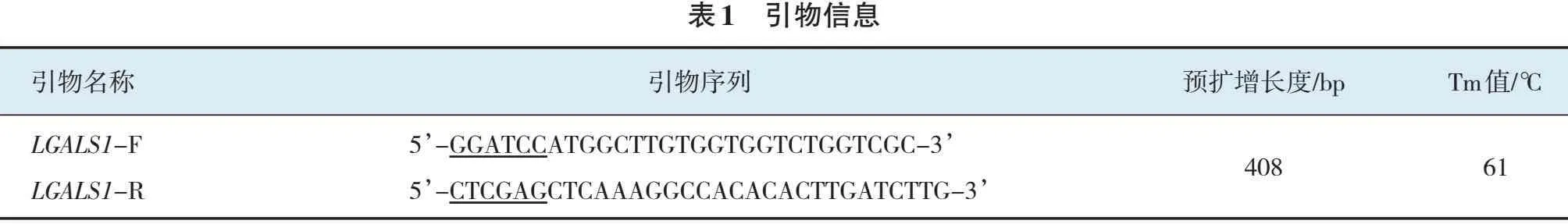
以反转录cDNA为模板,对LGALS1基因进行PCR扩增,经1.2%琼脂糖凝胶电泳分析,得到长度为408 bp的片段,与预期相符(见图1)。
M:DL 5 000 Marker;1:空白对照;2~4:LGALS1基因PCR产物
2.2 山羊睾丸细胞LGALS1基因重组质粒PCR鉴定结果
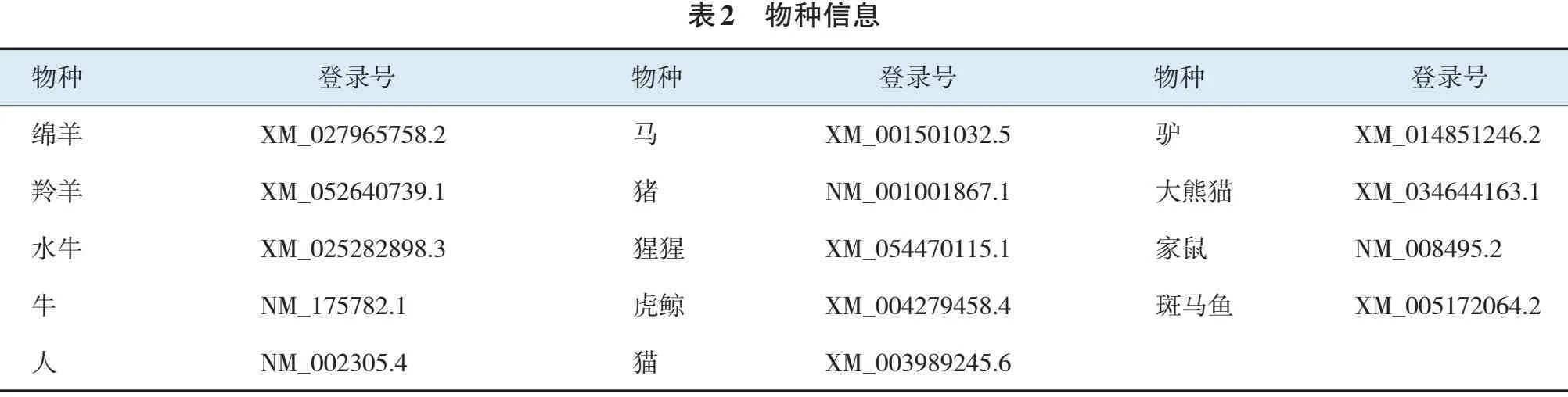
对克隆重组质粒进行PCR扩增,得到长度为408 bp的特异片段,与预期相符(见图2)。

M:DL 5 000 Marker;1:空白对照;2~3:pMD-19T-LGALS1质粒PCR产物
2.3 重组质粒双酶切鉴定结果
重组质粒经限制性内切酶BamHⅠ、XhoⅠ双酶切,酶切产物长度分别为2 700 bp的pMD-19T载体和408 bp目的条带,与预期相符,表明LGALS1基因成功插入克隆载体(见图3)。
M:DL 5 000 Marker;1:空白对照;2~3:pMD-19T-LGALS1 双酶切产物
2.4 山羊睾丸细胞LGALS1基因序列分析
测序结果表明,克隆的LGALS1基因与GenBank中登录的山羊LGALS1编码区序列(XM_018048739.1)相似性达100%。相似性比对结果显示,克隆山羊LGALS1基因与绵羊、羚羊、牛的同源性最高,核苷酸相似性均大于96%,与其他物种的核苷酸相似性介于54.6%~90.9%之间,其中与斑马鱼相似性最低(54.6%)(见图4)。系统进化树显示,LGALS1基因在山羊、绵羊、羚羊中为同一分支且亲缘关系最近,与斑马鱼的亲缘关系最远(见图5)。

图4 LGALS1基因核苷酸序列比对结果
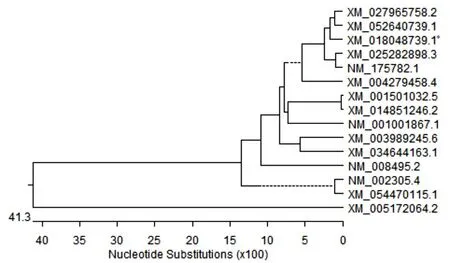
图5 LGALS1基因核苷酸序列的系统进化树
3 结论
试验成功克隆了山羊睾丸细胞LGALS1基因;经核苷酸序列同源性比对及遗传进化树分析,山羊LGALS1基因种内高度保守,与绵羊、羚羊亲缘关系最近,与斑马鱼亲缘关系最远。
4 讨论
本试验结果表明,LGALS1基因CDS区长度为408 bp,共编码135个氨基酸,与张凯等[6]、赵志峰等[7]对白来航鸡和梅花鹿的LGALS1基因研究结果一致。相似性比对及系统进化树显示,山羊LGALS1基因与同属动物的核苷酸一致性都在99%以上,与斑马鱼相似性最低(54.6%),与遗传距离结果一致,表明LGALS1基因具有较强的种属进化特异性和多样性,不同物种之间同源性越高,其进化关系越近。本试验克隆的山羊睾丸细胞LGALS1基因可为后续的抗羊LGALS1抗体制备和羊源LGALS1蛋白功能研究奠定基础。

