卡格列净与阿米洛利或苯扎米尔联用对肾病综合征大鼠骨代谢的影响
环 薇, 李 潇, 洪文娟, 罗晓菲, 王学芳, 李 倩, 成家茂
(1. 大理大学临床医学院, 云南 大理, 671003; 2. 大理大学第一附属医院 肾脏内科, 云南 大理, 671013;3. 大理大学基础医学院 解剖教研室, 云南 大理, 671003)
肾病综合征(NS)是以大量蛋白尿(>3.5 g/24 h)、低蛋白血症(< 30 g/L)、水肿和高脂血症为特征的一组临床综合征,是终末期肾病的原因之一。钠-葡萄糖协同转运蛋白2 抑制剂(SGLT2i)是一类新型降糖药, 具有降低尿蛋白、改善肾功能的作用[1], 卡格列净可增加骨折风险[2]。本课题组前期研究[3]发现,卡格列净治疗可使骨盆骨密度下降,高剂量卡格列净能增加骨质疏松风险。上皮钠通道是一种在肾远端小管处对钠转运起重要作用的离子通道,维持着体内的钠水稳态[4]。阿米洛利和苯扎米尔是上皮钠通道阻断剂(ENaCi), 其中,阿米洛利可抑制破骨细胞分化[5], 苯扎米尔对骨代谢影响的报道较少, ENaCi联用SGLT2i对骨代谢的影响尚未阐明。本研究观察卡格列净分别联用阿米洛利或苯扎米尔对阿霉素肾病大鼠骨代谢的影响,以期为临床防治NS患者药物性骨质疏松提供用药指导。
1 材料与方法
1.1 主要药物
阿霉素注射液(深圳万乐药业有限公司,批号H44024359); 卡格列净片(西安杨森制药有限公司,批号H20170375); 阿米洛利(上海皓元生物医药科技有限公司,目录号HY-B0285A/CS-2298); 苯扎米尔(上海皓元生物医药科技有限公司,目录号HY-B1546A/CS-7692)。
1.2 实验动物造模及分组
SPF级雄性SD大鼠49只, 6周龄,体质量180~200 g, 购自昆明双欣生物科技有限公司,许可证号SCXK(豫)2020-0005。所有大鼠均饲养在大理大学动物实验中心,自由饮食饮水。随机选取42只大鼠,经尾静脉第1次注射阿霉素4 mg/kg, 间隔1周后第2次注射阿霉素2.5 mg/kg, 建立NS模型; 剩余7只作为正常对照组(NG组),给予注射等量0.9%氯化钠溶液。造模7 d后,留取24 h尿液,并进行24 h尿蛋白定量(24 h-UTP)检测。24 h-UTP≥100 mg表示造模成功[6]。将造模成功大鼠再随机分为模型组(MG组)、卡格列净组(KG组)、苯扎米尔组(BH组)、阿米洛利组(AL组)、卡格列净+苯扎米尔组(KB组)、卡格列净+阿米洛利组(KA组),每组7只。
1.3 药物干预及一般情况观察
卡格列净使用剂量[10.5 mg/(kg·d)]依据人与大鼠用药比例进行换算,苯扎米尔[1.25 μg/(g·d)]及阿米洛利[10 mg/(g·d)]则依据说明书给予安全剂量,各药物均使用0.9%氯化钠溶液配制成相应浓度备用。每天上午9: 00开始,各药物组每只大鼠给予1 mL/100 g体质量灌胃, NG组则只给予0.9%氯化钠溶液,连续灌胃6周。每天灌胃前观察大鼠的一般情况,记录大鼠体质量。
1.4 尿液指标检测
在干预前1 d和干预6周末,将各组的每只大鼠单独放置于代谢检测笼,期间禁食不禁水, 24 h后收集尿液,立即送大理大学第一附属医院检验科检测24 h-UTP、尿钠(UNa)、尿钾(UK), 采用日立7000 120+ISE+ID型全自动生化分析仪进行测定。
1.5 血清学指标检测
药物干预6周后,采用乌拉坦1.5 g/kg腹腔注射麻醉大鼠,剪开胸腹腔,抽取下腔静脉血5 mL, 3 000转/min离心15 min, 吸取血清, -4 ℃保存。第2天冷链-80 ℃送至武汉赛维尔生物科技有限公司,采用Chemray 240全自动生化分析仪检测血清白蛋白(ALB)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、血钙(SCa)、血钠(SNa)、血钾(SK)、25-羟维生素D(25-OH-D)、碱性磷酸酶(ALP)和甲状旁腺素(PTH)水平。采用酶联免疫吸附测定(ELISA)法检测血清骨形成标志物Ⅰ型前胶原氨基端原肽(PINP)和骨吸收标志物Ⅰ型胶原羧基端肽β 特殊序列(β-CTX)的表达。
1.6 统计学分析
2 结 果
2.1 各组大鼠体质量比较
各组大鼠体质量符合正态分布,采用配对样本t检验。大鼠初始体质量及造模期间各组持续升高的体质量比较,差异无统计学意义(P>0.05), 见图1。连续药物干预2、4、6周后,大鼠体质量变化为NG组、MG组持续上升(P<0.01), KG组持续下降,差异有统计学意义(P<0.05), 而AL组、BH组、KB组、KA组的差异无统计学意义(P>0.05)。结果表明,单用卡格列净有减轻体质量的作用,而卡格列净联用苯扎米尔或阿米洛利可能具有防止体质量下降的作用。
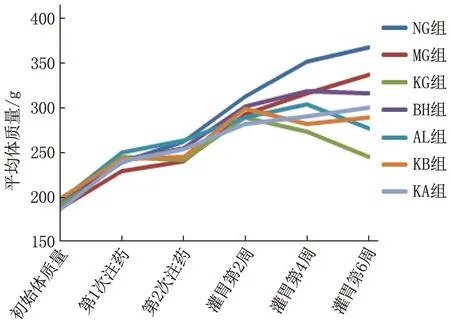
图1 各组大鼠灌胃前后体质量变化
2.2 各组大鼠尿液指标比较
经方差齐性检验,干预前后24 h-UTP、UNa的方差齐性检验均齐同,采用方差分析; UK方差不齐,采用秩和检验。药物干预前1 d行24 h-UTP检测; 药物干预6周后,进行24 h-UTP、电解质的检测和比较。
2.2.1 尿蛋白水平比较: 干预前1 d, MG组及各药物组大鼠的24 h-UTP均较NG组升高,且超过100 mg, 表明造模成功。干预6周后,各药物组大鼠24 h-UTP均较MG组下降,差异有统计学意义(P<0.01); 单药组间比较, BH组降低蛋白尿的效果较差,差异有统计学意义(P<0.01), 而KG组和AL组的降低效果比较,差异无统计学意义(P>0.05); 联合用药物KB组和KA组与KG组, KB组与BH组, KA组与AL组分别进行比较, KA组降尿蛋白的效果最好,差异有统计学意义(P<0.05或P<0.01), 见表1。结果表明单独用药和联和用药均能使阿霉素诱导NS大鼠的尿蛋白降低,以KA组最为显著。
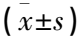
表1 各组实验大鼠尿液指标比较
2.2.2 UNa、UK比较: NG组与MG组的UNa水平比较,差异无统计学意义(P>0.05); AL组、KB组、KA组的UNa水平高于MG组,差异有统计学意义(P<0.01)。单药组间比较, AL组的UNa水平高于BH组,差异有统计学意义(P<0.05); KB组的UNa水平高于BH组,差异有统计学意义(P<0.05); KA组与AL组比较,差异无统计学意义(P>0.05)。结果表明造模不影响UNa的排泄,单用AL组及联合用药KB组、KA组均有排钠作用,仅联合用药KB组较单用药BH组排钠效果增强。各组的UK水平比较,差异均无统计学意义(P>0.05)。见表1。
2.3 各组大鼠血液指标的比较
经方差齐性检验, ALB、TC、TG、LDL、SCa、25-OH-D、ALP、PINP、PTH、β-CTX的方差均齐同,采用方差分析; SNa、SK方差不齐,采用秩和检验。药物干预6周后,进行低蛋白血症、高脂血症、电解质和骨代谢相关指标的检测和比较。
2.3.1 ALB水平比较: MG组较NG组下降,各药物组均较MG组升高,差异有统计学意义(P<0.01), 但各药物组之间的差异无统计学意义(P>0.05), 见表2。结果表明阿霉素诱导的NS 大鼠出现低蛋白血症,单用和联用药物均能使其得到改善且效果接近。
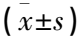
表2 药物干预6周后各组大鼠血液指标比较
2.3.2 脂质代谢指标TC、TG、LDL水平比较: MG组均高于NG组,各药物组均较MG组下降,差异有统计学意义(P<0.05 或P<0.01), 但各单用药组进行组间比较及各联合用药物组与相应的单用药组比较,差异均无统计学意义(P>0.05), 见表2。结果表明阿霉素诱导的NS大鼠出现高脂血症,单用和联用各药物后,均能获得相差不明显的降血脂效果。
2.3.3 电解质SCa、SNa、SK水平比较: MG组的SCa水平较NG组升高,各药物组较MG组均下降,差异有统计学意义(P<0.05或P<0.01); KG组的降SCa效果较AL组更好,差异有统计学意义(P<0.01)。结果表明,造模后NS大鼠的SCa水平上升,各药物组治疗后均使SCa水平下降,但单用阿米洛利降SCa的效果较差。各组的SNa、SK水平间比较,差异无统计学意义(P>0.05)。见表3。
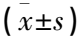
表3 药物干预6周后各组大鼠血液指标比较 mmol/L
2.3.4 骨代谢指标25-OH-D、ALP、PINP、PTH、β-CTX水平比较: 前三者有利于促进成骨,后两者则促进破骨。药物干预6周后,进行各指标比较。MG组的25-OH-D、ALP、PINP水平较NG组均下降,差异有统计学意义(P<0.05或P<0.01); 与MG组比较,单用药AL组25-OH-D、PINP水平升高,联合用药KA组25-OH-D、ALP、PINP水平均升高,差异有统计学意义(P<0.05或P<0.01); 与KG组比较, KA组的ALP水平升高, KB组的PINP水平升高,差异有统计学意义(P<0.05或P<0.01)。与NG组比较, MG组的PTH水平下降,差异有统计学意义(P<0.05), MG组、AL组的β-CTX水平比较差异无统计学意义(P>0.05), KG组、BH组、KB组的β-CTX水平下降,差异有统计学意义(P<0.05或P<0.01), 而KA组的β-CTX水平升高,差异有统计学意义(P<0.05)。与MG组比较, KA组的β-CTX水平升高,差异有统计学意义(P<0.05); 与KG组相比, KA组的PTH、β-CTX水平均升高,差异有统计学意义(P<0.01)。见表4。结果表明,造模NS大鼠的破骨因子可能受到抑制,单用或联用药物后的破骨作用可不产生明显影响,但在阿米洛利与卡格列净联用后,有可能增加了后者导致骨折的风险。
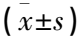
表4 药物干预6 周后各组大鼠骨代谢指标比较
3 讨 论
阿霉素是一种蒽环类抗肿瘤药物,通过对肾脏的直接毒性作用来诱发肾小管间质损伤,可用于构建高度可重复的NS 模型[7]。本实验通过对经尾静脉注射阿霉素后的大鼠尿液和血液检测结果证明模型复制成功。骨质疏松症是以骨吸收超过骨形成引起的骨密度下降和骨组织微观结构恶化为特征的一种全身退变性骨病[8], 其是NS的常见并发症,与血清总钙和维生素D 水平降低有关[9]。钙-PTH-维生素D轴是经典的SCa调节通路。SCa降低时, PTH的合成、分泌增加,促进肾重吸收钙,并增强破骨细胞的骨吸收作用使骨钙释放增多,同时刺激肾将25-OH-D转化为维生素D的活性形式1, 25-(OH)2-D3以增强肠道钙的吸收,从而升高SCa[10-11]。PINP和β-CTX 分别为骨形成和骨吸收的标志物,反映骨重塑率,可作为诊断骨质疏松症的参考指标[12-13]。ALP也可作为诊断和治疗骨质疏松症的有效生物标志物, ALP水平升高代表成骨细胞活性和骨化增强[14]。研究[15]认为, β-CTX在预测骨质疏松症方面优于骨密度。此外,低钠血症能增加破骨细胞形成和骨吸收活性,也与骨质疏松症有关[16]。本实验造模后大鼠的SCa升高,促骨形成因子25-OH-D、ALP、PINP水平和促破骨因子PTH均显著下降,而SNa、SK、UNa、UK和β-CTX水平均无明显变化,表明阿霉素诱导的NS模型主要通过抑制成骨作用增加骨质疏松风险。
SGLT2i 可阻断近端肾小管的重吸收来增强尿液中葡萄糖和钠的排泄[17], 还可能会破坏磷酸盐和钙的稳态,影响骨骼结构,导致体质量减轻[18]。临床荟萃分析[19-20]表明, SGLT2i治疗2型糖尿病患者的骨折风险总比率为0.67, 其致病机制并不十分明确。其中,卡格列净增加骨折的风险,与血清1, 25-(OH)2-D3减少和PTH 增加导致骨量减少有关[21], 还与血清β-CTX 的增加相关[22]。本研究中,卡格列净治疗NS后大鼠的体质量减少, SCa降低,而SNa、SK、UNa、UK、25-OH-D、ALP、PTH、PINP和β-CTX 均无明显变化,表明卡格列净有可能通过降低SCa和减轻体质量增加骨折风险,而通过打破血清成骨/破骨因子平衡造成骨折尚需达到一定的条件。
上皮钠通道在成骨细胞、破骨细胞和软骨细胞上都有分布[4]。研究[23]发现, NS患者尿中的丝氨酸蛋白酶增多,使上皮钠通道的α 和γ 亚基被蛋白水解,导致该通道过度激活,引起钠水潴留。血清钠增加可能会刺激成骨细胞的增殖、分化和基因表达[24]。用阿米洛利治疗肾病小鼠,可使尿中的丝氨酸蛋白酶活性正常化并防止钠水潴留[25], 并减少大鼠破骨细胞的数量,抑制破骨细胞中基因cathepsinK的表达[26]。本研究发现,阿米洛利和苯扎米尔对SNa、SK、UNa、UK以及血清ALP、PTH和β-CTX的影响不明显,均可导致NS大鼠的SCa下降,但只有阿米洛利能使25-OH-D、PINP升高,表明阿米洛利可能通过促进成骨作用来防止NS 大鼠的骨质疏松。
本实验通过对阿霉素诱导的NS大鼠模型给予SGLT2i、ENaCi及两者联合用药,结果发现单药和联合用药均可有效降低尿蛋白和血脂,升高血清ALB, 可用于NS的治疗。本实验还观察到,联用卡格列净和阿米洛利治疗后, NS大鼠的SCa降低,血清25-OH-D、ALP、PINP和β-CTX水平均升高,表明二者联用能显著加强成骨作用,破骨作用也可能增强,从而形成新的成骨/破骨平衡。本研究为治疗NS提供了新的用药参考,卡格列净联用阿米洛利可能有预防NS相关骨质疏松的作用,但具体机制需进一步探索。
——卡格列净的研究进展

