药用植物蒽醌类化合物来源和药理活性研究进展*
卢 婧,郭宇姝,师 超
(解放军总医院医疗保障中心,北京 100048)
蒽醌类化合物是药用植物广泛存在的一类重要的活性成分,具有抗癌[1-2]、抗病原微生物中[3]、抗炎[4-5]、抗骨质疏松[6]、抗氧化[7-8]和抗抑郁[9]等药理活性。从古至今我国一直使用含有蒽醌类成分的中药治疗疾病,如中药大黄具有泻下祛瘀的功效[10]。大黄中蒽醌类成分具有抗炎、抗损伤的药理作用[11]。药用植物蒽醌类化合物主要存在于蓼科、鼠李科、茜草科、豆科、百合科等药用植物中,如大黄、何首乌、虎杖、鼠李、茜草、巴戟天、番泻叶、决明子、芦荟等,具有抗菌、抗炎、抗病毒、抗氧化等作用。
药用植物中蒽醌类化合物具有强效的药理作用,然而有关药用植物蒽醌类化合物的研究只是针对单一中药材化学成分和药理作用的研究,药理作用主要集中在抗癌、抗病原微生物方面,其他功效涉及较少[12-15]。目前研究也缺少蒽醌类成分药理作用系统的阐释。故本文总结整理了从药用植物中鉴定出的蒽醌类化合物及来源,梳理药用植物中蒽醌类成分药理作用,以期为药用植物的蒽醌类成分科学开发及合理用药提供参考,为鉴定更多药用植物蒽醌类成分、探明蒽醌类药理作用和治疗疾病作用机制奠定基础。
1 药用植物蒽醌类化合物的来源
蒽醌是由蒽(图1A)衍生的平面三环芳香烃类化合物,分别在C-9、C-10位引入了羰基官能团。蒽醌(图1B)又名9,10-蒽二酮、蒽酮、9,10-蒽醌、蒽-9,10-醌和9,10-二氢-9,10-二氧蒽[16]。
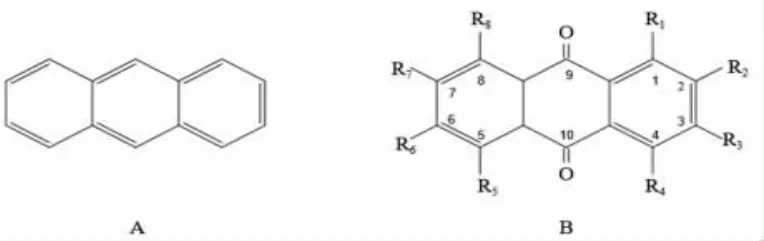
图1 蒽母核结构(A)和蒽醌母核结构(B)
自然界植物中的蒽醌不仅以简单的游离形态存在,还有大部分以其衍生物的形式存在。在药用植物中,蒽醌类化合物多集中在根、叶中。蒽醌类化合物的合成十分复杂,已经确定的蒽醌类化合物起源于各种不同的前体和途径。药用植物中主要有两种蒽醌类化合物的生物合成途径[17],分别是聚酮途径和莽草酸/邻琥珀酰苯甲酸途径。(见图2)其中,聚酮途径由乙酰辅酶A和丙二酰辅酶A为底物在聚酮合成酶Ⅲ作用下生成蒽醌类化合物;莽草酸/邻琥珀酰苯甲酸途径由异分支酸、α-酮戊二酸和硫胺二磷酸为底物,在邻琥珀酰苯甲酸合成酶作用下经系列反应合成蒽醌类化合物。
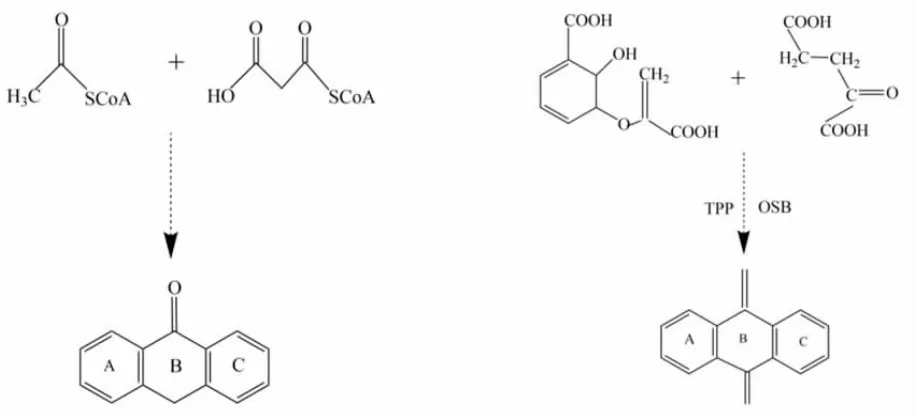
图2 聚酮途径(左)和莽草酸/邻琥珀酰苯甲酸途径(右)
蒽醌类化合物主要存在于蓼科、茜草科、鼠李科、豆科、百合科等药用植物中,如掌叶大黄、茜草、何首乌、虎杖、决明子。目前大黄中发现的蒽醌类成分主要有大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚、葡萄糖苷(大黄素-8-O-β-D-葡萄糖苷、大黄酚-1-O-β-D-葡萄糖苷、大黄酸二葡萄糖苷、芦荟大黄素-1-O-β-D-葡萄糖苷)、番泻苷A、番泻苷B、番泻苷C、番泻苷D等。蒽醌类化合物具有抗癌、抗病原微生物、抗炎、抗氧化和抗骨质疏松、抗抑郁等药理作用[3-11]。药用植物中蒽醌类化合物大多来源于2种途径,其中豆科、蓼科、鼠李科等药用植物,如决明子、大黄、鼠李中蒽醌类化合物来源于聚酮途径;茜草科植物中,如茜草、巴戟天中蒽醌类化合物来源于莽草酸/邻琥珀酰苯甲酸途径。
2 药用植物蒽醌类化合物的结构特性
目前药用植物中已鉴定出多种蒽醌类成分,蒽醌类成分根据母核结构可分为蒽醌单体和双蒽核类蒽醌。
2.1 蒽醌单体 蒽醌环是蒽醌的基本母核,具有单蒽醌环的化合物称为蒽醌单体。根据羟基在母核上的分布,蒽醌单体包括两类:羟基分布在一侧的蒽醌单体大黄素型(化合物1~8),以及分布在两侧位置的蒽醌单体分类茜草素型(化合物9~15)[18-21]。(见图3)大黄素型蒽醌母环两侧的苯环上均分布有羟基取代基。侧链的羟基多与葡萄糖结合成苷类,可使水溶性增加。茜草素型蒽醌类化合物存在于茜草科植物茜草的根茎中,包括茜草素、大叶茜草素、羟基茜草素等。部分蒽核类蒽醌化合物及其结构见表1和图3。

表1 部分单蒽核类蒽醌类化合物
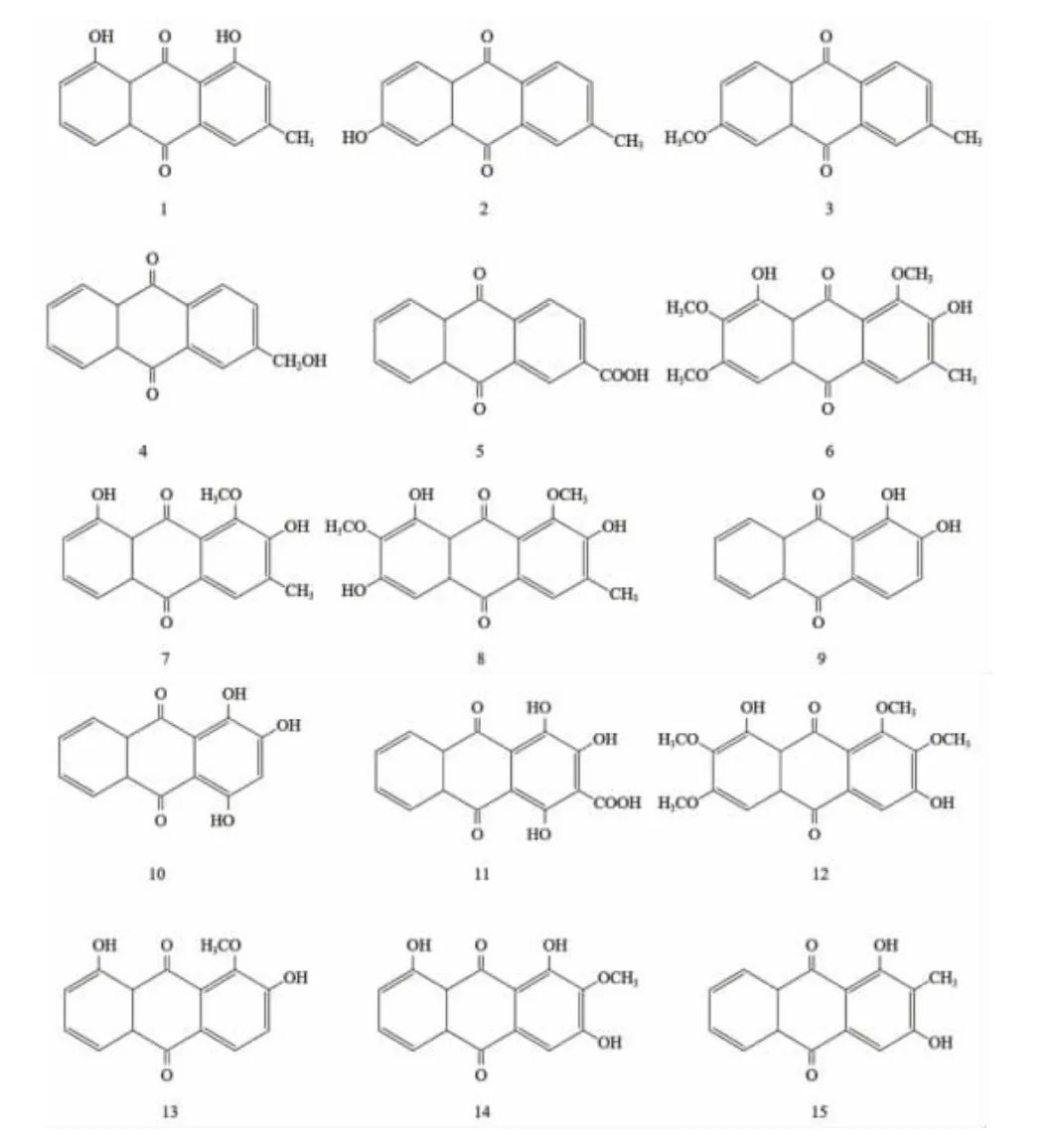
图3 部分单蒽核类蒽醌类化合物
2.2 双蒽核类 2个单一的蒽醌可通过脱水缩合C10-C10键结合形成双蒽核类蒽醌,部分双蒽核类蒽醌化合物及其结构见表2及图4。该类化合物可为单C-C键连接,也可为多C-C键连接。连接方式为顺式或反式。C-C键在自然存放条件下不稳定,易发生断裂,转变为蒽酮,有致泻的功效,如大黄及番泻叶中的番泻苷A。此外,根据脱水量和脱水部位的不同,蒽醌的结构也不同,如天精和山扁豆双醌。

表2 部分双蒽核类蒽醌类化合物
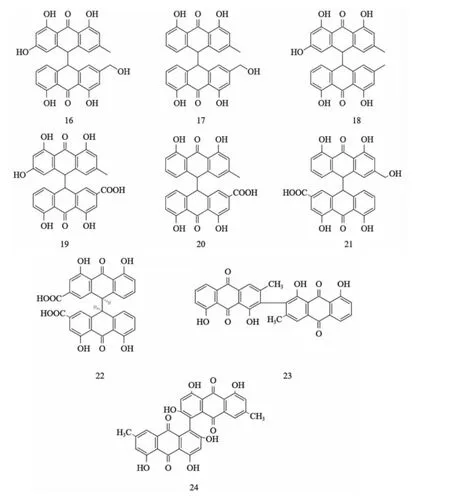
图4 部分双蒽核类蒽醌类化合物的结构
3 药用植物蒽醌类化合物的药理活性
蒽醌类成分是大黄、芦荟等药用植物中的主要活性物质,具有广泛的药理活性,主要包括抗肿瘤、抗病原微生物、抗氧化、抗骨质疏松、抗炎、抗抑郁等活性。药用植物蒽醌类化合物的药理活性和作用机制概括见表3。

表3 药用植物蒽醌类化合物药理活性及作用机制
3.1 抗肿瘤 药用植物蒽醌类化合物可在多种癌症中发挥抗癌潜力,该类成分已在不同的肿瘤细胞系和动物模型中进行了研究。其中,大黄素、芦荟大黄素和大黄酚等经常被用作抗肿瘤药物开发的起点[22]。药用植物蒽醌类化合物抗癌作用的主要机制包括诱导细胞凋亡和激活基因表达通路。癌细胞凋亡的标志是由于线粒体功能障碍导致的线粒体中Ca2+浓度升高[23]或线粒体膜通透性(MMP)降低[24]。芦荟大黄素可通过细胞特异性药物摄取发挥抗癌作用。PECERE T等[25]通过基因沉默、受体竞争、荧光成像及分子建模等手段,证明了芦荟大黄素可抑制人肿瘤癌细胞增殖,同时芦荟大黄素可被生长抑素受体SSTR2、SSTR5特异性识别。该受体可增加了芦荟大黄素积累,降低人肿瘤细胞毒性。此外,大黄酚对多种肿瘤细胞有抗肿瘤活性,可通过损伤线粒体以促进肿瘤细胞凋亡。TRYBUS W等[26]研究表明大黄酚可升高人宫颈癌细胞(Hela)活性氧自由基(ROS)水平,诱导Hela细胞线粒体的损伤和细胞凋亡。
3.2 抗病原微生物 药用植物蒽醌类化合物具有较广泛的抗病原微生物活性,如抗疟疾、抗菌等。药用植物蒽醌类化合物可通过抑制细菌的基础代谢,干预细菌生物膜合成而发挥作用[27-28]。蒽醌类单体化合物大黄素和茜草素具有广谱抗菌活性。HAZNI H等[29]研究证明大黄素能够抑制金黄色葡萄球菌、溶血性链球菌、肺炎球菌、白喉杆菌、炭疽杆菌、痢疾杆菌、大肠杆菌、变形杆菌等细菌活性。大黄中芦荟大黄素和大黄酸是主要的抑菌活性成分[30]。此外,芦荟中蒽醌类化合物对枯草芽孢杆菌、大肠杆菌和金黄色葡萄球菌有明显的抑制作用[31]。ESPINOSA A等[32]从真菌和地衣中提取的蒽醌衍生物1,3,8-三羟基-4-氯-6-甲基蒽醌(CE)对革兰氏阳性菌有明显的抑制作用,而且对常见的耐药菌株如耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌(VRE)抑制作用显著。该研究表明CE抑菌的机制是引起细菌细胞钾渗漏、细胞膜去极化和细胞膜选择性通透性损伤。同时CE与细菌DNA有很强的静电相互作用并能诱导DNA缩合,破坏细菌细胞膜和DNA,从而起到抗耐药菌作用。另外,药用植物蒽醌类化合物也具有较好的抗疟活性。PULLELLA G A等[33]从白纹油菊中提取的蒽醌化合物Albopunctatone具有抗恶性疟原虫作用,其抑制恶性疟原虫生长的半数有效量(ED50)为0.260 mg/mL。
3.3 抗氧化 活性氧不仅与人类慢性疾病密切相关,也是引起人类衰老、癌症、炎症的重要因素[34]。因此,寻找外源性抗氧化剂已备受关注[35]。药用植物蒽醌类化合物,如8-羟基-1,2,6,7-四甲氧基-3-甲基蒽醌、1,6,8-三羟基-2,7-二甲氧基-3-甲基蒽醌、茜草素、紫红素等成分具有抗氧化作用,可通过抑制过量的自由基,预防组织因氧化而产生的损伤,从而降低有关疾病的发生率。LUO H Y等[36]基于色谱分离技术从决明子中分离出新蒽醌苷元8-羟基-1,2,6,7-四甲氧基-3-甲基蒽醌和1,6,8-三羟基-2,7-二甲氧基-3-甲基蒽醌,并通过磁共振光谱和质谱进行结构解析,同时测定了蒽醌类化合物的抗氧化活性。结果表明蒽醌类化合物自由基清除能力强,具有较好的抗氧化活性。蒽醌类化合物可以保护食物免受氧化损伤,防止氧化应激和炎症。NAM W等[37]研究表明茜草根中蒽醌类化合物茜草素、紫红素具有较高的抗氧化活性,且紫红素可以下调NLRP3炎症小体的组装和激活。此外,有研究表明蒽醌类化合物的保肝功效与其抗氧化特性有关。CHEN R R等[38]研究表明巴戟天根的蒽醌提取物在100 mg/kg和200 mg/kg剂量下,可降低小鼠肝脏中丙二醛(MDA)水平,对小鼠肝损伤有保护作用。该研究证明了巴戟天为潜在的抗氧化、保肝药物。
3.4 抗骨质疏松 骨质疏松症患者骨骼结构会发生改变。蒽醌类化合物具有抗骨质疏松的作用,可改善骨骼生物学性能。有研究发现巴戟天中蒽醌类化合物可治疗骨质疏松症。王洪英等[39]研究表明巴戟天蒽醌类成分能提高去卵巢骨质疏松症大鼠模型骨骼矿物质含量,改善大鼠股骨生物学性能,从而有效预防骨质疏松症状的发生。邓亦峰等[40]研究表明游离大黄蒽醌类化合物可以防止骨质疏松症模型大鼠骨骼丢失。SUN Y N等[41]研究发现从溶解的芦荟渗出液中分离出的蒽醌类化合物,在破骨细胞中亦表现出显著抗酒石酸酸性磷酸酶(TRAP)活性,表明蒽醌类化合物具有抗骨质疏松的作用。以上结果和研究体现了蒽醌类化合物在骨质疏松症中的治疗潜力,并为骨质疏松症早期药物的开发奠定了基础。
3.5 抗炎 炎症的病理过程主要为炎症区组织渗出、变性、增生,主要表现为肿胀、热痛和功能障碍[42]。药用植物蒽醌类化合物,如大黄素、芦荟大黄素等具有较好的抗炎活性,可通过下调促炎性细胞因子、抑制激酶的活性进而抑制炎症介质的释放,发挥抗炎作用。研究发现,药用植物大黄、何首乌、茜草中的大黄素是抑制炎症的有效标志物。其中,大黄素可通过促进跨膜蛋白Claudin-5和Occludin的表达,下调促炎性细胞因子TNF-和IL-6的水平,降低胰腺细胞通透性,从而治疗急性胰腺炎[43]。此外,大黄素也可以通过剂量依赖性方式降低重症炎症大鼠的血清淀粉酶和脂肪酶水平,抑制P27/NLRP3信号通路[44]发挥治疗作用。最新研究发现,大黄素可降低急性重症胰腺炎大鼠miR-218a-5p、RhoA、ROCK1、Akt、Bax、Fas、FasL、Caspase-3和Caspase-9的表达水平,提高Notch1、Bcl-2、ZO-1和上皮细胞钙黏蛋白的表达,抑制肠细胞的凋亡,从而治疗炎症引起的肠道功能障碍[45]。药用植物蒽醌类化合物可通过下调炎症信号通路中的蛋白,降低信号网络末端炎症因子的表达,从而发挥抗炎作用。LUO H等[46]提取分离了茜草科巴戟天的有效成分,并成功鉴定出3种新型蒽醌衍生物。3种衍生物均可下调iNOS、COX-2的表达,抑制促炎介质的表达,从而发挥抗炎活性。有研究发现芦荟大黄素亦有较强的抗炎活性,可剂量依赖性地抑制LPS诱导的RAW264.7细胞中iNOS mRNA表达及NO的产生,40 μmol/mL的芦荟大黄素可抑制COX-2 mRNA表达及PGE2的产生[8]。其抑制炎症细胞因子产生的作用机理是通过抑制丝裂原活化蛋白激酶(MAPK),抑制核转录因子-κB(NF-κB)和胞内磷脂酰肌醇3-激酶(PI3K),下调炎症信号通路以发挥抗炎作用[47]。
3.6 抗抑郁 药用植物蒽醌类化合物,如金丝桃素亦具有抗抑郁活性,常应用于抗抑郁治疗。有研究发现金丝桃素可改善大鼠的抑郁症状,且高剂量金丝桃素可激活抑郁大鼠海马体中5-羟色胺受体(5-HT),刺激神经递质传递,提高大鼠兴奋程度。该蒽醌类化合物可降低大鼠抑郁程度[35]。
3.7 其他 除上述药理活性外,游离蒽醌类化合物具有一定的泻下活性,对溃疡性结肠炎[48]和实验性便秘[49]均具有一定治疗作用。
4 结语
药用植物蒽醌类化合物主要存在于大黄、何首乌、虎杖、茜草、巴戟天、决明子、芦荟等药用植物,具有抗癌、抗病原微生物、抗炎、抗骨质疏松、抗氧化、抗抑郁等药理活性。目前,药用植物蒽醌类化合物的研究技术手段多数为传统的提取分离及合成,后续研究可运用生产天然活性次生代谢物技术,从而大批量分离、合成新的蒽醌类化合物;同时后续研究可进行相关酶及基因研究和构效关系研究,运用计算机技术进行蒽醌类化合物结构修饰开发新的具有较强药理活性的单体成分。此外,蒽醌类化合物的结构与其活性密切相关[50]。该研究主要集中在蒽环上取代基与其药理活性的相关性方面,如:蒽环取代基与抗肿瘤活性的相关性研究,蒽醌环上的羟基取代与抗病原微生物活性、抗氧化和抗骨质疏松相关性研究,以及取代基极性与抗菌、抗氧化活性关联性研究。目前研究不够全面,且缺乏其他取代基与活性之间相关性的研究。后续可更深入地进行结构特性与活性的相关性研究,为蒽醌类化合物的开发利用提供科学依据。

