经皮雌激素内膜准备对不明原因反复种植失败患者冻融胚胎移植妊娠结局的影响
周燕 陈楠 张红艳 江美燕 林珍云 费小阳
尽管辅助生殖技术已成为解决不孕不育问题 的主要治疗方式,然而不明原因反复种植失败(unexplained recurrent implantation failure,URIF)仍是辅助生殖技术的一大挑战。在中国,URIF的发病率为5%~11.1%[1,2]。URIF 病因复杂且具有异质性,近年研究指出胚胎发育缺陷、子宫内膜容受性降低、胚胎发育和子宫内膜种植窗不同步是导致URIF的最常见原因[3,4]。冻融胚胎移植(frozen-thawed embryo transfer,FET)可根据子宫内膜准备方案改善内膜环境,准确把握子宫内膜种植窗的开放时间段,改善子宫内膜容受性[5],成为目前改善URIF 妊娠结局的一个重要步骤。目前FET内膜准备方案最常见的有自然周期、激素替代治疗(hormone replacement therapy,HRT)、促排卵方案等[6,7]。HRT因具有便捷性和灵活性的特点,被广泛应用于临床。然而不同的雌激素给药途径可显著改善内膜准备的时间,改善URIF 患者FET 周期中内膜准备的效率[8]。目前临床上多经验性使用口服途径补充雌激素,针对经皮给药途径对URIF 患者FET 妊娠结局的研究仍较少。本次研究回顾性分析URIF 患者的不同雌激素给药方式,探究经皮雌激素内膜准备对URIF患者临床妊娠结局的影响,旨在为URIF患者提供一种更为有效、经济、简便的内膜准备方案,改善妊娠结局。
1 资料与方法
1.1 一般资料 回顾性分析2021年1 月至2022年12 月于杭州市妇产科医院生殖中心诊断为URIF再次行FET 的94 例患者临床资料,年龄24~39 岁。纳入标准为:①年龄<40 岁;②符合URIF 诊断标准[9];③未发现双方染色体异常;④未发现子宫发育畸形或子宫内膜异常;⑤有冷冻的卵裂期或囊胚期的胚胎,本次移植胚胎中至少有1 枚优质胚胎。排除标准为:①患有严重的全身或局部急性炎症;②合并有子宫内膜病变或通过手术宫腔形态无法恢复正常;③任何一方染色体存在异常;④合并有内外科疾病,如甲状腺功能异常、自身免疫性疾病、糖尿病等。选取HRT内膜准备方案,根据雌激素给药方式不同分为实验组(经皮雌二醇凝胶组)33 例和对照组(口服17β-雌二醇组)61 例。两组体重指数、抗苗勒管激素(antimullerian hormone,AMH)、促卵泡刺激素/促黄体生成素(follicle-stimulating hormone/luteinizing hormone,FSH/LH)等一般资料比较见表1。两组比较,差异均无统计学意义(P均>0.05)。
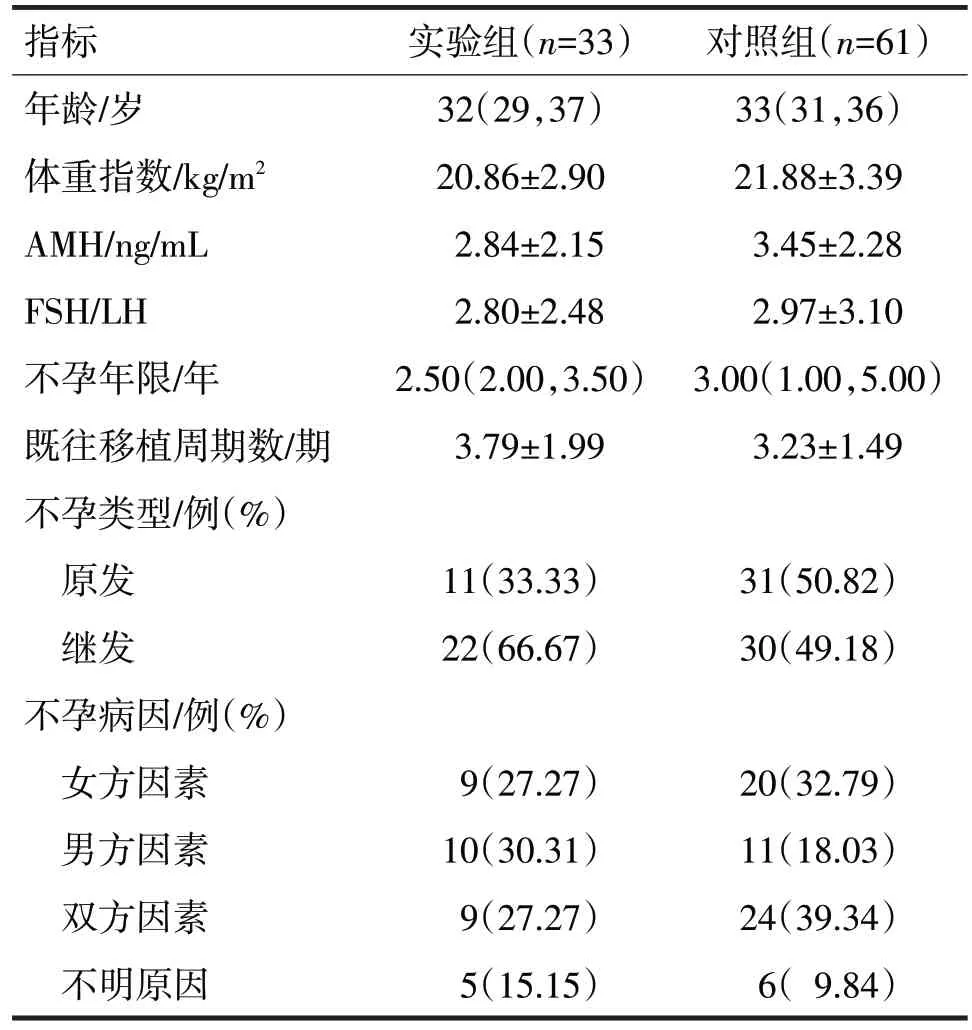
表1 两组一般资料比较
1.2 方法
1.2.1 对照组 月经第3 天开始口服17β-雌二醇(雌二醇片/雌二醇地屈孕酮片复合包装,由美国Abbott Biologicals B.V.生产)2 mg,每日2 次,间隔7 d后根据内膜厚度调整雌二醇剂量。当子宫内膜厚度≥8 mm时,开始内膜转化。
1.2.2 实验组 月经第3 天给予经皮雌二醇凝胶(17β-雌二醇凝胶,由法国Besins 生产)2.5 g,每日2 次,间隔7 d 后根据内膜厚度调整雌二醇凝胶剂量。当子宫内膜厚度≥8 mm时,开始内膜转化。
1.2.3 黄体转化 加用黄体酮针(由浙江仙琚生产)40 mg 肌肉注射,每日2 次,联合地屈孕酮(由荷兰雅培生产)20 mg 口服,每日2 次。内膜转化第4 天移植卵裂期胚胎,转化第6 天移植囊胚。
1.3 监测指标 监测两组转化日雌二醇(estradiol,E2)、转化日孕酮(progesterone,P)、转化日内膜厚度、移植胚胎数、优质胚胎数、临床妊娠率、种植率、多胎妊娠率、流产率、活产率。
1.4 统计学方法 采用SPSS 19.0 统计软件,符合正态分布的计量资料以均数±标准差()表示,组间比较用t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
两组临床妊娠结局比较见表2。
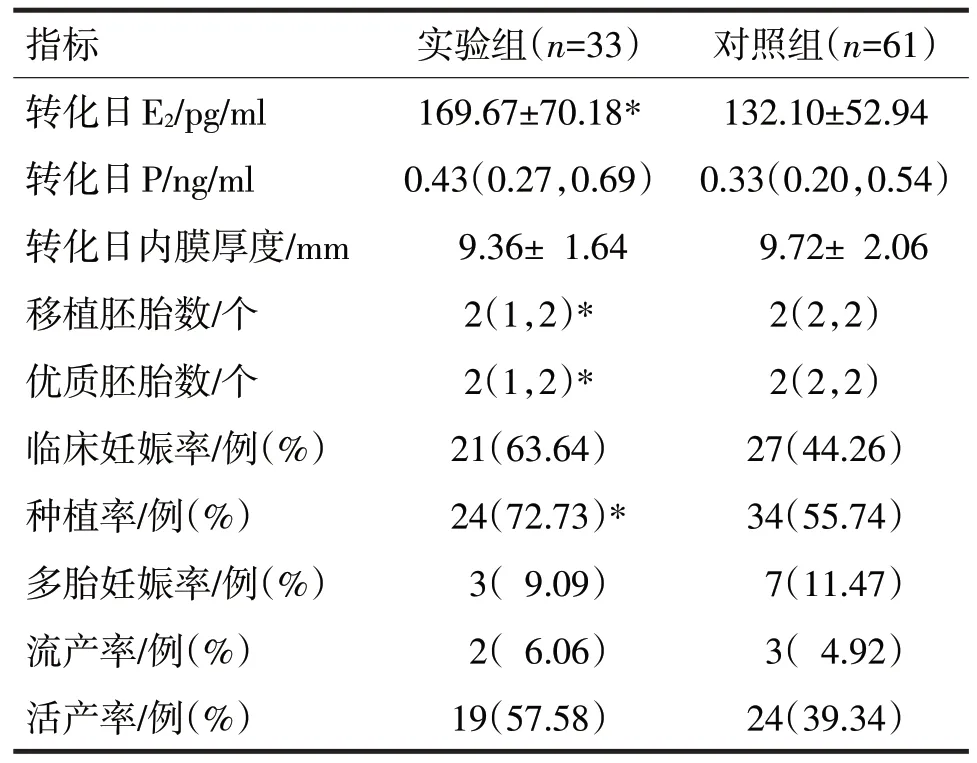
表2 两组临床妊娠结局比较
由表2 可见,实验组转化日E2水平明显高于对照组(t=2.92,P<0.05),两组移植胚胎数及优质胚胎数、种植率比较,差异均有统计学意义(Z分别=3.65、3.67,χ2=6.07,P均<0.05)。但两组间转化日P、转化日内膜厚度、临床妊娠率、多胎妊娠率、流产率、活产率比较,差异均无统计学意义(Z分别=1.19,t=0.85,χ2分别=3.22、0.85、0.03、1.78,P均>0.05)。
3 讨论
胚胎着床是依赖于胚胎和子宫内膜之间的多组分双向信号的微妙协调,受胚胎因素和子宫内膜容受性的双重影响[10,11]。子宫内膜容受性的建立主要由雌激素和孕激素协调[11]。雌激素刺激子宫内膜增生、诱导孕激素受体增加,孕激素诱导产生子宫内膜整合素等关键因子,促进内膜建立种植“窗口期”,决定种植窗口的开启(关闭)时间[12]。在辅助生殖中,雌激素和孕激素的作用已被反复证明对临床妊娠率的影响[13]。许多研究表明,HRT 周期通过外源性补充雌激素,机动调整内膜种植窗开启(关闭)时间,灵活选择胚胎移植的时机,大幅降低移植取消率,已成为目前FET的主流内膜准备方案[14]。
HRT 周期中雌激素有多种不同的给药途径,包括口服给药、经阴道给药、经皮给药等。而针对效果稳定性及对临床妊娠结局影响的研究较少。本次研究纳入经口服给药和经皮给药两种途径的患者,结果显示经皮给药组转化日E2水平明显高于口服给药组(P<0.05),移植胚胎数、优质胚胎数、种植率比较,差异均有统计学意义(P均<0.05),而临床妊娠率未见显著差异,与Scheffer 等[15]研究结果一致。Scheffer 等[15]研究指出雌激素口服给药途径在肝脏和肠道的高代谢率导致雌酮/雌二醇(estrone/estradiol,E1/E2)的比例升高,而经皮给药产生的E1/E2较低,导致经皮雌激素被认为在诱导子宫内膜容受性方面优于口服雌激素,然而临床妊娠率未见显著差异。Garimella等[16]前瞻性研究结果指出口服给药组与经皮给药组的着床率、临床妊娠率、流产率及周期取消率均无显著差异,而经皮给药患者满意度得分显著高于口服给药组,副作用显著低于口服给药组。考虑经皮雌激素与口服雌激素在FET周期中同样有效,并且经皮雌激素具有更好的患者舒适度,副作用更少,安全性更好。Bagot等[17]研究发现,E2水平在经皮和口服途径之间并无差异,但口服途径导致凝血酶生成明显增加,考虑是由于口服雌二醇的主要代谢产物雌酮的肝脏首过代谢所介导,经皮途径可以避免。雌酮对凝血酶生成的影响使口服途径的女性静脉血栓风险增加。Fritz等[18]指出E2与持续妊娠率和活产率显著相关,较高的E2水平可能会导致持续妊娠率和活产率降低。Ma 等[19]研究认为由于高剂量雌激素的凋亡和抗增殖作用导致种植窗口在雌激素水平较低时打开时间较长,而在雌激素水平较高时迅速关闭,提示高雌激素水平可能会显著缩短种植窗口期,加速种植窗口的关闭速度,降低胚胎种植概率。此外,既往研究指出胚胎移植周期中E2水平升高与不良妊娠结局的发生率增加有关[20]。尽管与本次研究结果不一致,但这些研究中大多数患者E2水平显著高于本次研究。因此,通过经皮途径的E2水平有利于在更接近生理的E2水平上进行胚胎种植,增加妊娠概率。
在本次研究中,不同给药途径组间的子宫内膜厚度、临床妊娠率、种植率、多胎妊娠率、活产率、流产率在两组间差异无统计学意义。与Shahrokh等[21]结果一致。Shahrokh等[21]随机对照研究指出经皮给药和口服给药途径组中胚胎移植前子宫内膜厚度和子宫内膜准备时间相似,两组临床妊娠率无显著差异,而经皮给药组流产率更低,持续妊娠率更高。然而由于本次研究纳入样本量较少,仍存在潜在的选择性偏倚。因此后续需通过扩大样本量,开展多中心前瞻性随机对照研究进一步证实本次研究结果。
综上所述,两种给药途径的临床妊娠结局无明显差异。然而对于URIF患者,经皮雌二醇凝胶可获得与口服雌激素相似的临床妊娠结局的同时,可消除肝脏首过效应,降低静脉血栓风险,可成为FET患者激素替代疗法的首选给药方式。

