复合益生菌粉改善小鼠肠道菌群的研究
黄 莹,孙 鑫,黄 晶,杨 晓,陈 曦
中国健康促进基金会抗衰老营养与健康研发中心,湖北 武汉 430100
肠道菌群是指寄居于消化道内的各种微生物的总和,物种类多达1 000 种[1-2]。肠道菌群不仅是我们身体中最重要的微生物群落,同时作为“第二基因组”的肠道菌群,对人体代谢、免疫应答和基因表达均有调节作用[3-6]。肠道菌群作为人体的天然屏障,在抑制有害菌生长繁殖方面发挥着重要的作用[7]。据报道,患肠道疾病的人群数量与日俱增,工业化快发达的欧洲地区,目前将近0.2%的人口都患有肠道疾病[8],近年来随着经济全球化的快速发展,各个国家和地区患肠道疾病的人数都在增加,呈现全球性上升趋势[9-10]。临床研究表明,肠道菌群失调是肠道疾病重要的激发因素之一,主要表现为有益菌群数量减少和有害菌群数量增多[11]。
益生菌是一类对宿主(动物和人)有益的细菌的统称[12]。2019 年3 月国家市场监督管理总局发布的《益生菌类保健食品申报与审评规定(征求意见稿)》明确表明,摄取数量足够的益生菌对宿主健康有益。消费者健康意识的提高促进了益生菌消费市场的大幅度扩大,我国益生菌市场每年都在以15%的年复合增长率增长,预计今年将达到1 420 亿元[13]。益生菌在调节肠道菌群[14]、提高免疫力[15]、润肠通便[16]、维持肠道内环境均衡[17]等方面发挥着重要的作用,同时其在抗氧化[18]、改善血脂异常[19]、缓解骨质疏松[20]、护肝[21]方面的功能也有相关的研究报道。常见的益生菌种类有双歧杆菌和乳杆菌。本实验主要采用七种乳杆菌,即植物乳杆菌550、植物乳杆菌360、鼠李糖乳杆菌S24、植物乳杆菌543、副干酪乳杆菌S6、嗜酸乳杆菌11073、干酪乳杆菌10640,辅以益生元,组成复合益生菌粉,研究其对小鼠肠道菌群的改善作用,为研究益生菌在改善肠道菌群方面的作用提供理论依据。
1 材料与方法
1.1 实验材料
复合益生菌粉原料:混合益生菌粉;辅料:鱼胶原蛋白肽粉、维生素C、赤藓糖醇、麦芽糊精、抗性糊精、岩藻多糖。复合益生菌粉由16.5%的原料和83.5%的辅料混合而成。复合益生菌粉的人体推荐量为2 g/d,按成人60 kg·bw 计为0.033 g/kg·bw。
混合益生菌粉由四川高福记生物科技有限公司提供。主要组成为:植物乳杆菌550、植物乳杆菌360、鼠李糖乳杆菌S24、植物乳杆菌543、副干酪乳杆菌S6、嗜酸乳杆菌11073、干酪乳杆菌10640。其他组成成分均为市售。
伊红美蓝琼脂培养基、BBL 琼脂培养基、TSC 琼脂培养基、TSC 琼脂配套试剂(SR0290)(广东环凯微生物科技有限公司),叠氮钠-结晶紫-七叶苷琼脂培养基、柠檬酸铁铵、Lbs 琼脂(北京路桥生物技术有限公司),氯化钠(国药集团化学试剂有限公司)。
1.2 主要仪器与设备
BPC-250F 生化培养箱(上海一恒科学仪器有限公司)、SW-CJ-1FD 超净工作台(苏净集团苏州安泰空气技术有限公司)、BXM-30R 立式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂)、90 mm×15 mm 一次性培养皿(比克曼生物科技有限公司)、厌氧盒、厌氧袋和厌氧指示剂(日本三菱化学公司)、1 mL 移液枪(德国eppendorf 公司)。
1.3 实验动物
雄性SPF 级Babl/c 小鼠,7 周龄(19~21 g),北京维通利华实验技术有限公司湖北分公司提供(许可证号:SCXK(鄂)2022-0030)。环境温度20~25℃,相对湿度40%~70%。维持饲料购自武汉市万千佳兴生物科技有限公司。
1.4 剂量选择与受试样品给予方式
复合益生菌粉低、中、高剂量组分别按人体推荐量的10 倍(0.333 g/kg·bw)、20 倍(0.667 g/kg·bw)、30 倍(1.000 g/kg·bw)给予,同时设置阴性对照组(给予同体积的纯水)、原料组(0.165 g/kg·bw)和辅料组(0.835 g/kg·bw)。各剂量受试样品的给予方式为经口灌胃,灌胃量为0.1 mL/10 g·bw。
1.5 试验方法
方法来源:《允许保健食品声称的保健功能目录非营养素补充剂(2020 年版)(征求意见稿)》的第十五条,有助于调节肠道菌群功能的检验方法。
1.5.1 实验步骤
在给予受试样品之前,无菌采取小鼠肛门内粪便0.1 g,采用0.85%的氯化钠溶液10 倍系列稀释,选择合适的稀释度分别接种在各培养基上。培养后,从菌落形态、革兰氏染色镜检、生化反应等方面入手,鉴定计数菌落,计算出每克湿便中的菌数,取对数后进行统计处理。
受试样品给予时间14 d 后的24 h 内和给予时间30 d 后的24 h 内,用与实验前相同的方式取直肠粪便,检测肠道菌群,方法同上。
1.5.2 观察指标
体重、双歧杆菌、乳杆菌、肠球菌、肠杆菌、产气荚膜梭菌。各肠道菌群的培养条件如表1 所示。
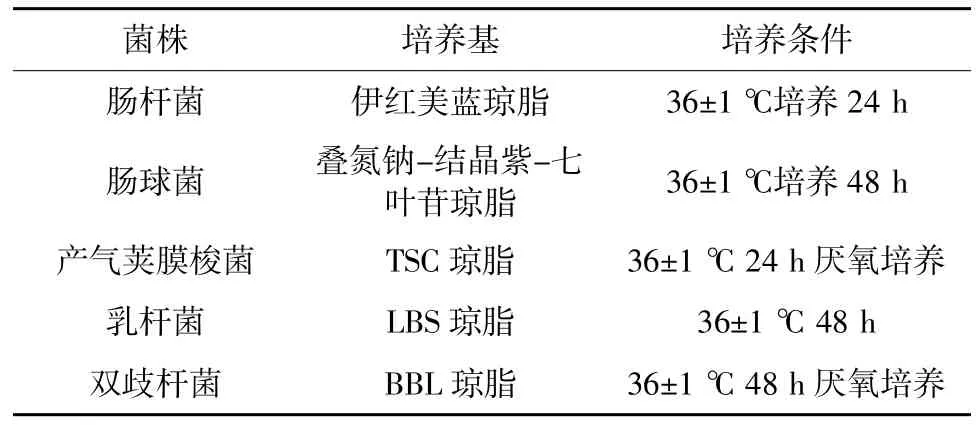
表1 各个肠道菌群的培养条件
1.6 数据处理和结果判定
可以对资料进行方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F 值,F 值<0.05,结论:各组均数间无显著性差异;F 值≥0.05,P≤0.05,用多个实验组和一个对照组间均数两两相比的方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,对转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
2 结果与讨论
2.1 受试样品对小鼠体重的影响
试验期间每周称1 次体重,各期体重及体重增长情况如表2 所示。实验期间,所有小鼠的精神状态、活动、摄食、排泌等均未见明显的异常状况,且体重在持续增长。与空白对照组相比,实验期间各实验组小鼠体重均未见异常。结果表明复合益生菌粉、原料及辅料对小鼠的生长无不良影响。
表2 受试样品对小鼠体重的影响表(,n=10)

表2 受试样品对小鼠体重的影响表(,n=10)
组别干预期体重/g 0 d7 d14 d21 d30 d阴性对照组20.99±0.76 22.77±0.88 23.29±0.96 23.93±1.06 24.77±1.21复合益生菌粉低剂量组21.05±0.79 22.84±0.57 23.30±0.61 24.21±0.75 24.82±0.62复合益生菌粉中剂量组21.20±0.80 22.70±0.83 23.16±0.87 23.87±0.73 24.87±0.73复合益生菌粉高剂量组24.78±1.06原料组21.16±0.65 21.19±0.75 23.10±0.75 23.50±0.83 24.22±0.97 24.66±0.94辅料组21.02±0.68 23.00±0.85 23.65±0.92 23.90±1.00 22.77±0.59 23.46±0.79 24.21±0.99 25.13±1.22
2.2 受试样品对小鼠肠道菌群的影响
2.2.1 受试样品对小鼠粪便肠杆菌菌落数的影响
由图1 可知,与阴性对照组相比,各剂量组干预14 d 和30 d 后,肠杆菌的数量均出现了不同程度的下降,且干预30 d 后复合益生菌粉各剂量组肠杆菌的数量与阴性对照组相比存在显著性差异(P<0.05);各剂量干预30 d 前后肠杆菌的数量存在显著性差异(P<0.05)。复合益生菌粉高剂量组对肠杆菌的生长抑制作用最大,实验发现干预30 d 后肠杆菌数量的下降率达到了73.00%,且复合益生菌粉高剂量组对肠杆菌生长的抑制效果大于原料组和辅料组。

图1 受试样品对小鼠粪便肠杆菌菌落数的影响
2.2.2 受试样品对小鼠粪便肠球菌菌落数的影响
由图2 可知,与阴性对照组相比,各剂量组干预14 d 和30 d 后,肠球菌的数量均出现了不同程度的下降,且干预30 d 后各剂量组肠球菌的数量与阴性对照组相比存在显著性差异(P<0.05);各剂量干预30 d 后肠球菌的数量与干预前存在显著性差异(P<0.05)。复合益生菌粉高剂量组对肠球菌的生长抑制作用最强,实验发现在干预30 d 后肠杆菌数量的下降率达到了31.24%,且对肠球菌的抑制效果大于单独的原料组和辅料组。

图2 受试样品对小鼠粪便肠球菌菌落数的影响
2.2.3 受试样品对小鼠粪便产气荚膜梭菌菌落数的影响
由图3 可知,与阴性对照组相比,各剂量组干预14 d 和30 d 后,产气荚膜梭菌的数量均出现了不同程度的下降,且干预30 d 后各剂量组产气荚膜梭菌的数量与阴性对照组相比,均存在显著性差异(P<0.05);各剂量干预30 d 后产气荚膜梭菌的数量与干预前相比存在显著性差异(P<0.05)。复合益生菌粉中剂量组对产气荚膜梭菌的生长抑制作用最大,实验发现干预30 d 后肠杆菌数量的下降率达到了84.17%,且对产气荚膜梭菌的抑制效果大于单独的原料组和辅料组。

图3 受试样品对小鼠粪便产气荚膜梭菌菌落数的影响
2.2.4 受试样品对小鼠粪便乳杆菌菌落数的影响
由图4 可知,与阴性对照组相比,各剂量组干预14 d 和30 d 后乳杆菌的数量均出现了不同程度的增长,但只有复合益生菌粉中剂量、高剂量组和原料组在干预30 d 后乳杆菌的增长量与阴性对照组存在显著性差异(P<0.05),低剂量组和辅料组无显著性差异(P>0.05);与干预前相比,复合益生菌粉中、高剂量组以及原料组在干预30 d 后,乳杆菌的增长量与干预前相比都存在显著性差异(P<0.05)。复合益生菌粉中剂量组对乳杆菌增长的促进作用最大,增长率达63.77%,且对乳杆菌增长的促进效果大于单独的原料组和辅料组。

图4 受试样品对小鼠粪便乳杆菌菌落数的影响
2.2.5 受试样品对小鼠粪便双歧杆菌菌落数的影响
由图5 可知,与阴性对照组相比,各剂量组在干预14 d 和30 d 后双歧杆菌的数量均出现了不同程度的增长,但是只有复合益生菌粉的中剂量和高剂量组在干预30 d 后乳杆菌的增长数量与阴性对照组存在显著差异(P<0.05);与干预前相比,在复合益生菌粉中、高剂量组干预30 d 后,双歧杆菌的增长数量与干预前相比存在显著性差异(P<0.05)。复合益生菌粉中剂量组对双歧杆菌增长的促进作用最大,增长率达47.74%,且对双歧杆菌的促增长效果大于单独的原料组和辅料组。

图5 受试样品对小鼠粪便双歧杆菌菌落数的影响
3 讨论
比较实验前后各菌种自身及组间双歧杆菌、乳杆菌、肠球菌、肠杆菌、产气荚膜梭菌的变化情况发现,复合益生菌粉在干预前后自身也发生了显著性变化,且干预后与阴性对照组比较也存在显著性差异,主要表现为小鼠粪便中双歧杆菌和乳杆菌明显增加,对乳杆菌的增殖作用更强了,肠杆菌、肠球菌和产气荚膜梭菌明显减少,同时研究发现复合益生菌粉对肠道菌群的改善效果优于单独的原料组和辅料组。
本研究采用含多种乳杆菌的原料与辅料组成复合益生菌粉,大量研究证明乳杆菌在改善肠道菌群方面成效显著,例如Lahtinen 等[22]研究发现鼠李糖乳杆菌和嗜酸乳杆菌对老年人粪便中乳杆菌和艰难梭菌的数量有明显的改善作用。张泽鹏等[23]研究植物乳杆菌对小鼠血脂及肠道菌群的调节作用,发现干预42 d 后,干预组小鼠粪便中大肠杆菌的数量均低于模型组(P<0.05);粪便双歧杆菌和乳杆菌的数量均高于模型组(P<0.05)。刘伟贤等[24]给予小鼠灌胃副干酪乳杆菌K56 菌株,比较干预14 d 前后的菌株数量,发现各组小鼠粪便中的双歧杆菌、乳杆菌、产气荚膜梭菌均显著增加(P<0.05),而肠杆菌和肠球菌则无显著变化(P>0.05)。陈雪等[25]研究植物乳杆菌对雄性小鼠肠道菌群的调节功能,研究结果表明,植物乳杆菌HCS03-001 的中、高剂量组可显著提高小鼠小肠墨汁推进率(P<0.05);植物乳杆菌HCS03-001 高剂量可降低产气荚膜梭菌(P<0.05)、肠球菌(P<0.05)、肠杆菌(P>0.05)的活菌数,同时促进乳杆菌增殖(P<0.05)。同时发现复合益生菌粉对肠道菌群的改善效果优于单独的原料组和辅料组,因为辅料组中的一些益生元成分作为一种不被人体消化的食物成分,通过选择性地刺激肠道内的益生菌生长来对机体产生有益影响,改善机体的健康状况[26]。
研究发现益生菌对肠道有害菌的抑制作用和对有益菌增长的促进作用主要体现为:(1)益生菌可破坏细胞结构和胞内大分子物质、影响DNA 或RNA的活性、竞争病原菌中生长相关物质的结合位点,阻止细胞生长分裂[27]、益生菌黏蛋白的黏附作用和定植以及一定浓度的毒素能够在一定程度上对致病菌产生拮抗作用[28];(2)益生菌可提高小鼠空肠绒隐比,改善其肠道吸收功能;可升高盲肠内容物的总SCFAs 含量,增强肠道的屏障功能,使肠道菌群中的乳杆菌属等有益菌相对增加,对有害菌产生一定的抑制作用,进而调节肠道菌群的分布生长情况,改善肠道内环境[29]。虽然动物实验证明益生菌具有改善小鼠肠道菌群的作用,但是涉及益生菌对人体肠道菌群改善作用机理的研究仍需要使用更复杂的模型去预测作用机制并开展更严格的临床试验去证实,本研究为后续益生菌制剂调节肠道微生态的探索提供了理论支持。

