希拉穆仁荒漠草原围封区植物群落土壤有机碳研究
魏亚娟, 刘美英, 解云虎, 高玉寒, 刘美萍, 悦普庆, 刘澜波
(1.包头师范学院资源与环境学院, 内蒙古 包头 014030; 2.内蒙古农业大学 草原与资源环境学院,内蒙古自治区土壤质量与养分资源重点实验室, 呼和浩特 010018; 3.内蒙古自治区包头市气象局, 内蒙古 包头 014030)
草地生态系统作为陆地三大生态系统之一,具有巨大的固碳能力[1]。我国草原面积约为4.0×108hm2,占全国总面积的40%以上,且草地生态系统约80%的碳储存于土壤中[2]。随着全球气候变暖,草原生态系统中的土壤有机碳对气候变化比较敏感。因此,草原的合理利用与发展对土壤碳汇起着重要作用。而且,在全球气候变暖背景条件下,草原土壤有机碳的分布特征及其影响因素已成为全球研究热点[3]。
近年来,学者们针对围封区土壤有机碳的研究较多。学者们研究发现,土壤有机碳主要受植被群落自身特征、凋落物、分泌物和土壤理化性质等因素影响[4-8]。由于植被与土壤具有互动效应。植被对土壤影响主要来源于3个方面。其一,不同植被类型下,植被群落组成、多样性会直接或间接影响有机碳的分解速率和分解模式,进而影响土壤有机碳含量[4-5];其二,植物死亡或枯萎,凋落物分解会影响有机碳输入质量和数量,进而影响有机碳累积;其三,植物根系作为植物和土壤进行物质交换和能量流动的纽带,植物将光合作用固定的CO2以根系分泌物的形式释放到土壤中[6]。另外,根系死亡经过土壤微生物的分解将有机物释放到土壤中。还有研究得出,土壤机械组成、水分、容重和速效养分含量等会影响土壤微生物活性进而影响土壤有机碳含量[7-8]。因此,草原有机碳含量的差异及其影响机制是否由植物群落决定有待于进一步明晰。
希拉穆仁草原位于阴山北麓属典型荒漠草原,是草原向荒漠的过渡带[9]。该区域降雨稀少、季风强劲,土壤侵蚀严重,导致该地区生态环境脆弱。加之草原植被结构简单、结构稳定性差,容易遭受破坏。近年来,随着国内旅游业的大力发展使草原生态环境严重破坏,造成草原破碎化,地表板结程度较高和地表粗粒化[10]。目前,关于希拉穆仁草原的研究多集中在地表风蚀特征[11-12]、植被群落特征[13]、土壤理化性质[14-15]。这些研究在一定程度上揭示了草原土壤、植物生长变化规律。然而,针对不同植被群落的研究相对较少。基于此,本研究以希拉穆仁草原围封区6种植物群落(短花针茅(Stipabreviflora)、洽草(Koeleriacristata)、羊草(Leymuschinensis)、克氏针茅(Stipakrylovii)、银灰旋花(Convolvulusammannii)、蒙古韭(Alliummongolicum))为研究对象,通过对各植被群落0—30 cm土壤机械组成、根系分布、有机碳变化特征及三者间相互关系进行研究,以期为当地围封禁牧提供一定的科学依据。
1 材料与方法
1.1 研究区概况
研究区位于希拉穆仁草原围封区(110°00′—110°20′E,41°12′—41°31′N),围封时间为14 a,围封面积为133 hm2。海拔在1 642 m左右,该区属中温带半干旱大陆性季风气候,年均降雨量约为281 mm,且主要集中在7—9月,占全年降雨量的55%以上。该区域蒸发量年际变化大,蒸发量在2 305 mm;年均气温在2.5℃。风沙天气多发生在春、冬两季,且主要以北风和西北风为主,年均风速在5.2 m/s左右。土壤类型主要以栗钙土和棕钙土为主,土层厚度在30~80 cm。植物结构类型简单,多以旱生、中旱生植物为主。优势植物为克氏针茅和冷蒿(Artemisiafrigida)。围封前,对围封区进行定点植被调查和土壤理化性质测定,如表1和表2所示。

表1 围封前希拉穆仁草原土壤特征Table 1 Soil characteristics of Xilamuren grassland before enclosure

表2 样地基本情况调查Table 2 Basic situation questionnaire
1.2 研究方法
1.2.1 样地布设 于2018年8月中旬,在围封区内,沿东西方向布设8条长300 m的样线,每条样线相隔50 m。每条样线分别设置6个1.0 m×1.0 m的样方,共设置样方48个。首先,根据样方内优势种特征,对每个样方内植物种数量、平均高度、盖度、地上生物量、枯落物进行测定,以便调查植物群落变化。然后在每个样方内,将地表杂物清除后,按五点法用根钻分别钻取0—5,5—10,10—20,20—30 cm的土样,将取出的根土混合样品装入自封袋带回实验室。在根系取样的同时,用环刀取每层土壤样品,并称鲜重用于土壤含水量、土壤容重测定;同时每层另取一份土样与同一植物群落其他样方和土层深度土样均匀混合后,用于机械组成和有机质的测定。
1.2.2 根系生物量测定 将根系土壤样品带回实验室,置于0.05 mm网筛上进行冲洗,直至将根系上的土壤冲洗干净,冲洗过程中将根系中的杂质和黑色死根挑拣干净,用吸水纸吸干根系表面水分。最后,将不同土层活根系分别装入信封内放入65℃烘箱内连续烘干48 h至恒重,以便获得根系生物量。
1.2.3 土壤理化性质测定 土壤容重用环刀法进行测定,土壤水分采用烘干法进行测定[16]。土壤粒度采用美国制[17],分别为黏粒(<2 μm)、粉粒(2~50 μm)、极细粒(50~100 μm)、细砂(100~250 μm)、中砂(250~500 μm)、粗砂(500~1 000 μm)、极粗砂(1 000~2 000 μm)和砾石(>2 000 μm)。土壤有机碳用浓硫酸—重铬酸钾氧化法测定[18]。
1.3 数据处理
利用Excel对数据进行统计整理。用SPSS 20.0对不同植物群落各土层土壤机械组成、土壤容重、水分、根系生物量和土壤有机碳进行单因素方差分析(ANOVA),再利用最小显著差异法(LSD)进行显著性检验(p<0.05)。并对各指标进行相关分析。最后,利用Origin 2021作图。
2 结果与分析
2.1 不同植物群落土壤机械组成特征
由表3知,6种植物群落0—30 cm土层土壤机械组成主要以粉粒和极细砂为主,其平均值分别介于26.50%~54.62%和16.90%~34.08%之间。粉粒平均值大小由大到小依次为:短花针茅(54.62%)>洽草(40.75%)>银灰旋花(36.89%)>羊草(27.48%)>克氏针茅(27.44%)>蒙古韭(26.50%);极细砂平均值由大到小依次为:银灰旋花(34.08%)>羊草(32.06%)>蒙古韭(30.47%)>短花针茅(25.16%)>洽草(23.57%)>克氏针茅(16.90%)。短花针茅和洽草各土层含有少量土壤黏粒,含量在0.08%~0.24%。表明土壤细粒结构越好,有利于水分的保存。

表3 不同植物群落土壤机械组成Table 3 Soil mechanical composition of different plant communities
2.2 不同植物群落土壤容重和水分变化特征
土壤是植物生长发育的载体,其土壤物理性质影响着植物的生长发育。由图1A知,各植物群落土壤容重平均值介于1.34~1.57 g/cm3。克氏针茅、羊草、洽草、短花针茅土壤容重随土层深度增大,而蒙古韭、银灰旋花土壤容重随土层深度呈先减小后增加的趋势。在0—5 cm,洽草土壤容重与克氏针茅差异不显著(p>0.05),与其他群落差异显著(p<0.05);在5—10 cm,洽草与羊草差异不显著(p>0.05),与其他群落差异显著(p<0.05);在10—30 cm,洽草与克氏针茅、短花针茅差异显著(p<0.05),说明围封降低了希拉穆仁草原土壤容重(表1),其中以羊草与洽草效果最明显。

注:不同大写字母表示同一植物群落不同土层深度之间的显著差异(p<0.05);不同小写字母表示同一土层深度不同植物群落之间的显著区别(p<0.05)。
土壤水分是影响植物生长发育的主要因子之一。由图1B知,除银灰旋花和克氏针茅外,其余植物群落均呈先增大后减小的趋势。各植物群落土壤水分平均值介于5.68%~8.28%。在0—5 cm,蒙古韭土壤水分含量最低,为6.88%,与克氏针茅差异不显著(p>0.05),与其他植物群落差异显著(p<0.05);在5—10 cm,银灰旋花与克氏针茅差异不显著(p>0.05),与其他植物群落差异显著(p<0.05);在10—20 cm,短花针茅与洽草、羊草差异不显著(p>0.05),与其他植物群落差异显著(p<0.05);在20—30 cm,短花针茅与银灰旋花、克氏针茅差异显著(p<0.05),与其他植物群落差异不显著(p>0.05)。表明围封增加了土壤含水量(表1),其中以羊草和短花针茅土壤含水量增加幅度最大。
2.3 不同植物群落根系分布特征和空间构型
由图2知,不同植物群落根系生物量随土层深度逐渐减小,且根系生物量总量依次表现为:洽草(731.71 g/m2)>羊草(356.16 g/m2)>克氏针茅(305.73 g/m2)>蒙古韭(299.74 g/m2)>短花针茅(268.00 g/m2)>银灰旋花(229.21 g/m2),最大值是最小值的2.19倍。在0—5 cm和5—10 cm土层,洽草与各植物群落差异显著(p<0.05)。在10—20 cm土层,银灰旋花与其他植物群落差异显著(p>0.05);在20—30 cm土层,各植物群落差异不显著(p>0.05)。说明各植被群落根系生物量主要集中在0—5 cm土层,占总根系生物量的58.41%~70.59%。为有机碳的输入准备了条件。
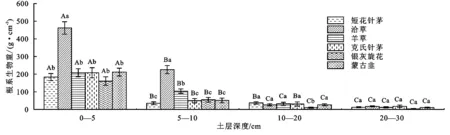
注:不同大写字母表示同一植物群落不同土层深度之间的显著差异(p<0.05);不同小写字母表示同一土层深度不同植物群落之间的显著区别(p<0.05)。
植物根系生物量的空间差异性影响着地上生物量的变化与稳定。由图3知,短花针茅根系垂直空间分布呈“E”型,即:根系生物量呈锯齿状分布;其他植物群落呈“V”型,即:植物根系生物量自上而下呈倒金字塔型分布。

图3 不同植物群落根系空间分布
2.4 不同植物群落有机碳特征
土壤有机碳是是衡量土壤肥力的重要指标,土壤有机碳的分解和积累影响着土壤肥力。由图4知,各植物群落土壤有机碳含量随土层深度逐渐降低,说明有机碳具有明显的表聚作用。0—30 cm土层平均有机碳含量依次为:洽草(11.75 g/kg)>羊草(8.41 g/kg)>短花针茅(7.54 g/kg)>蒙古韭(7.17 g/kg)>克氏针茅(7.14 g/kg)>银灰旋花(6.07 g/kg),最大值是最小值的0.94倍。在0—5 cm和5—10 cm土层,最大值和最小值分别为洽草和银灰旋花。最大值分别是最小值的0.83倍和1.48倍。在10—20 cm和20—30 cm土层,最大值和最小值分别为洽草和克氏针茅,最大值分别是最小值的0.94倍和0.69倍。

注:不同大写字母表示同一植物群落不同土层深度之间差异显著(p<0.05);不同小写字母表示同一土层深度不同植物群落之间差异显著(p<0.05)。
2.5 不同植物群落根系生物量与土壤机械组成、有机碳含量相关性研究
由表4可知,各植物群落根系生物量、土壤有机碳与黏粒呈极显著正相关,与粉粒呈显著正相关,表明土壤粉粒、黏粒含量越多,不同植物群落根系生物量和土壤有机碳越丰富。土壤水分与粉粒呈显著相关,与粗砂和极粗砂呈显著负相关,说明土壤粉粒增多,有利于土壤保持水分,土壤粗粒和极粗粒增多,不利于土壤水分保持。土壤容重与根系生物量、土壤有机碳分别呈极显著负相关。此外,研究中还发现,植物根系生物量与土壤有机碳呈极显著正相关,表明不同植物根系有利于增加土壤养分含量。
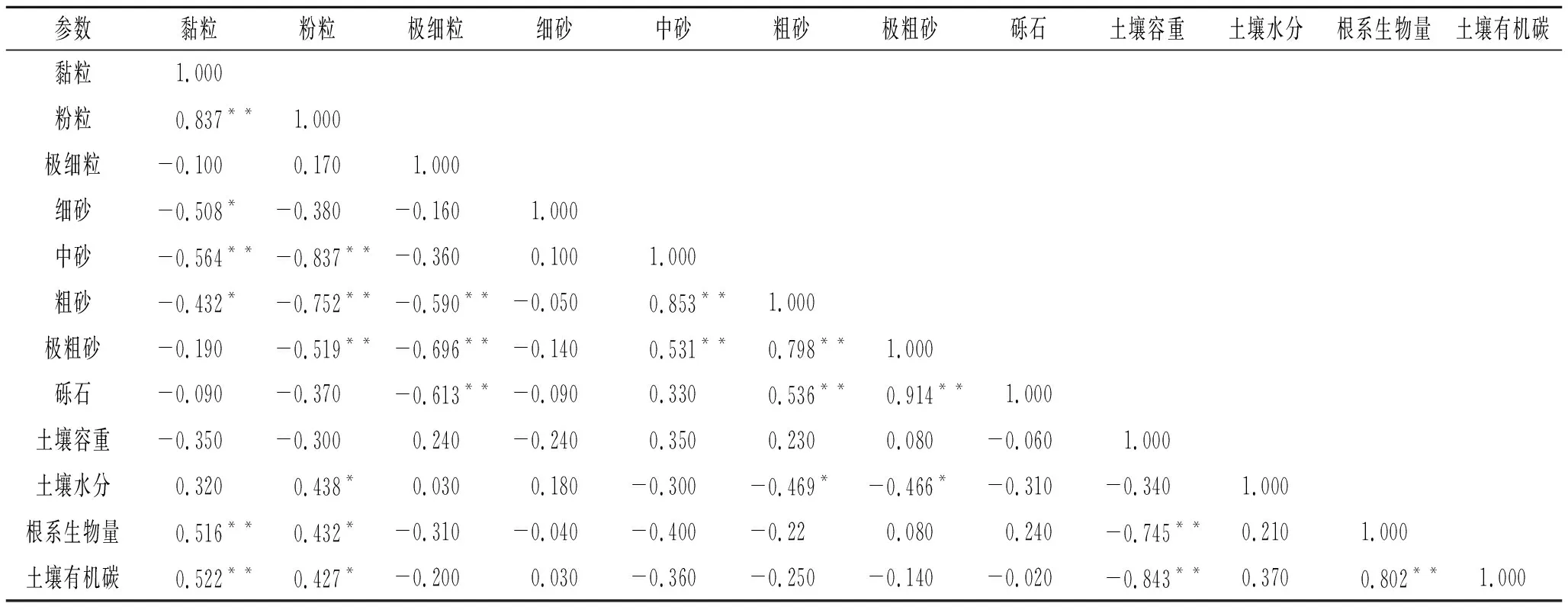
表4 土壤机械组成与根系生物量、土壤有机碳的相关关系Table 4 Relationships between soil mechanical composition, root biomass and soil organic carbon
3 讨 论
土壤机械组成不仅改变植物根系分布和营养吸收,而且影响着土壤结构和土壤通透性。本研究中,与20—30 cm相比,银灰旋花0—5 cm土壤黏粒和粉粒分别减少61.54%和21.99%,砂粒增加18.78%。由此可知,银灰旋花群落退化较为严重,地表出现了风蚀,导致表层细粒物质被搬运,从而使地表颗粒组成粗粒化[19-20]。由于银灰旋花属指示草原退化的植被,说明在草地围封14 a后,部分地区呈现出斑块状态[21]。短花针茅、洽草群落表层土壤黏粒分别增加13.33%,166.67%。而其他植物群落表层土壤粉粒分别增加3.71%~444.54%,砂粒分别减少1.22%~58.18%。土壤细粒物质增加,增强了地表土壤的抗侵蚀能力。相关分析发现,土壤黏粒和粉粒与土壤有机碳呈极显著或显著正相关,说明黏粒和粉粒增加有利于有机碳输入。
本研究发现,除银灰旋花、蒙古韭外,其他植物群落土壤容重均随土层深度增大,这可能与群落根系生物量有关。因为植物根系通过克服土壤机械阻力不断向下和周边延伸生长,导致土壤孔隙度增加。为微生物的繁殖和土壤养分的积累奠定了基础[7]。而且,与20—30 cm相比,银灰旋花表层土壤容重增加1.25%,其他植物群落分别减小4.73%~32.76%。这不利于土壤有机碳积累。因为土壤容重增加,导致孔隙度降低,土壤通气性和透水性变差,不利于枯落物转化为土壤有机碳。相关分析发现土壤容重与土壤有机碳呈极显著负相关,也证明了这一点[9]。土壤水分影响着植物对土壤养分的吸收与利用。本研究中,除短花针茅外,其他植物群落较20—30 cm相比,表层土壤水分增加4.50%~72.70%。根据相关分析发现土壤水分与土壤粉粒呈显著相关,说明土壤粉粒增加,有利于土壤蓄积水分,为土壤有机碳矿化和植被恢复奠定了良好的基础。
植物根系是土壤有机碳的重要来源,对提高土壤质量具有重要意义[22]。本研究发现,各群落植物根系整体由上至下逐渐减小,且植物根系主要存在于0—5 cm土层,占总植被生物量的58.42%~70.59%,说明各植物群落主要存在于土壤表层,且各植物群落根系在空间分布上具有差异性。而且,除短花针茅群落根系呈“E”型分布,其他植物群落均呈“V”型分布。这主要与植物自身遗传特征有关,该研究结果与魏巍等[23]对西藏高原不同草地类型的研究结果相同。相关分析发现,根系生物量与黏粒和粉粒呈极显著或显著正相关,与土壤容重呈极显著负相关。该结果与牛存洋等[24]对固沙植物的研究结果不同,其研究表明水分不是限制植物群落根系生物量的主要因子。这主要是因为土壤细粒物质增加,改善了土壤结构,增加了土壤孔隙度,同时降低了土壤容重,为土壤有机碳矿化提供了条件。
土壤有机碳是土壤养分的重要来源,其质量和数量直接影响土壤潜在生产力,是衡量土壤肥力水平的基础。本研究中,各植物群落土壤有机碳差异显著。这主要因为各植物群落其生长特征、根系生物量不同,导致地表枯落物和根系微生物不同,从而使土壤有机碳输入和输出产生差异[25]。通过相关分析发现土壤有机碳与根系生物量呈极显著正相关,再一次证明了植物群落根系是土壤有机碳主要驱动因子。尤其,银灰旋花显著小于短花针茅、洽草、羊草和克氏针茅4种禾本科植物,这主要是因为禾本科植物具有更好的净光合固碳效率,具有更高的凋落物和有机碳输入[26]。本研究发现各植物群落土壤有机碳整体随土层深度逐渐减小,与土壤根系生物量变化趋势相同。尤其0—5 cm土壤含碳量占总含量的29.11%~37.75%。造成此现象主要有3个原因。其一,土壤表层黏粉粒含量增加,而黏粉粒能通过黏粒胶体的吸附对土壤有机碳起到保护作用,减少微生物对有机碳的分解和增加碳汇能力[6];其二,植物根系分泌的物质能促进微生物活动,增加土壤有机碳含量;其三,由于各植物群落土壤表层累积大量的枯落物,其分解增加土壤有机碳的输入,增加土壤储碳能力[27]。
4 结 论
(1) 各植物群落土壤容重和水分平均值分别介于1.34~1.57 g/cm3,5.68%~8.28%之间。尤其银灰旋花土壤容重最大,不利于土壤有机碳积累。
(2) 6种植物群落根系生物量随土层深度逐渐减小,且根系生物量总量介于229.21~731.71 g/m2。植物群落根系多集中于0—5 cm土层,占总根系生物量的58.42%~70.59%。
(3) 各植物群落土壤有机碳具有明显的表聚作用。0—30 cm土层平均有机碳含量介于6.07~11.75 g/kg。尤其洽草群落土壤有机碳含量最高。
(4) 根系生物量、土壤有机碳含量与黏粒含量呈极显著正相关,与粉粒含量呈显著正相关,表明土壤粉粒、黏粒含量越多,植物群落根系生物量和土壤有机碳越丰富。

