乳粉中沙门氏菌检测能力验证分析
王文洁,李 莹
(谱尼测试集团股份有限公司,湖北武汉 430000)
微生物污染是影响食品安全的最主要因素,其中致病性细菌对食品安全构成的危害是最显著的生物性危害[1]。食源性致病菌是以食品、水为传播媒介引起食物中毒的致病性细菌[2]。在食品生产、加工、贮藏、运输和销售过程中,若不能采取有效的控制方法,食源性致病菌会在任何一个环节引起食品污染,从而引发食品腐败变质,导致人类食物中毒等各种疾病,严重威胁人们的身体健康[3-4]。据世界卫生组织统计,食源性致病菌导致全球每年约6 亿人患病,42 万人死亡[5]。常见的食源性致病菌主要有沙门氏菌(Salmonella)、单核细胞增生李斯特氏菌、金黄色葡萄球菌、致泻大肠埃希菌、蜡样芽胞杆菌、副溶血性弧菌等[6]。沙门氏菌普遍存在于自然界中,是欧盟认定的第二大常见的人畜共患病致病菌[7],也是全球腹泻疾病中导致人类死亡的第三大原因[8]。其主要寄生在人类和动物的肠道中,能引起发热、恶心、呕吐和腹泻等症状,对人类健康和食品加工产业造成严重损失[4,9-10]。因此,沙门氏菌的检测需要高度重视。
检测机构需要对实验室进行质量控制以保证检测结果的准确性。能力验证是保证检测质量的必要手段[11-12],可以用于评估实验室人员的技术能力,其结果直接影响到检验报告的准确性和质量[13-14]。能力验证不仅可以促进实验室发现问题,及时采取纠偏措施,还可以提高实验室检验检测水平[15]。因此,实验室参加了由中国食品药品检定研究院组织的NIFDC-PT-323 乳粉中沙门氏菌检验能力验证项目,采用国标《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)的方法对2 份样品进行检验,分析总结能力验证试验过程及结果,以期为沙门氏菌相关检测提供参考依据。
1 材料与方法
1.1 样品来源
实验室收到2 份中国食品药品检定研究院组织的NIFDC-PT-323 乳粉中沙门氏菌检验能力验证发放的待测样品,每份样品由1 个白色菌球和1 袋约25 g 奶粉基质组成,2 份待测样品的编号分别为7 号和59 号。
1.2 培养基及试剂
缓冲蛋白胨水(Buffered Peptone Water,BPW)、四硫磺酸钠煌绿增菌液基础(Tetrathionate Broth Base,TTB)、亚硒酸盐胱氨酸增菌液(Selenite Cystine Broth,SC)、亚硫酸铋琼脂(Bismuth Sulfite Agar,BS)、木糖懒氨酸脱氧酸盐琼脂(Xylose Lysine Desoxycholate Agar,XLD)、沙门氏菌显色培养基(Salmonella Chromogenic Agar,SA)、营养琼脂(Nutrient Agar,NA)、三糖铁琼脂(Triple Sugar Iron Agar,TSI)、沙门氏菌干制生化鉴定试剂盒,均为北京路桥技术股份有限公司提供;沙门氏菌诊断血清(A-F),宁波天润生物药业有限公司提供。
1.3 仪器与设备
BSP-400 型生化培养箱,上海博迅医疗生物仪器股份有限公司产品;DH6000BⅡ型电热恒温培养箱,天津市泰斯特仪器有限公司产品;SX-700 型蒸汽灭菌器,日本TOMY 公司产品;BSC-1604ⅡA2 型生物安全柜,苏州安泰空气技术有限公司产品。
1.4 标准菌株
鼠伤寒沙门氏菌(ATCC 14028),广东省食品微生物安全工程技术研究开发中心提供。
1.5 试验方法
1.5.1 样品前处理及预增菌
在生物安全柜内开启西林瓶,取225 mL 无菌BPW 增菌液加入到无菌均质袋中,并将西林瓶内小球加入到BPW 增菌液中,充分溶解。将对应编号的奶粉基质加入到上述BPW 增菌液中,充分均质混匀。同时,将鼠伤寒沙门氏菌(ATCC 14028)加入BPW 中作为阳性对照,不加任何物质的BPW 作为空白对照。将7 号、59 号样品、空白对照和阳性对照均放入生化培养箱中,于36 ℃条件下培养18 h。
1.5.2 选择性增菌
取出预增菌培养物,轻轻摇晃,分别吸取1 mL于10 mL TTB 和10 mL SC 选择性增菌液中,TTB 于42 ℃条件下培养24 h,SC 于36 ℃条件下培养24 h。
1.5.3 分离
将培养后的TTB 和SC 选择性增菌培养物取出,混匀,分别取1 环划线BS、XLD、SA 琼脂平板,将BS 于36 ℃条件下培养48 h,XLD 和SA 于36 ℃条件下培养22 h。
1.5.4 生化鉴定
根据菌落特征,挑取BS、XLD、SA 琼脂平板上的可疑菌落于NA 平板上纯化,于36 ℃条件下培养24 h。打开沙门氏菌生化鉴定试剂盒,在试剂盒的长条槽中加入1 mL 无菌水。挑取纯化的单菌落于TSI 斜面划线,底层穿刺。同时,用接种环挑取同一单菌落至适量无菌水中,制成0.5 麦氏浊度的均一菌悬液,分别吸取200 μL 菌悬液于试剂盒的圆孔中,向赖氨酸脱羧酶和KCN 试验孔中滴加2~3 滴液体石蜡覆盖培养基表面,与TSI 生化管一同于36 ℃下培养箱中培养,氰化钾试验若24 h 仍为阴性,可延长培养至48 h 再观察结果。
1.5.5 血清学鉴定
将符合沙门氏菌生化现象的菌落进行血清凝集试验。在无菌培养皿上滴加1 滴生理盐水和沙门氏菌诊断血清(A-F),用一次性无菌接种环从NA 平板上挑取单菌落于诊断血清中轻轻混匀,观察是否有颗粒状的凝集现象。生理盐水无凝集证明该菌落无自凝集现象。
2 结果与分析
2.1 预增菌与增菌结果
预增菌及增菌结果见表1。

表1 预增菌及增菌结果
由表1 可知,经培养后,编号7、编号59、阳性对照的BPW 均变浑浊,空白对照保持澄清状态。除空白对照保持澄清,编号7、编号59、阳性对照的TTB 和SC 均为浑浊状态,且编号7 和编号59 的TTB 变黄,SC 变红。
2.2 选择性平板分离结果
选择性平板分离菌落特征见表2。

表2 选择性平板分离菌落特征
由表2 可知,阳性对照中的菌落特征均符合沙门氏菌,空白对照无菌落生长。编号为7 的样品在BS 上呈现2 种菌落形态,一种为棕褐色菌落,周围培养基呈棕色;另一种为灰绿色菌落,在XLD 和SA上仅呈现1 种菌落形态,分别为周围培养基变黄的黄色菌落和蓝绿色菌落。编号为59 的样品在BS 上也呈现2 种菌落形态,分别为周围培养基为黑色带金属光泽的黑色菌落和灰绿色菌落,在XLD 上为带黑色中心的粉红色菌落,在SA 存在2 种菌落形态分别为蓝绿色菌落和紫红色菌落。根据GB 4789.4—2016 中的表1:沙门氏菌属在不同选择性琼脂平板上的菌落特征和沙门氏菌显色培养基说明书可知,7 号样品在BS 和XLD 的菌落属于可疑菌落,在SA 上的蓝绿色菌落不属于可疑菌落;59 号样品在BS 和XLD 的菌落为可疑菌落,在SA 上的紫红色菌落属于可疑菌落。
2.3 生化鉴定结果
生化鉴定结果见表3。
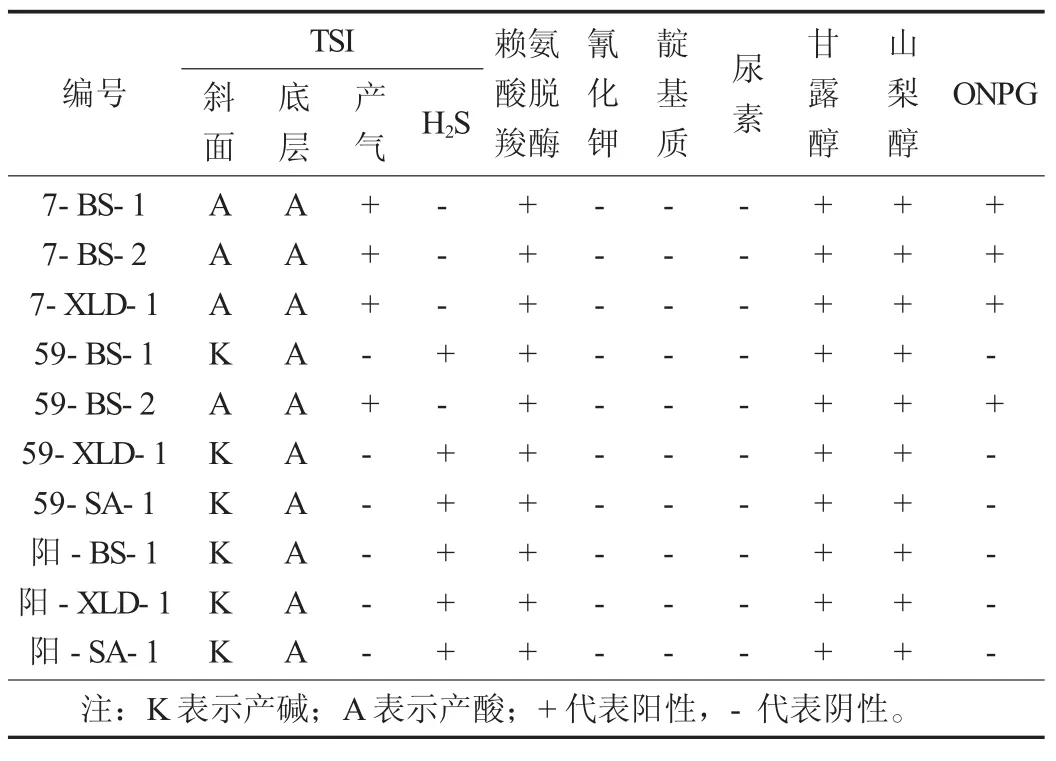
表3 生化鉴定结果
经鉴定,编号7 在BS 和XLD 上的可疑菌落(7-BS-1、7-BS-2、7-XLD-1)的生化现象完全相同,均为TSI 的斜面产酸、底层产酸、产气、不产H2S,赖氨酸脱羧酶阳性、氰化钾阴性、靛基质阴性、尿素阴性,甘露醇阳性、山梨醇阳性,但ONPG试验结果为阳性,故鉴定为非沙门氏菌。编号59 在BS、XLD、SA 上的可疑菌落(59-BS-1、59-XLD-1、59-SA-1)的生化反应现象为TSI 的斜面产碱、底层产酸、不产气、产H2S,赖氨酸脱羧酶阳性、氰化钾阴性、靛基质阴性、尿素阴性,甘露醇阳性、山梨醇阳性、ONPG 试验阴性,与阳性对照的结果一致,属于典型反应,判定为沙门氏菌。
2.4 血清凝集结果
为进一步对生化鉴定结果进行确认,对所有鉴定为沙门氏菌的菌落进行血清凝集试验。
血清鉴定结果见表4。

表4 血清鉴定结果
由表4 可知,所有菌落在生理盐水中均不凝集,排除了菌落的自凝集现象,而在O 多价血清(A-F)中均凝集,与生化鉴定结果一致。
3 结论
综合上述试验结果,判定7 号样品在选择性培养基上的可疑菌落不属于沙门氏菌,59 号在BS 上的周围培养基为黑色,带金属光泽的黑色菌落、XLD 上带黑色中心的粉红色菌落、SA 上的紫红色菌落为沙门氏菌。报告7 号样品未检出沙门氏菌,59 号样品检出沙门氏菌,能力验证组织单位报告结果为满意。通过此次能力验证试验,总结了以下几点注意事项,以便指导日常检测工作。①收到能力验证样品后,首先检查样品是否存在破损、污染、密封性不强等问题,如发现问题及时与机构联系。若不能及时进行试验,需按照作业指导书中的要求储存样品。②试验所用设备应经校准合格,且在校准期间范围内。③在整个试验过程中,需保证所用培养基、试剂、耗材的无菌状态,可采用化学指示带对其灭菌效果进行监测,避免因其污染造成假阳性结果。④所用培养基温度不能过高,否则会灭活样品中的目标菌,造成样品假阴性结果。⑤制备平板时,培养基温度需适宜。若温度过高,一方面会使对热敏感的活性成分失活;另一方面会导致培养基内的水分蒸发到皿盖内侧,降低了培养基的湿度。而且,皿盖上的蒸汽经冷凝会滴落在培养基上,不利于单菌落的形成。若温度过低,培养基会凝固成块,不易制成平板,且培养基质地不均匀。⑥检测样品时,应按照空白对照、样品、阳性对照的顺序独立进行试验,防止样品交叉污染及阳性对照污染样品,保证结果的准确性。⑦在BS 和XLD 上,沙门氏菌呈现多种形态,而在沙门氏菌显色培养基上,沙门氏菌仅呈现紫红色一种状态。沙门氏菌显色培养基能有效区分目标菌和干扰菌,可以考虑将其作为日常沙门氏菌检测中的首选培养基,从而节省人力、物力和时间成本。⑧在选择性平板上需进行多区分离划线,避免因菌落弥漫生长导致无法观察完整菌落形态,从而影响后续鉴定试验。⑨在此次试验中发现SA 培养时间过长,平板上的菌落会由蓝绿色变为紫色,影响结果判断。因此,SA 的培养时间需严格按照说明书要求。⑩挑取菌落时,对于非典型但可疑的菌落,需要耐心进行后续鉴定试验,不可轻易得出结论。对于初筛疑似阳性后续鉴定为阴性的菌落,需要挑取多个可疑菌落进行鉴定,避免样品漏检。⑪挑取的可疑菌落可以选择先在NA 上进行纯化培养,取纯化培养后的菌落同时进行TSI、赖氨酸脱羧酶、氰化钾、靛基质、尿素、甘露醇、山梨醇、ONPG 试验。一方面可以避免选择性平板对生化结果的影响,另一方面可以解决菌落量不够接种的问题,同时缩短了试验周期。⑫进行KCN 试验时,应避免菌悬液的浓度过高,否则会导致对照孔和试验孔均为浑浊状态,导致KCN 假阳性结果。⑬整个试验过程需在生物安全柜中进行,防止样液外溢,避免操作人员被感染。操作结束后,对生物安全柜进行灭菌,并将培养物进行无害化处理,避免污染环境。⑭在做血清凝集试验时,应采用生理盐水作为对照排除菌落自凝集现象,避免造成血清凝集假象。
实验室能力验证是利用实验室间比对来确定实验室检测能力的活动,是检验实验室检测水平的一项重要方式[16]。通过能力验证,实验室对沙门氏菌的检测能力得到了认可,同时积累了相关检验经验,提高了技术水平,为增强实验室综合实力奠定了基础。但是,此次试验也存在一些不足之处,因为缺少相关血清,实验室未对检出的沙门氏菌做血清分型项目,在今后的工作中还需加强相关检测能力。此外,实验室仅采用一种方法对沙门氏菌进行检测,在以后的试验中可以采用分子检测技术、免疫检测技术、全自动细菌鉴定系统等方法与国家标准法结合[6,17],以提高检测质量和效率。

