清酱香型白酒糟酚类物质鉴定及其活性功能解析
钟 江,黄永光,胡鹏刚,周 蝶,陆丽娟,程玉鑫*
(1.贵州大学 酿酒与食品工程学院 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025)
白酒糟是白酒生产过程中的主要副产物,年产量高达2 000万t,形成了巨大的副产物资源。酒糟中含有丰富的化学成分,具有潜在的研究价值和应用价值[1],而因酿造工艺的差异性导致不同香型酒糟的化学成分不同。清酱香型白酒是我国创新香型白酒,具有清亮透明、清酱协调、香气幽雅、醇厚丰满、细腻柔顺、回味悠长的酒体风格,深受广大消费者的喜爱[2]。采用多曲联用作为糖化发酵剂和添加具有少数民族特色的陀陀曲辅助发酵是清酱香型白酒区别于其他香型白酒的根本区别,其独特的酿造工艺构成了清酱香型酒糟化学成分高残留的特点,且清酱香型酒糟因其优良的品质高价售出,体现出更高的研究价值与利用价值。
目前,关于白酒酒糟多酚的研究主要集中于酱香型白酒酒糟多酚、清香型白酒酒糟多酚和浓香型白酒酒糟多酚的提取条件探究、抗氧化活性的评定和多酚化合物的鉴定。曹新志等[3]优化了酱香型白酒酒糟多酚的提取工艺,当乙醇体积分数为100%、料液比为1∶11(g∶mL)、提取时间为8 h、提取温度为75 ℃时,总酚的提取率最佳,为29.36%。WANG X Y等[4-6]研究报道了酱香型酒糟、清香型酒糟和浓香型酒糟的多酚含量分别为4.78 mg/g、6.80 mg/g和2.55 mg/g,清香型白酒酒糟中检出4-羟基苯甲酸、4-羟基苯乙酸、香草酸、丁香酸、香豆酸、反式阿魏酸和肉桂酸,而在酱香型白酒酒糟中检出表儿茶素、阿魏酸、对羟基苯甲酸、咖啡酸、丁香酸、槲皮素、香草酸和没食子酸。毕静等[7]探究了浓香型白酒酒糟多酚的体外抗氧化活性,结果表明浓香型白酒酒糟多酚对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率高达85%~92%。现有研究为白酒酒糟多酚的提取、抗氧化活性的评定及多酚化合物的鉴定奠定了基础,但关于清酱香型白酒酒糟多酚的研究还鲜见报道。
本研究通过超声辅助溶剂法联合碱解法提取清酱香型白酒酒糟的酚类物质,并利用超高效液相色谱-电喷雾-串联质谱联用(ultra-performance liquid chromatographyelectrospray-tandem mass spectrometry,UPLC-ESI-MS/MS)技术鉴定游离酚和结合酚化合物的组成结构,评价清酱香型白酒酒糟的游离酚和结合酚的体外抗氧化活性,并通过体外模拟胃肠道消化模型探究清酱香型白酒酒糟的游离酚和结合酚对肠道菌群和短链脂肪酸的影响。旨在对清酱香型白酒酒糟多酚的活性功能进行较全面的评定,为实现白酒酒糟的高值化利用提供有利的科学依据。
1 材料与方法
1.1 材料与试剂
清酱香型白酒糟:岩博酒业股份有限公司;乙腈(色谱纯):北京迪科马科技有限公司;甲酸(色谱纯):梯希爱化成工业发展有限公司;甲酸铵(色谱纯):美国Sigma-Aldrich公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS)、2,4,6-三吡啶基三嗪(tripyridyl triazine,TPTZ)、水溶性维生素E(Trolox)、吐温80、氯化血红素、维生素K1、L-半胱氨酸、刃天青:索莱宝生物科技有限公司;酵母膏、蛋白胨、胰酶S10031(酶活4 000 U/g)、胰淀粉酶(酶活7 000 U/g)、胰脂肪酶(酶活4 000 U/g)、猪胆盐S30895(胆酸含量>60%):上海源叶生物科技有限公司;胃蛋白酶P7000(酶活≥250 U/mg):美国Sigma-Aldrich公司;D4015-01 E.Z.N.A.R粪便脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:美国OMEGA公司;SYBR Premix ExTaqTMⅡ基因的荧光定量试剂盒:宝生物工程(大连)有限公司。
1.2 仪器与设备
ACQUITY液相色谱仪:美国Waters公司;Q Exactive质谱仪:美国Thermo Fisher Scientific公司;Gentier 96R全自动医用聚合酶链式反应(polymerase chain reaction,PCR)分析系统:西安天隆科技有限公司;LAI-3厌氧培养箱:上海龙跃仪器设备有限公司;NanoDrop2000超微量分光光度计:美国NanoDrop Technologies公司。
1.3 方法
1.3.1 样品预处理
清酱香型白酒糟样品在50 ℃恒温条件下干燥至恒质量,粉碎过60目筛,得到酒糟粉,保存于-20 ℃,备用。
1.3.2 酒糟基础成分的测定
水分的测定:参考GB/T 5009.3—2016《食品中水分的测定》中的直接干燥法;粗蛋白的测定:参考GB/T 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法;粗纤维的测定:参考GB/T 6434—2022《饲料中粗纤维的含量测定》中的过滤法;粗淀粉的测定:参考T/CBJ 004—2018《固态发酵酒醅通用分析方法》;粗脂肪的测定:参考GB/T 6433—2006《饲料中粗脂肪的测定》;粗灰分的测定:参考GB/T 6438—2007《饲料中粗灰分的测定》;总酚含量的测定:采用福林酚法。
1.3.3 酒糟中游离酚和结合酚的提取及结构解析
大学生正位于价值观形成和发展的关键时刻,对自我价值与社会价值的判断相对片面,极容易受到外界环境的冲击与干扰,陷入政治信仰缺失、理想信念迷茫、价值判断模糊、功利思想严重等思想困境。因此,高校应从大学生的全面发展以及“中国梦”的实现两方面出发,对社会主义核心价值观培养策略进行探究。
参考汪瑞敏等[8]的方法并稍作修改。酒糟中的游离酚和结合酚进行提取:称取5 g酒糟粉,按料液比1∶20(g∶mL)加入体积分数为60%的乙醇溶液,超声功率420 W条件下提取30 min,4 ℃、5 000×g条件下离心10 min,收集上清液,得到酒糟游离酚提取液。向提取完游离酚的酒糟残渣中按料液比1∶40(g∶mL)加入2 mol/L NaOH溶液,充入氮气隔绝氧气,置于摇床中(25 ℃,180 r/min)消化4 h。消化结束后,立即将溶液的pH调至2.0±0.2,加入乙酸乙酯萃取至上清液无色,旋转浓缩除去溶剂后得到酒糟结合酚提取液。
利用超高效液相色谱-电喷雾-串联质谱联用技术鉴定游离酚和结合酚化合物组成。
UPLC条件:Waters ACQUITY超高效液相系统,使用ACQUITY UPLC HSS T3色谱柱(2.1 mm×150 mm,1.8 μm),流速为0.25 mL/min,柱温为40 ℃,进样量为2 μL。正离子模式下,流动相为0.1%甲酸乙腈(B1)和0.1%甲酸水(A1),梯度洗脱程序为:0~1 min,2% B1;1~9 min,2%~50%B1;9 ~12 min,50%~98% B1;12 ~13.5 min,98% B1;13.5~14 min,98%~2%B1;14~20 min,2%B1。负离子模式下,流动相为乙腈(B2)和5 mmol/L甲酸铵水(A2),梯度洗脱程序为:0~1 min,2%B2;1~9 min,2%~50%B2;9~12 min,50%~98%B2;12~13.5 min,98%B2;13.5~14 min,98%~2%B2;14~17 min,2%B2。
质谱条件:Thermo Q Exactive质谱检测器,电喷雾离子(electrospray ionization,ESI)源,在正负离子模式下分别采集数据。正离子喷雾电压为3.50 kV,负离子喷雾电压为-2.50 kV,鞘气30 arb,辅助气10 arb,毛细管温度325 ℃,以分辨率70 000进行一级全扫描,一级离子扫描范围为100~1 000 m/z,同时采用动态排除去除无必要的MS/MS信息。
1.3.4 多酚抗氧化活性测定
DPPH自由基清除能力的测定:用无水乙醇配制0.4 mg/mL的Trolox标准溶液,分别吸取0、10 μL、20 μL、30 μL、40 μL、50 μL Trolox标准溶液于离心管中,向离心管中依次加入100 μL、90 μL、80 μL、70 μL、60 μL、50 μL蒸馏水,随后加入1.9 mL 0.04 mg/mL的DPPH标准溶液(用体积分数为80%甲醇溶液溶解),摇匀,避光反应30 min,在波长517 nm处测定吸光度值,以质量浓度(x)为横坐标,吸光度值(y)为纵坐标制作标准曲线方程。铁离子还原能力以每克酒糟粉中Trolox当量(Trolox equivalent,TE)微克数表示。
铁离子还原/抗氧化能力(Ferric ion reducing antioxidant power,FRAP)的测定:用无水乙醇配制0.4 mg/mL的Trolox标准溶液,分别吸取0、10μL、20μL、30μL、40μL、50μLTrolox标准溶液于离心管中,向离心管中依次加入50 μL、40 μL、30 μL、20 μL、10 μL、0蒸馏水,随后加入2.45 mL 10 mmol/L的TPTZ溶液(用40 mmol/L盐酸溶解),摇匀,避光反应30 min,在593 nm波长处测定吸光度值,以质量浓度(x)为横坐标,吸光度值(y)为纵坐标制作标准曲线方程。铁离子还原能力以每克酒糟粉中Trolox当量(TE)的微克数表示。
1.3.5 模拟小肠消化及结肠发酵
参考CHENG Y X等[9]的方法并稍作修改。将1 mg/mL酒糟多酚溶液的pH调至2.0,加入280 μL模拟胃液(0.01 mol/L盐酸配制胃蛋白酶溶液),置于摇床中(37 ℃、180 r/min)消化60 min。消化结束后,将体系的pH调节至6.5,加入6 mL模拟小肠消化液(2 mg/mL胆汁酸盐和10 mg/mL胰液素按体积比1∶3混合配制),随后将体系的pH调节至7.4,于摇床(37 ℃、180 r/min)继续消化2 h。
收集两名健康捐赠者(BMI:22.36-24.12)的新鲜粪便与0.01 mol/L无菌磷酸盐缓冲液(8 g NaCl、0.2 g KCl、1.15 g Na2HPO4、1.93 g Na2HPO4·12H2O、0.2 g KH2PO4、0.5 gL-半胱氨酸盐酸盐,加1 L蒸馏水溶解,pH调至7.4,灭菌)按1∶9(g∶mL)混合,纱布过滤制得粪便悬浮液。分别在低剂量(0.66 mL)、中剂量(1.32 mL)和高剂量(2.64 mL)的多酚溶液中加入13.08 mL、12.66 mL和11.82 mL无菌厌氧培养基,接种1.5 mL粪便菌悬液,然后将混合体系置于厌氧培养箱(90%N2、5%CO2、5%H2)37 ℃发酵24 h和48 h。结肠发酵结束后,将混合体系在4 ℃、10 000×g条件下离心10 min,分别收集上清液和沉淀,保存于-80 ℃冰箱中,上清液用于短链脂肪酸(short-chain fatty acids,SCFAs)(也称挥发性脂肪酸(volatile fattyacids,VFA),是指碳原子数<6的有机脂肪酸)测定,沉淀用于粪便中微生物种类和丰度分析。
1.3.6 粪便菌群丰度变化分析
采用基因荧光定量试剂盒进行定量扩增。反应程序如下:最初在95 ℃下变性30 s,然后在95 ℃下变性5 s,53 ℃下变性30 s,72 ℃下延伸30 s。在延伸阶段采集荧光,溶解曲线温度范围为60~95 ℃。采用2-ΔΔCt方法分析各微生物群的相对表达量:ΔCt=Ct(目标基因)-Ct(管家基因);ΔΔCt=ΔCt(处理组)-ΔCt(空白组)。每组均设置3个平行,并进行3次独立操作。
1.3.7 短链脂肪酸分析
短链脂肪酸测定采用高效液相色谱法。取0.8 mL上清液,加入体积分数为50%的H2SO4160 μL,再加入80 μL 2-乙基丁酸(790 mmol/L),涡旋15 min,于4 ℃条件下酸化1 h。酸化后,加入0.8 mL乙酸乙酯,涡旋10 min,于4 ℃冰箱中萃取10 min,离心(13 000×g、4 ℃)取有机层,经0.22 μm有机膜过滤后,上机分析。色谱条件:DB-WAX色谱柱(30 m×0.25 mm×0.25 μm),检测器为火焰离子检测器(flame ionization detector,FID),流速为1 mL/min,进样量为1 μL,分流比为10∶1,检测器温度为250 ℃。初始温度设为105 ℃,保持3 min;以10 ℃/min的升温速率加热至170 ℃;然后再以70 ℃/min的升温速率加热至240 ℃,保持7 min。
1.3.8 数据处理
使用IBM SPSS Statistics 26.0进行统计分析,GraphPad Prism 9.0、Canoco 5.0和Chiplot 0.2绘图。
2 结果与分析
2.1 清酱香型白酒酒糟基本成分
采用国家相关标准,测定不同香型白酒酒糟的基本成分,结果见表1。由表1可知,清酱香型白酒酒糟的水分、蛋白质、淀粉、粗纤维、灰分和脂肪含量分别为48.94 g/100 g、12.82 g/100 g、29.61 g/100 g、18.70 g/100 g、1.49 g/100 g、2.83 g/100 g。清酱香型白酒酒糟的蛋白质含量低于酱香型白酒酒糟、浓香型白酒酒糟和清香型白酒酒糟,特别是酱香型酒糟的蛋白质含量为清酱香型酒糟的1.9倍以上。同样地,清酱香型酒糟的灰分含量和脂肪含量低于其他香型酒糟,特别是浓香型酒糟的灰分含量是清酱香型酒糟的6.7倍以上,而清酱香型酒糟的淀粉含量却远高于酱香型酒糟和浓香型酒糟,是酱香型酒糟和浓香型酒糟的1.5倍和2.2倍以上,不同香型酒糟间的成分差异可能是由酿造工艺和酿造原料的不同所导致。
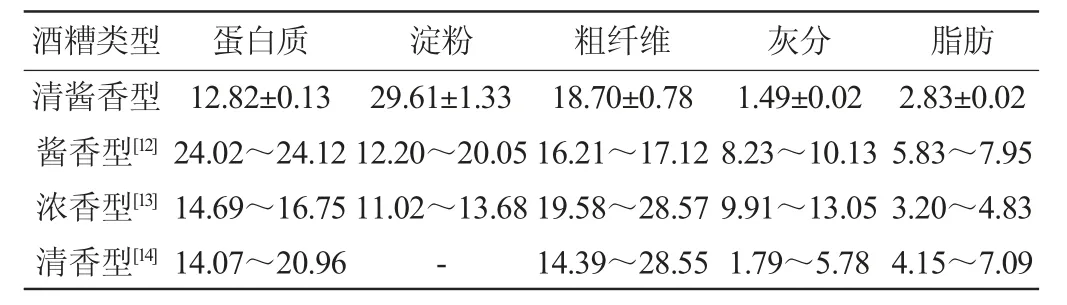
表1 不同香型白酒酒糟基础成分含量比较Table 1 Comparison of base components contents of distiller's grains of different flavor Baijiu g/100 g
此外,研究发现,蛋白质、淀粉和粗纤维是清酱香型酒糟中残留的主要基础成分,占总成分的60%以上。以往的研究表明,传统固态发酵技术的局限性和低效率使得酒糟中残留大量淀粉[1],而酿造谷物中富含的抗营养因子单宁(0.45%~1.68%)以及加入的稻壳填充剂会阻碍微生物对蛋白质的代谢以及导致大量粗纤维残留在酒糟中[10-11]。上述分析表明,蛋白质、淀粉和粗纤维是清酱香型酒糟中最丰富的基础成分,且清酱香型白酒酒糟与其他香型白酒酒糟间的基础成分存在差异。
2.2 清酱香型白酒酒糟酚类物质分析
本研究测定结果表明,清酱香型酒糟的游离酚、结合酚和总酚含量分别为(2.64±0.03)mg/g、(6.11±0.05)mg/g和(8.58±0.04)mg/g。清酱香型酒糟总酚含量高于酱香型酒糟(4.78 mg/g)[5]、清香型酒糟(6.80 mg/g)[4]和浓香型酒糟(2.55 mg/g)[6],不同酒糟间的总酚差异可能与提取方法与酿造工艺密切相关。以往的研究直接通过溶剂浸提法或超声辅助溶剂法获得酒糟总多酚,大部分与膳食纤维、蛋白质和淀粉以强有力共价键结合的结合态多酚没有被提取[15],导致获得的总酚含量低。而本研究通过超声辅助法联合碱解法获得酒糟总多酚,超声[16]和碱解[17]可提高多酚的提取率和促进结合态多酚的释放,两者的联用可提高酒糟总酚的提取率。
此外,研究发现清酱香型酒糟中结合态多酚更丰富,结合酚的含量(6.11 mg/g)是游离酚含量(2.64 mg/g)的2.3倍,这可能与酿造谷物有关。研究指出,多酚的存在形式与谷物种类有关,高粱中绝大部分多酚以结合态形式存在[18]。上述分析表明,清酱香型酒糟比其他香型酒糟含有更丰富的酚类物质,且清酱香型酒糟中结合态多酚更丰富。
2.3 清酱香型白酒酒糟中酚类化合物的组成
清酱香型白酒酒糟酚类化合物的组成和含量测定结果见表2。由表2可知,在清酱香型白酒酒糟中共检测出34种多酚化合物,其中游离酚有28种,结合酚有33种,且柚皮苷[(116.12±7.15)μg/g]和漆黄素[(379.6±21.05)μg/g]分别是游离酚和结合酚中含量最高的酚类化合物。研究表明,清香型白酒酒糟和酱香型白酒酒糟中均检测到8种酚类化合物,其中香豆酸和表儿茶素(562.70 μg/g)分别是清香型酒糟和酱香型酒糟中最丰富的酚类化合物[4,6]。清酱香型酒糟与其他香型酒糟间酚类化合物的差异性可能与酿造工艺密切相关,多曲联用作为糖化发酵剂及添加具有少数民族特色的陀陀曲辅助发酵是清酱香型酒糟与其他香型酒糟间的本质区别,不同的酒曲发酵导致不同香型酒糟间酚类化合物产生差异。

表2 清酱香型白酒酒糟中游离酚和结合酚含量测定结果Table 2 Determination results of free and bound polyphenols in light/sauce-flavor Baijiu distiller's grain
此外,阿魏酸是谷物中最丰富的酚类化合物[18],而在清酱香型酒糟中却只发现反式阿魏酸的存在,这可能是由于微生物发酵改变了酚类化合物的组成和含量。例如,在黑荞麦原料中未检测到山奈酚和绿原酸,而经发酵后山奈酚和绿原酸的含量分别为(285.19±3.03)mg/kg和(36.71±0.63)mg/kg,且发酵后槲皮素和表儿茶素的含量分别增加了约13.67倍和8.51倍[19]。结果表明,清酱香型酒糟中含有丰富的酚类化合物,且柚皮苷和漆黄素分别是游离酚和结合酚最丰富的酚类化合物,丰富的酚类化合物可能使得清酱香型酒糟具有较好的生物活性。
2.4 清酱香型白酒酒糟酚类物质的抗氧化性及二者相关性
清酱香型白酒酒糟游离酚、结合酚和总酚抗氧化活性测定结果见图1,总酚与抗氧化活性相关性见图2。

图1 清酱香型白酒酒糟酚类化合物的抗氧化活性Fig.1 Antioxidant activities of phenolic compounds in distiller's grain of light/sauce-flavor Baijiu

图2 总酚含量与抗氧化活性之间相关性Fig.2 Correlation between total phenolic contents and antioxidant activities
由图1可知,清酱香型酒糟游离酚、结合酚和总酚的抗氧化活性存在显著差异(P<0.05),且抗氧化活性的强弱为总酚>结合酚>游离酚。游离酚对ABTS自由基、DPPH自由基的清除能力和对FRAP的还原能力分别为(441.16±9.87)μg TE/g、(74.12±6.16)μg TE/g和(53.43±1.09)μg TE/g;结合酚对ABTS自由基、DPPH自由基的清除能力和对FRAP的还原能力分别为(1 532.62±77.05)μg TE/g、(402.06±29.86)μg TE/g和(153.67±11.76)μg TE/g;同样地,总酚的抗氧化活性分别为(1 973.78±84.76)μg TE/g、(476.17±29.34)μg TE/g和(207.10±11.59)μg TE/g。关于酒糟多酚的抗氧化活性研究,报道了酱香型酒糟总酚对DPPH自由基和ABTS自由基的半抑制浓度分别为16.21 μg/mL和5.73 μg/mL[4];许世浩等[20]以清香型酒糟为原料,测得清香型酒糟总酚对DPPH自由基、ABTS自由基和超氧阴自由基的清除率均达到90%以上。
由图2可知,总酚含量与ABTS、DPPH自由基清除率、FRAP间相关系数R分别为0.990、0.968、0.997,总酚含量与抗氧化活性之间呈极显著正相关(P<0.01)。
2.5 清酱香型白酒酒糟酚类化合物对肠道菌群的调节作用
清酱香型酒糟酚类化合物对粪便菌群相对丰度的影响结果见图3。由图3可知,相对于空白组,游离酚和结合酚显著增加了肠道有益菌的相对丰度(P<0.05)。游离酚和结合酚分别在24 h和48 h时对肠道菌群的促进作用最佳,游离酚使总细菌、丁酸产生菌、阿克曼菌属(Akkermansia)、乳杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)和双歧杆菌属(Bifidobacterium)的相对丰度分别提高了1.69倍、1.90倍、2.04倍、2.27倍、2.15倍和2.73倍,而结合酚使总细菌、Akkermansia、Lactobacillus、Ruminococcus和Bifidobacterium的相对丰度分别提高了1.62倍、1.48倍、2.56倍、2.40倍和1.77倍。游离酚和结合酚对肠道菌群的影响不同,这可能与各自的特性有关,游离酚具有吸收释放快的特点,而结合酚的释放缓慢且持续[21]。BURGOS-EDWARDS A等[22]研究表明,醋栗游离酚在模拟发酵4 h时对Akkermansia、Lactobacillus和Bifidobacterium的促进作用最好,而醋栗结合酚却是在模拟发酵24 h时才表现出最好的促进作用。此外,酚类化合物的差异性也是导致游离酚和结合酚对肠道菌群影响作用不同的原因。例如,主成分为花色素苷的野樱莓游离酚和主成分为矢车菊素的野樱莓结合酚对小鼠肠道微生物的调控不同,结合酚主要调控拟杆菌门(Bacteroidetes)和梭菌纲(Clostridia),而游离酚则主要调控放线菌门(Actinobacteria)和梭菌纲(Clostridia)[23],故清酱香型酒糟游离酚(主要为柚皮苷(116.12±7.15)μg/g)和结合酚(主要为漆黄素(379.6±21.05)μg/g)中酚类物质的差异性可能是导致其影响作用不同的原因之一。结果表明,清酱香型酒糟酚类物质对肠道有益菌具有良好的促进作用,且游离酚和结合酚对肠道有益菌的促进作用不同。

图3 游离酚(A)和结合酚(B)对肠道菌群相对丰度的影响Fig.3 Effect of free phenols (A) and bound phenols (B) on the relative abundance of gut microbiota
2.6 清酱香型白酒酒糟酚类化合物对短链脂肪酸的影响
SCFAs是肠道菌群的代谢产物,清酱香型酒糟游离酚和结合酚对SCFAs的影响结果分别见图4和图5。由图4和图5可知,与空白组相比,在24 h时,游离酚使总SCFAs和乙酸的浓度分别提高了1.75倍和1.77倍,结合酚使总SCFAs、乙酸、丙酸、戊酸的浓度分别提高了1.52倍、1.62倍、1.10倍和1.47倍;在48 h时,游离酚使丙酸、戊酸和异戊酸的浓度提高了1.18倍、5.19倍和1.26倍,结合酚使异丁酸和异戊酸的浓度分别提高了1.68倍和3.15倍;然而,在整个模拟阶段,游离酚和结合酚均抑制了丁酸的产生,这可能与富含原花青素(见表2)密切相关,有研究表明,富含原花青素的醋栗多酚在体外模型中显著降低丁酸含量[22]。碳水化合物的分解是合成SCFAs的必要条件,而原花青素可通过抑制微生物产生糖化酶或直接抑制糖化酶的活性以阻碍碳水化合物的分解,从而降低SCFAs的含量[24]。

图4 游离酚对短链脂肪酸含量的影响Fig.4 Effect of free phenols contents on short-chain fatty acids

图5 结合酚对短链脂肪酸含量的影响Fig.5 Effect of bound phenols contents on short-chain fatty acids
此外,SCFAs的含量与肠道菌群的组成和丰度密切相关。例如,Lactobacillus、Bifidobacterium、Ruminococcus、普氏菌属(Prevotella)、拟杆菌属(Bacteroides)、梭菌属(Clostridium)及链球菌属(Streptococcus)可代谢分解碳水化合物产生乙酸[25],这暗示着乙酸含量的上升可能与这些菌的丰度上升有关;多酚可通过促进巨型球菌属(Megas-phaera)和粪杆菌属(Faecalibacterium)的生长将结肠中可发酵的碳水化合物转换为丙酸[26]。结果表明,清酱香型酒糟多酚增加了总SCFAs、乙酸、丙酸、戊酸、异戊酸和异丁酸的含量,抑制了丁酸的产生。
2.7 肠道菌群与短链脂肪酸间相关性分析
SCFAs与肠道菌群间相关性分析结果见图6。由图6可知,乙酸、丁酸和戊酸与乳杆菌(Lactobacillus)、瘤胃球菌(Ruminococcus)、双歧杆菌(Bifidobacterium)和大肠杆菌(Escherichia coli)呈显著负相关(P<0.05),丁酸与丁酸产生菌和阿克曼菌(Akkermansia)呈显著正相关(P<0.05)。丙酸与Lactobacillus和Escherichia coli呈显著负相关(P<0.05),与Akkermansia呈显著正相关(P<0.05)。异丁酸与Lactobacillus、Ruminococcus和Escherichia coli呈显著负相关,与Akkermansia呈显著正相关(P<0.05),异戊酸与Akkermansia呈显著正相关(P<0.05)。相似的研究指出,Bifidobacterium和Escherichia-Shigella与乙酸、丙酸、丁酸、异丁酸和异戊酸呈显著负相关(P<0.05),推测Bifidobacterium可能受到结肠环境酸化的影响[27];乙酸、丙酸和丁酸与Akkermansia呈正相关,与Escherichia coli、Paraeggerthella和Anaerobacter呈负相关[28];傅金凤等[29]研究发现,乙酸、丙酸、丁酸与Akkermansia呈正相关,乙酸和丁酸与Ruminococcus呈负相关。结果表明,SCFAs与肠道菌群间呈现出较好的相关性,两者间可能具有相互促进或相互制约的关系。

图6 短链脂肪酸与肠道菌群间相关性热图Fig.6 Heat map of correlation between short-chain fatty acids and gut microbiota
3 结论
清酱香型酒糟含有丰富的多酚物质,其柚皮苷(116.12±7.15)μg/g和漆黄素(379.6±21.05)μg/g分别是游离酚和结合酚中含量最高的多酚化合物。清酱香型酒糟酚类物质具有高抗氧化活性,且游离酚含量、结合酚含量、总酚含量与ABTS、DPPH和FRAP间极显著正相关(P<0.01)。清酱香型酒糟游离酚和结合酚提高了肠道有益菌的相对丰度,游离酚使总细菌、丁酸产生菌、阿克曼菌、乳杆菌、瘤胃球菌和双歧杆菌的相对丰度分别提高了1.69倍、1.90倍、2.04倍、2.27倍、2.15倍和2.73倍,而结合酚使总细菌、阿克曼菌、乳杆菌、瘤胃球菌和双歧杆菌的相对丰度分别提高1.62倍、1.48倍、2.56倍、2.40倍和1.77倍。此外,清酱香型酒糟多酚还促进了SCFAs的产生,游离酚使总SCFAs、乙酸、丙酸、戊酸和异戊酸的浓度分别提高了1.75倍、1.77倍、1.18倍、5.19倍和1.26倍,而结合酚使其提高了1.52倍、1.62倍、1.10倍、1.47倍、1.68倍。结果表明,清酱香型酒糟中含有丰富的酚类化合物,且具有良好的活性功能,具备作为功能性膳食成分应用的潜能,可为高值化利用白酒糟提供有利的科学依据。

