线粒体自噬调控脑缺血再灌注损伤及天然产物研究进展
陈 璐 李 瑞 沈志强
脑卒中是全世界引起残疾或死亡的主要因素之一。其中,以缺血性脑卒中最为常见,约占全部脑卒中的80%,临床主要通过天然产物溶栓使缺血性脑组织的血供迅速恢复。但随着血流的快速恢复,代偿会加剧脑组织损伤,即产生脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)。研究发现,线粒体自噬参与了CIRI的发展进程,适度的线粒体自噬激活可减轻脑缺血后的线粒体功能障碍,但过度的线粒体自噬会加剧氧化应激损伤脑组织[1]。因此,通过调控线粒体自噬维持线粒体功能正常可能是治疗CIRI的关键。本文讨论了线粒体自噬介导CIRI的主要通路以及作用机制,总结归纳了靶向线粒体自噬治疗CIRI的天然产物的研究进展,以期为CIRI治疗提供理论基础和新的思路。
一、线粒体自噬与脑缺血再灌注损伤
2005年首次提出了线粒体自噬的概念,线粒体自噬作为一种选择性自噬,目的是去除多余或功能失调的线粒体,是线粒体稳态不可或缺的过程。在CIRI发生、发展过程中,大量产生的活性氧(reactive oxygen species,ROS)、活性氮和Ca2+富集,会导致细胞毒性水肿,引起线粒体通透性转换孔异常开放,加速线粒体外膜破裂和内膜肿胀,促进细胞色素C等促凋亡因子的释放和炎性反应,最终破坏DNA和结构蛋白导致细胞死亡。线粒体自噬具有双刃剑效应,其具体的影响与CIRI的过程密切相关。
二、参与CIRI的经典线粒体自噬信号通路
1.PINK1/Parkin信号通路:线粒体自噬有多种信号通路参与调控其自噬过程。其中,研究最多、最具特征性的线粒体自噬途径涉及人第10号染色体缺失的磷酸酶及张力蛋白同源的基因诱导假定激酶1/E3泛素连接酶(PTEN induced putative kinase 1/Parkin,PINK1/Parkin)通路。在该通路中,线粒体膜去极化后导致PINK1的积累,其将泛素磷酸化后激活Parkin,并磷酸化其他细胞质受体蛋白,募集微管相关蛋白轻链3(microtubule-associated protein1 light chain3,LC3)并与之结合,最终被溶酶体识别、吞噬和降解。Wen等[2]研究发现,再灌注逆转了脑缺血引起的线粒体清除障碍,促进了PINK1和Parkin的表达,改善了短暂性脑缺血后海马神经元损伤。之后,有研究发现在大鼠脑皮质缺血半影区检测到受损线粒体中PINK1的积累,Parkin和p62向线粒体易位,证实了PINK1/Parkin信号通路参与了CIRI后的病理生理过程。
2.NIX/Bnip3信号通路:凋亡蛋白Bcl-2腺病毒E1B 19kDa蛋白相互作用蛋白3类似物(Nip3-like protein X,NIX)/Bcl-2腺病毒E1B 19kDa蛋白相互作用蛋白3(Bcl-2/adenovirus E1B-19kD-interacting protein,Bnip3)信号通路也参与了CIRI的发生和发展。NIX 和Bnip3定位于线粒体外膜,可通过LC3直接与自噬小体结合。研究发现,Bnip3或NIX能与Bcl-2(或相关蛋白)结合,并从Bcl-2复合物中释放Beclin1,激活自噬发生。另外,NIX/Bnip3和缺氧诱导因子-1α的相互影响可介导线粒体自噬,阻止ROS 水平的增加[3]。还在Bnip3-KO小鼠中发现减少Bnip3与LC3的相互作用可以抑制线粒体自噬,脑梗死体积减少,提示Bnip3基因沉默有利于脑卒中后的神经保护。
4.其他信号通路:除此之外,磷脂酰肌醇激酶/磷酸化蛋白激酶B(phosphatidylinositol-3-kinase/ protein kinase B,PI3K/Akt)信号通路和AMP依赖的蛋白激酶/哺乳动物雷帕霉素靶蛋白[adenosine 5′-monophosphate (AMP)-activated protein kinase/ mammalian rapamycin target protein,AMPK/mTOR]通路等也参与调控线粒体自噬,并且与先前提到的经典通路可能存在着些许联系,协同影响着CIRI的过程,但他们之间的具体影响机制尚需深入研究(图1)。

图1 CIRI的分子级联反应和相关线粒体自噬通路图
三、以线粒体自噬为关键干预环节治疗CIRI的天然产物
越来越多的证据表明,天然产物可以通过调控线粒体自噬,发挥清除受损线粒体作用的同时不易因过度线粒体自噬而产生脑组织持续性损伤。以下归纳了部分靶向线粒体自噬治疗CIRI的天然产物,以期为治疗CIRI提供实验基础和理论数据。
1.苷类
(1)人参皂苷:人参皂苷(ginsenoside)是一种皂苷类化合物,是传统中药人参的主要活性成分之一。研究发现,人参皂苷通过抑制mTOR表达,减少中动脉栓塞/再灌注(middle cerebral artery occlusion/ Reperfusion,MCAO/R)大鼠的线粒体DNA损伤和凋亡因子胱天蛋白酶的裂解,还可以增加线粒体呼吸链复合体的活性,促进ATP产生[5]。另外,人参皂苷还可以激活AMPK信号通路启动线粒体自噬,保护神经元细胞免受损伤。线粒体自噬的保护作用可能与CIRI的不同时期以及脑缺血程度有关[6]。
(2)松果菊苷:松果菊苷(echinacoside,ECH)是肉苁蓉总苷中浓度最高的苯乙醇苷。报道发现,ECH通过抑制线粒体自噬保护神经元免受损伤,从而在预防和治疗CIRI过程中发挥重要作用[7]。另外,ECH能够增强线粒体融合蛋白2的表达,有效改善了线粒体形态和功能,减少了脑损伤,这些研究均表明与抑制过度线粒体自噬有关[8]。
(3)地黄苦苷:熟地黄是一种药用植物,作为中风方剂的重要组成部分,在传统中医中已使用了数百年。地黄苦苷(rehmapicroside)是熟地黄的主要活性成分,其能通过Drp1/PINK1/Parkin信号通路,升高线粒体膜电位,抑制线粒体自噬激活,减少氧化应激,减轻脑梗塞面积并改善神经功能,提示地黄苦苷可能是一种潜在的抗CIRI的候选单体天然产物[9]。
2.黄酮类
在侠世界·中州之上,有这样一群豪杰,他们不从属于任何一方势力,他们行走江湖,只为以武会友、快意恩仇,时人慕其风采,称其为“游侠”。
(1)木犀草素:木犀草素(luteolin)是一种天然四羟基黄酮化合物,具有多种药理活性,广泛存在于不同植物物种中。在MCAO/R小鼠和氧糖剥夺/再灌注(oxygen and glucose deprivation/reperfusion,OGD/R)诱导的人神经母细胞瘤细胞模型分别发现了木犀草素的保护效果,它可以改善自噬流过程,促进线粒体自噬小体的降解,加速ROS的清除效率,还可以通过抑制Drp1活性保护线粒体形态,恢复线粒体活力和功能[10,11]。
(2)葛根素:葛根素(puerarin)是从中药葛根中分离得到的具有扩血管作用的异黄酮衍生物。研究表明,葛根素可以减少自噬小体的形成,减少Beclin1的表达,以及降低LC3-Ⅱ的表达,抑制线粒体自噬介导的线粒体质量下降,保护了大鼠皮质神经元免受神经毒性。而这些作用大多依赖于AMPK/mTOR/ULK1通路,推测该通路抑制过度线粒体自噬是葛根素减轻CIRI的主要机制[12]。虽然线粒体自噬在CIRI中所起的作用一直存在争议,但能够确定,受损线粒体的过度清除和清除不足均将导致细胞死亡。
(3)柚皮苷:柚皮苷(naringin)是一种天然存在于葡萄柚和其他柑橘类水果中的类黄酮,Feng等[13]研究发现,柚皮苷可以抑制过氧亚硝基阴离子和一氧化氮的产生,降低了线粒体LC3-Ⅱ/LC3-Ⅰ的比例,并抑制了PINK1的聚集和Parkin向线粒体的易位。另外,柚皮苷可以激活线粒体大电导钙调节钾通道,减少细胞线粒体损伤和凋亡[14]。但其具体机制还有待于深入研究。
(4)黄芩苷:黄芩苷(baicalin)是从黄芩中提取的具有神经保护活性的天然生物活性类黄酮。主要以依赖于AMPK的方式调节线粒体自噬功能来减轻CIRI。研究发现,黄芩苷能够激活AMPK通路,增加Drp1 Ser637磷酸化,从而减少线粒体分裂,并抑制ROS 的富集。不仅如此,林筱洁等[15]研究还发现,黄芩苷处理后能有效调控线粒体自噬小体,并发现线粒体自噬相关Bnip3、Parkin、FUNDC1蛋白均可能参与了CIRI的发生与发展。提示,黄芩苷治疗CIRI的相关机制与线粒体自噬有重要联系,同时也发现黄芩苷抑制线粒体自噬的作用可能是多条信号通路交联的结果。
(5)荭草苷:荭草苷(orientin)是中药金莲花中的主要生物活性类黄酮化合物。据报道,荭草苷可以激活PI3K/Akt信号通路,减少LC3和Bnip3蛋白表达,并且能够呈剂量依赖性逆转细胞凋亡,提示抑制大鼠脑组织线粒体自噬过度激活可能是荭草苷发挥脑保护作用的重要机制[16]。
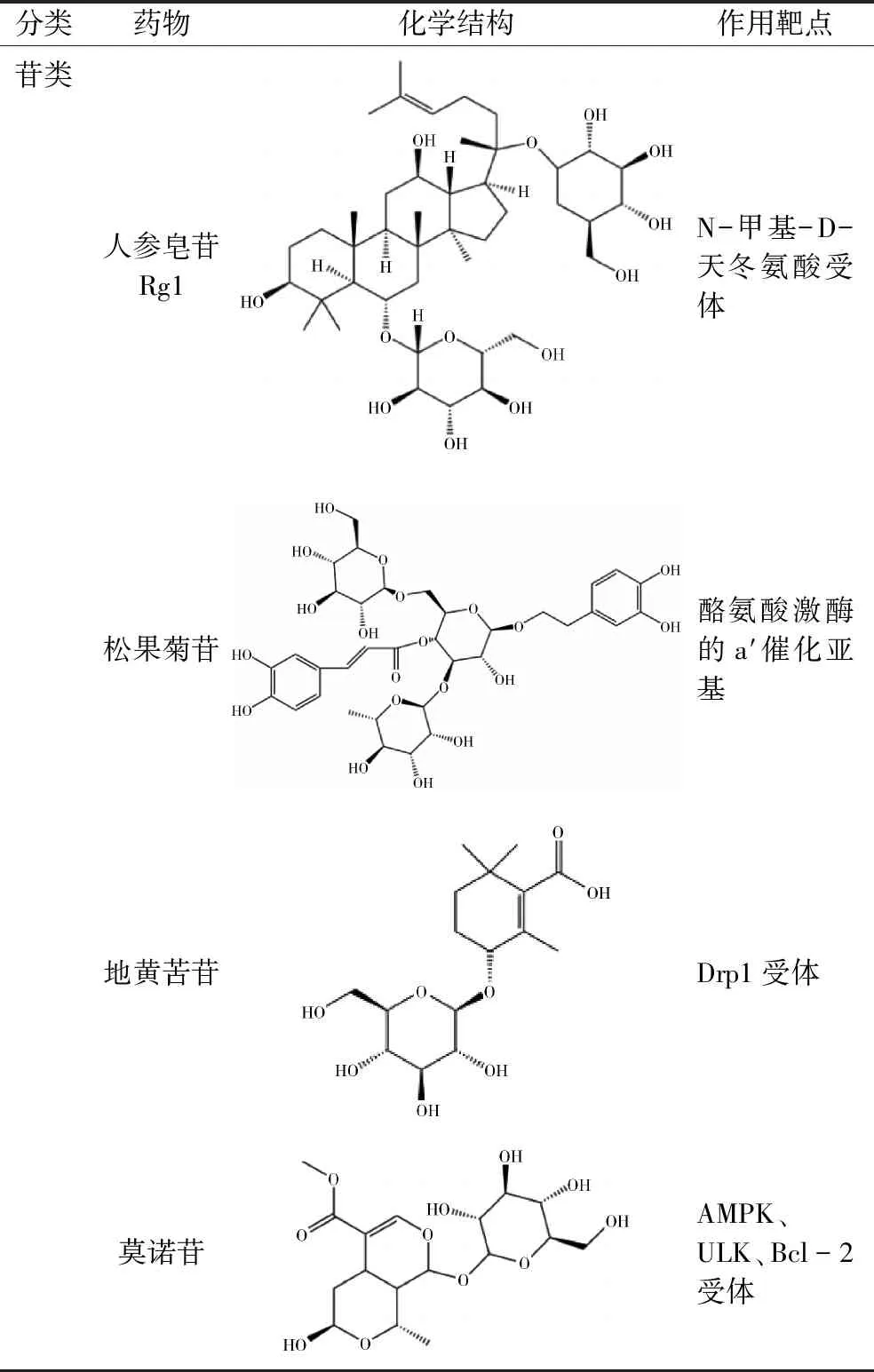
表1 靶向线粒体自噬治疗CIRI的天然活性成分
3.酚类
(1)白藜芦醇:白藜芦醇(resveratrol,RSV)是一种天然的多酚化合物,存在于葡萄、蓝莓和红酒等食物中。研究发现,RSV上调PINK1,招募Parkin蛋白,促进了LC3和线粒体外膜转位酶的共定位,减轻了OGD/R诱导的氧化应激[17]。另外,Kang等[18]研究发现,RSV促进了AMPK磷酸化对脑缺血谷氨酸兴奋性毒性的消除作用。不止如此,RSV还可以通过SIRT-1、AMPK/PGC-1α、AMPK/ULK1和AMPK/ERK等途径上调线粒体自噬,表明RSV在CIRI治疗中有丰富的机制研究,由此也可以发现线粒体自噬是RSV防治CIRI的关键靶点,为RSV在未来抗CIRI天然产物开发中的潜在应用提供了有价值的信息[19,20]。
(2)姜黄素:姜黄素(curcumin)是从姜黄的根茎中提取的亮黄色多酚活性复合物,在许多研究中都发现其能够诱导线粒体自噬,主要通过调控Akt/mTOR通路,增强LC3和线粒体标记线粒体外膜蛋白孔蛋白1的共定位,减轻CIRI[21]。同时,姜黄素还促进LC3与NIX的相互作用,改善了小鼠脑内皮细胞的线粒体重塑,可以开发作为提示姜黄素可能成为一种线粒体功能障碍的潜在治疗剂[22]。
(3)芹菜甲素:芹菜甲素,又称丁苯酞(n-butylphthalide,NBP)是一种缺血性脑卒中的治疗天然产物,可通过抑制线粒体自噬起到神经保护作用。研究发现,NBP可减少缺血侧海马CA1区Bnip3表达,抑制Bcl-2家族相关凋亡因子表达[23]。另外研究发现NBP还可通过PINK1/Parkin通路,上调p62和线粒体外膜转位酶的表达,抑制了再灌注后线粒体自噬水平的升高,保护脑组织免受损伤,以上研究表明,NBP均以抑制过度线粒体自噬发挥作用[24]。
4.其他
(1)大黄酚:大黄酚(chrysophanol)是从植物大黄中提取的蒽醌类天然化学物质。Cui等[25]研究发现,大黄酚给药后减少了氧化应激发生,NIX和LC3蛋白表达降低,提示大黄酚可能通过下调NIX蛋白调节线粒体自噬,减轻小鼠海马体的损伤。然而NIX作为一种线粒体自噬相关蛋白的贡献似乎在CIRI等病理过程中被忽视了。因此,进一步鉴定NIX引起线粒体自噬的分子机制有望为挖掘脑缺血疗法以调控线粒体自噬过程建立生物学基础。
(2)虾青素:虾青素(astaxanthin)是一种存在于许多海洋微藻、真菌、鱼虾等微生物中的天然类胡萝卜素,被认为是自然界中最有效的抗氧化剂之一。研究发现,虾青素调控PI3K/Akt通路,升高膜电位,通过调节Bcl-2家族和线粒体通透性转换孔的开放,有效阻断了线粒体功能障碍,抑制OGD/R诱导的神经元凋亡[26]。因此,虾青素表现出的强抗氧化生物活性,为其开发成为防治CIRI引起的神经元损伤的新药提供理论依据。
(3)银杏内酯K:银杏内酯K(ginkgolide K)是一种萜类化合物,作为天然血小板活化因子受体拮抗剂,在脑缺血再灌注损伤中发挥着重要作用。研究表明,银杏内酯K可以上调AMPK/mTOR/ULK1信号通路促进线粒体自噬,减少Drp1转位到线粒体和阻止线粒体渗透性转换孔开放,并激活JAK2/STAT3通路促进神经再生,从而减轻CIRI[27,28]。
四、展 望
诸如苷类、黄酮类、酚类和内酯类等代表性天然产物,多数呈中性或酸性,其含有的多个不饱和共价键和酚羟基使其发挥极强的抗氧化作用,大基团的空间位阻有利于过氧自由基特异性结合,终止自由基链式反应,最终抑制DNA的氧化,保护细胞的生长。
通过PINK1/Parkin、NIX/Bnip3、FUNDC1、PI3K/Akt和AMPK等多种途径介导的线粒体自噬去除受损或功能失调的线粒体已被证明是一种重要的线粒体质量控制机制。虽然线粒体自噬在脑缺血中作用的尚无统一,但关于线粒体自噬在脑缺血中的作用研究已经取得了很大进展。本文总结了从体内、体外、多角度、多途径深入探究天然产物可以通过调控线粒体自噬相关机制对CIRI的神经保护作用,这些发现将进一步促进临床中CIRI候选天然产物的开发和应用。然而,现在仍然有大多数天然产物与CIRI相关的研究停留在细胞和器官组织水平,很少有深度研究线粒体等细胞器。未来凭借线粒体在CIRI中的重要地位,调控线粒体自噬的天然产物可能为临床应用提供新的思路和方向。
利益冲突声明:所有作者均声明不存在利益冲突。

