GTSE1在肝癌中的表达及其对预后和免疫浸润的影响
谭程鹏 刘晓红 李 锟
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要病理组织学类型,占比约为90%。它作为全球第六大最常见的癌症,给社会带来了巨大的健康和经济负担[1,2]。此外,由于其不良预后,HCC是癌症死亡的第四大原因。目前,癌症治疗策略主要包括手术、化疗、放疗、靶向治疗和免疫治疗,但患者的预后和存活率并不理想。HCC的早期诊断和早期治疗可以显著提高患者的整体治疗效果。然而,缺乏有效的预后指标极大地限制了总体生存率,这表明预后标志物的鉴定对于改善肝癌预后、丰富治疗方案至关重要[3,4]。
G2/S期应答相关蛋白1(G2and S phase-expressed protein 1,GTSE1)是定位于染色体22q13.2~q13.3的p53诱导基因,在细胞周期的G2期和S期显著表达[5,6]。GTSE1被GTSE1启动子区域上的功能性p53结合而激活,并编码GTSE1蛋白,导致从G2期到M期的转换延迟[7]。研究表明,GTSE1的过表达有助于促进不同肿瘤中细胞的增殖、迁移和侵袭,这是通过将p53转位到细胞质中来实现的[8,9]。
研究表明,GTSE1的过表达与乳腺癌、膀胱癌和肝细胞癌患者的不良预后相关,但其在癌症的发生、发展中的作用机制知之甚少[10,11]。本研究利用生物信息学技术探究了GTSE1在人类癌症中的表达和预后意义,以及在HCC中GTSE1基因表达与免疫细胞浸润的关系。
资料与方法
1.数据来源及处理:本项研究数据来自癌症基因组图谱(The Cancer Genome Atlas, TCGA)。使用R 4.1.3整合原始数据并验证数据库分析结果。
2.数据分析:Kaplan-Meier数据库含有多数据库的基因表达数据以及生存信息,其中包含360例肝癌患者的生存数据,可根据基因的中位表达水平将患者分为高表达组和低表达组进行生存分析。基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库利用表达数据和临床数据,可以在线分析不同基因的生物学作用,例如预后相关生物学标志物,癌症特异性非编码RNA和COVID-19相关基因ACE2的表达谱。人类蛋白质图谱(Human Protein Atlas,HPA)数据库基于蛋白组学、转录组学以及系统生物学数据,可以绘制组织、细胞、器官等图谱。

图1 GTSE1在不同癌症组织中的差异表达

图2 HPA数据库中GTSE1在细胞中的定位
应用Kaplan-Meier数据库、生物医学数据分析网站SangerBox、GEPIA数据库进行生存数据分析,验证GTSE1基因表达与HCC以及其他不同类型癌症中的多层面预后相关性,包括总体生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)、无病生存期(disease-free survival,DFS)、疾病特异性生存期(disease-special survival,DSS)。使用Kaplan-Meier法分析HCC患者不同临床病理因素中GTSE1基因表达与预后的相关性,其中HCC分期方法包括巴塞罗那分期、TNM分级。应用HPA数据库鉴定GTSE1在人样本中的蛋白表达。
肿瘤免疫估计资源(Tumor Immune Estimation Resource,TIMER)数据库利用高通量测序(RNA-Seq表达谱)数据分析肿瘤组织中免疫细胞的浸润情况,主要提供B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、中性粒细胞和树突细胞等6种免疫细胞的浸润情况。本研究利用TIMER数据库分析GTSE1在不同癌症中的表达差异,及GTSE1与HCC中免疫细胞浸润水平的相关性分析(P<0.05)。
应用R 4.1.3软件处理从TCGA-LIHC数据集下载的RNA-Seq数据和临床数据,得到19620个基因,根据GTSE1表达量计算其中位数,应用DESeq2包,将基因集分为高、低表达组,取log2|fold change|>2,P<0.05,得到了458个GTSE1相关差异表达基因,应用R软件的ClusterProfiler包,对GTSE1相关差异表达基因进行基因本体(gene ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析(P<0.05)。
3.标本收集和免疫组化验证GTSE1在人体HCC组织中的表达:(1)样本采集:收集3例确诊为HCC患者术后的肝癌及癌旁组织。本研究获武汉大学中南医院医学伦理学委员会批准(伦理学审批号:临研伦2022019),研究对象及家属已签署知情同意书。(2)抗体及方法:GTSE1抗体购自北京博奥森生物技术有限公司,山羊抗兔鼠通用二抗购自丹麦Dako公司。采用间接法行免疫组化实验。(3)实验步骤:肝癌组织石蜡切片经二甲苯脱蜡及梯度乙醇充分水化,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次。抗原修复:用乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗原修复缓冲液煮沸,95℃ 15min。阻断内源性过氧化物酶:切片放入3%过氧化氢溶液,室温避光孵育25min,PBS液洗3次。血清封闭:在组化圈内滴加3% 牛血清白蛋白(Bovine serum albumin,BSA)均匀覆盖组织,室温封闭30min。敷一抗,4℃孵育过夜。玻片置于PBS中晃动洗涤3次。敷二抗,室温孵育50min。二氨基联苯胺(diaminobenzidine,DAB)显色,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗终止显色。苏木精复染细胞核。脱水封片。
结 果
1.GTSE1在癌组织和正常组织中的差异表达:使用TIMER数据库对TCGA数据集处理分析。结果表明,在乳腺浸润癌(breast invasive carcinoma,BRCA)、胆管癌(cholangiocarcinoma,CHOL)、肝细胞癌(hepatocellular carcinoma,HCC)等20种肿瘤中,GTSE1的表达显著上调(P<0.001)。为了进一步了解GTSE1在HCC中的表达情况,本研究使用R 4.1.3软件整理分析了从TCGA数据库获取的TCGA-LIHC数据,取log2|fold change|>2,P<0.05,得到369个肿瘤样本和50个正常组织样本,以及GTSE1在样本中的表达数据,研究发现,GTSE1在HCC组织中的表达较正常组织显著上调,详见图1。
2.免疫组化验证GTSE1在HCC组织中的表达情况:通过HPA数据库分析GTSE1在人基因组图谱中的表达及蛋白定位发现,人类细胞系RH-30的免疫荧光染色显示该蛋白表达定位在质膜和中心体(图2)。免疫组化实验结果显示,GTSE1蛋白定位于细胞质,在100倍和400倍镜下观察发现,在HCC组织中,GTSE1的表达较癌旁组织表达水平更高。免疫组化染色后,细胞质内出现淡黄色颗粒为弱阳性,深棕色颗粒为强阳性表达(图3)。
3.GTSE1多方面预后价值分析:本研究按不同生存指标对GTSE1基因表达与HCC及其他肿瘤患者预后之间的关系进行了评估。生存指标包括OS、DSS、PFS和DFS。单因素生存分析揭示,GTSE1的表达与不同癌症患者OS的关系,发现在肝细胞癌、胶质瘤等18种肿瘤中,GTSE1高表达预后差(P<0.05),而在胸腺癌中,GTSE1低表达预后差(P<0.01),详见图4。本研究进一步完善了生存曲线分析。应用GEPIA数据库分析发现,GTSE1高表达与HCC预后较差相关(P<0.05,图5中E、F),使用Kaplan-Meier法进一步验证,GTSE1高表达与HCC预后较差显著相关,详见图5中A~D。

图4 33种肿瘤中GTSE1表达危险比的森林图

图5 GTSE1基因表达与HCC患者预后的关系
4.GSTE1基因表达与肝细胞癌患者病理因素、临床特征的相关性分析:应用Kaplan-Meier数据库分析了GTSE1基因表达与HCC患者临床特征、病理因素之间的关系,结果见表1。数据库中包含364例HCC患者,GTSE1高表达与女性及男性患者不良预后显著相关,但两者间无明显差异。3种HCC分期或分级方式中,均发现GTSE1高表达的患者预后不良。无血管侵犯或未感染肝炎病毒的肝癌患者中,GTSE1过表达的患者预后更差(P<0.05)。
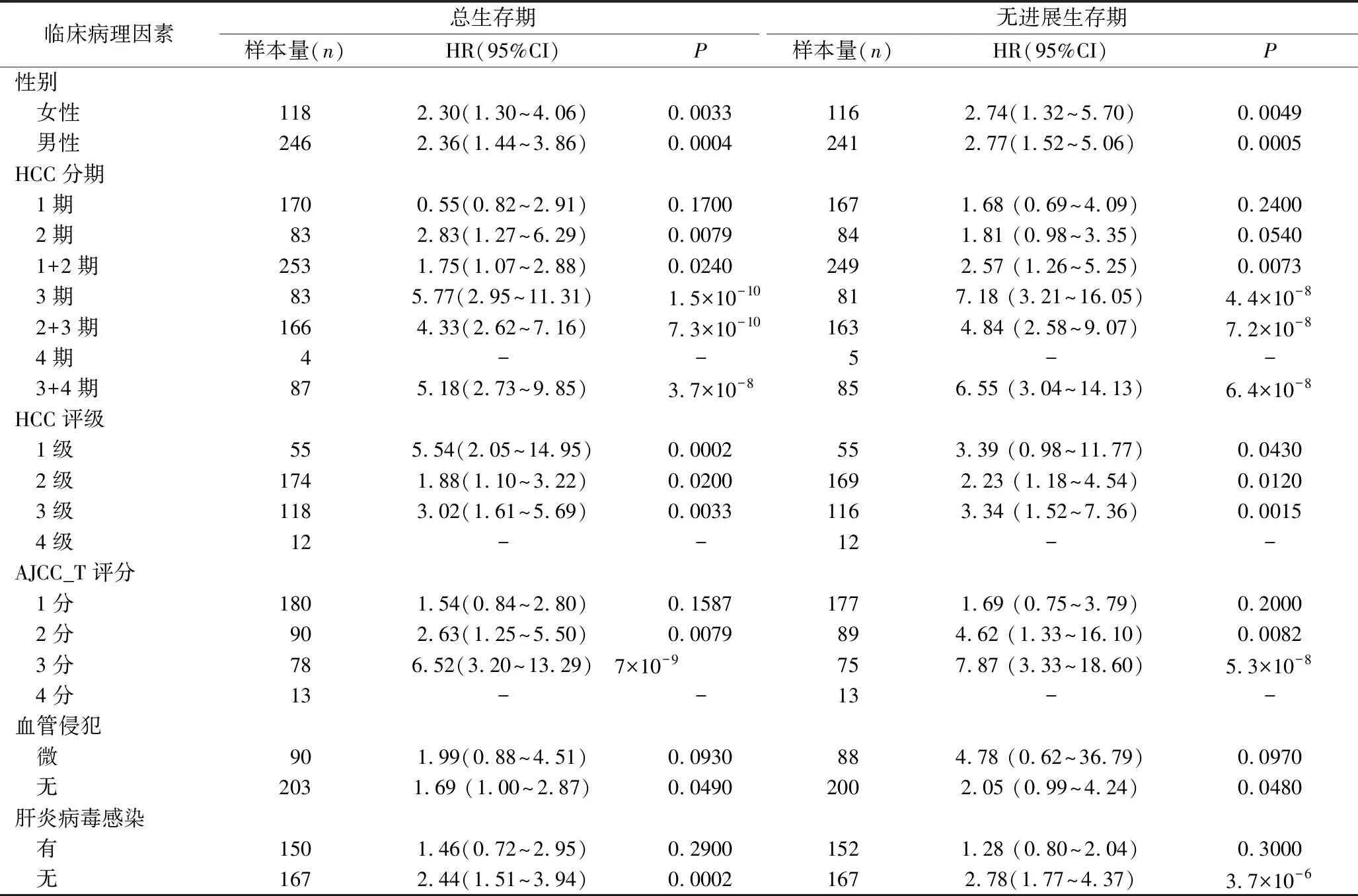
表1 Kaplan-Meier数据库分析GSTE1基因表达与肝细胞癌患者临床特征、病理因素的相关性
5.GTSE1的表达与免疫细胞浸润水平的相关性分析:研究表明,肿瘤免疫微环境在肿瘤的发生、发展过程中具有重要的作用。本研究使用来自TIMER数据库中371例HCC患者的数据,对GTSE1在HCC组织中的表达与免疫渗透水平之间的关系进行了相关性分析。结果表明,GTSE1基因的表达与肿瘤纯度(r=0.128)呈正相关(P<0.05),且在HCC中,GTSE1表达与B细胞(r=0.484)、CD8+T 细胞(r=0.296)、CD4+T 细胞(r=0.402)、巨噬细胞(r=0.484)、中性粒细胞(r=0.360)和树突状细胞(r=0.425)的浸润水平呈显著正相关(P<0.001),详见图6。
6.GTSE1在HCC中的GO和KEGG富集分析:GO富集分析由生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3部分组成。BP分析结果表明,GTSE1相关差异基因在核分裂、有丝分裂核分裂、细胞器裂变等途径中显著丰富;在CC分析中,GTSE1产物发挥作用的主要场所包括突触膜、离子通道配合物等;MF分析表明,显著丰富的途径是通道活动和离子通道活性。KEGG富集分析发现,GTSE1相关基因参与的主要通路包括细胞周期、神经活性配体-受体相互作用等,详见图7。

图7 富集分析结果
讨 论
肝癌由于早期缺乏特异性的症状和体征,多数发现时已经处于晚期,具有高病死率、低存活率等特点。
本研究通过多数据库联合分析,以及免疫组化实验验证,明确了GTSE1在肿瘤组织中的表达水平,及其在HCC发生、发展中发挥着一定的作用。TIMER数据库分析表明,在肝细胞癌、胆管癌等20种肿瘤中,GTSE1的表达显著上调。采用Kaplan-Meier数据库分析GTSE1表达与预后的相关性,本研究发现,GTSE1过表达与HCC不良预后显著相关。通过分析GSTE1基因表达与HCC患者临床特征、病理因素的相关性,进一步验证了GTSE1过表达对HCC患者预后的不良影响。研究表明,肝癌在男性患者中发生率和病死率均比女性高2~3倍,但在本研究中,男性患者与女性患者的预后未见明显差异,这可能是由于Kaplan-Meier数据库样本量较小导致的[12]。GTSE1在乳腺癌、肢端黑色素瘤、透明细胞肾细胞癌、肝细胞癌等多种癌症中表达明显上调,且与肿瘤预后不良相关[13,44]。这与本研究结果一致。本研究认为,GTSE1可作为一种潜在的HCC预后生物学标志物,但其影响肝癌发生、发展的具体机制还需进一步探索。
肿瘤微环境是由肿瘤细胞、非恶性细胞、血管、细胞外基质和其他物质组成的复杂结构。不同类型的免疫细胞在肿瘤微环境中发挥不同的调节作用[15]。研究表明,癌细胞与肿瘤微环境的各种成分之间的相互作用对肿瘤发生免疫逃逸有着极大的影响,最终导致肿瘤的增殖、复发和转移[16]。肿瘤微环境显著影响治疗反应和临床结果[17]。免疫细胞是肿瘤基质的重要组成部分,且在其中发挥关键作用[18]。先天免疫细胞(巨噬细胞、中性粒细胞、树突细胞和自然杀伤细胞等)以及适应性免疫细胞(T细胞和B细胞)在肿瘤中存在时有助于肿瘤进展[19]。中性粒细胞在肿瘤内的炎症中起着核心作用,中性粒细胞通过释放活性氧或蛋白酶可促进肿瘤发生,并可促进肿瘤中血管生成从而促进肿瘤发生、发展[20,21]。GTSE1对HCC免疫微环境的影响及其作用机制尚未得到充分研究。通过TIMER数据库分析发现,在HCC中,GTSE1基因的表达与肿瘤纯度呈正相关(P<0.05),与B细胞、CD8+T细胞等6种免疫细胞的浸润水平呈显著正相关(P<0.001)。
本研究认为,GTSE1在肝细胞癌中可通过促进免疫细胞浸润从而影响HCC的发展,且对肿瘤免疫具有重要作用,未来对GTSE1在肝癌中免疫细胞浸润的前瞻性研究可能会为肿瘤发生、发展及免疫细胞浸润提供更多见解,并优化肝癌治疗策略,以提高免疫治疗的疗效。
富集分析结果表明,GTSE1相关的差异表达基因主要富集于核分裂、细胞器裂变、离子通道活性等基因模块,提示其与肿瘤发生、发展密切相关;其参与的信号通路主要包括神经活性配体-受体的相互作用、细胞周期等,为进一步研究GTSE1参与肿瘤生物学的具体分子机制提供了思路。
综上所述,GTSE1在肿瘤的发生、发展中发挥着重要作用,为进一步研究GTSE1表达对肿瘤预后的影响及潜在分子机制提供了理论基础。
利益冲突声明:所有作者均声明不存在利益冲突。

