鸭源多杀性巴氏杆菌的分离鉴定及药敏试验
郭伟娜, 王紫苇, 马佰贺, 王 旋
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.动物营养调控与健康安徽省重点实验室,安徽 凤阳 233100)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)是一种具有荚膜、没有鞭毛和芽孢的革兰阴性菌,瑞氏染色或美蓝染色表现为明显的两极浓染现象,在世界各地分布广泛。Pm可感染哺乳动物、鸟类、禽类、爬行动物甚至人类,引起急性出血性败血症和慢性肺炎、萎缩性鼻炎、皮肤坏死、脑膜炎等,病死率较高,对我国畜牧业的健康发展和公共卫生安全影响较大[1-2]。目前,Pm根据荚膜多糖抗原结构的不同,分为A、B、D、E、F等5个血清型;根据脂多糖结构的差异,分为16个血清型[3-4]。其中,A型、B型和E型Pm菌株主要引起牛出血性败血症,D型Pm菌株主要引起猪传染性萎缩性鼻炎,A型Pm菌株能够引起猪的肺疫,而禽霍乱多数是由A型和F型Pm菌株引起,但也有报道分离到荚膜B型的鸡源Pm菌株[5]。多杀性巴氏杆菌对鸡、鸭、鹅具有高度易感性,引起的出血性败血症又称为禽霍乱,发病较为严重,病死率较高,对养禽业造成重大的经济损失[6-7]。长期以来,抗菌药物的使用是防治禽霍乱等细菌病的常用方法之一,但是由于临床上不规范的药物使用或滥用导致常用药物效果降低,所产生的耐药性非常严重[8-9]。研究表明,养殖场严格的饲养管理制度以及合理的疫苗免疫是预防该病的关键措施[10]。本研究主要是从一例疑似禽霍乱的病死鸭肝脏中进行病原菌的分离鉴定及药敏试验,为深入研究多杀性巴氏杆菌的致病机理和防控提供一定参考。
1 材料与方法
1.1 材料
血琼脂培养基和药敏纸片购于比克曼生物科技(湖南常德)有限公司。普通营养琼脂培养基、麦康凯培养基购于海博生物(青岛)有限公司。PCR MasterMix预混液、50×TAE缓冲液、DL-2000 DNA Marker等均购于生物工程(上海)有限公司。
1.2 样品采集
安徽某养鸭场送检的4只20日龄病死肉鸭,剖检后发现心冠脂肪有出血,肺脏也有出血点或出血斑,肝脏病变最典型,肿大变脆,表面有大量针尖大小的灰白色坏死点,如图1所示。疑似禽霍乱,无菌采集其肝脏组织进行病原的分离鉴定。
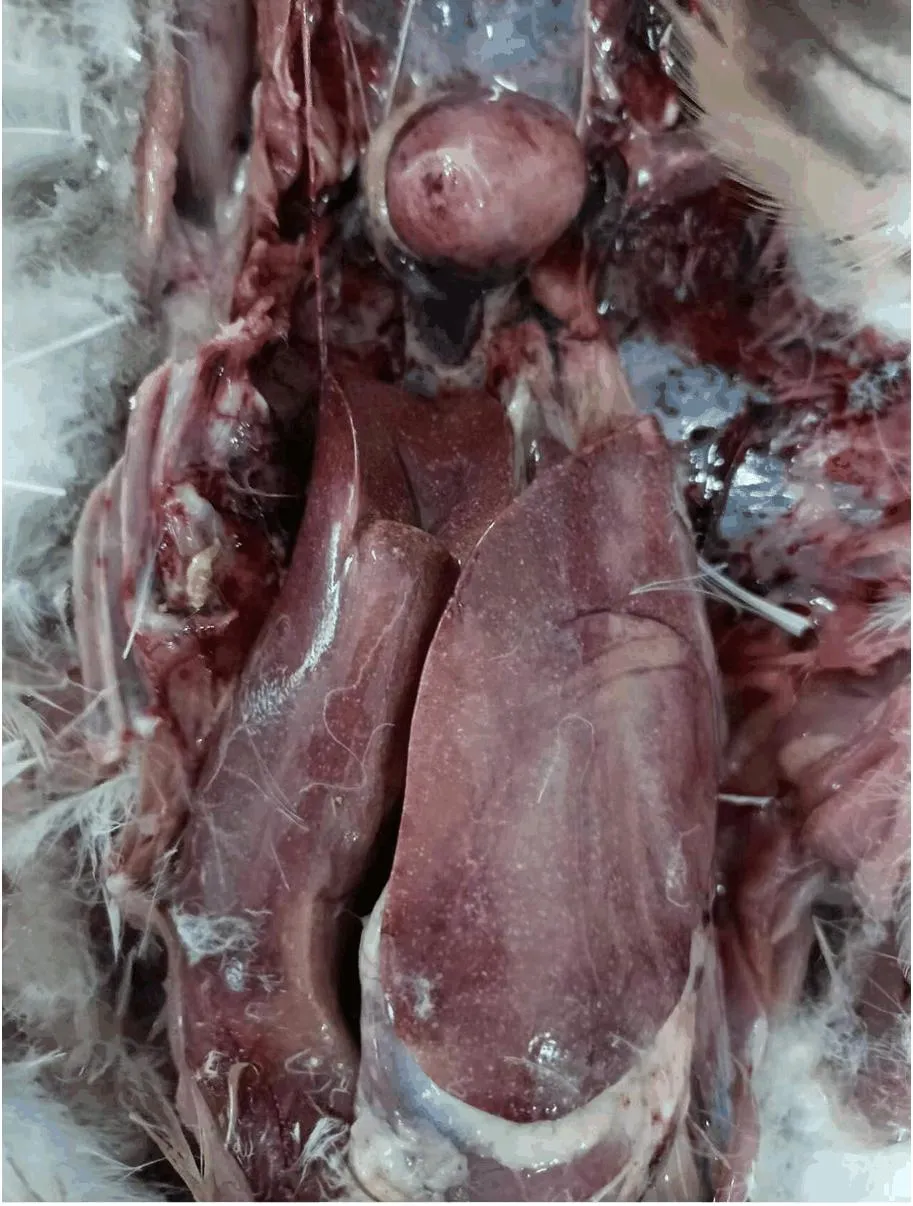
图1 病死鸭的剖检病变Fig.1 Pathological changes of dead ducks
1.3 分离纯化
无菌条件下采集病死鸭的肝脏病料组织,划线接种于普通营养琼脂培养基、麦康凯培养基及血琼脂培养基上,然后放入恒温培养箱于37 ℃培养24 h,观察分离菌的生长状况及菌落形态;挑取符合Pm典型菌落特点的单菌落在血琼脂培养基上进一步分离纯化,对纯化培养后的菌落进行革兰染色和显微镜观察。
1.4 模板的制备
蘸取纯化后细菌的单个菌落放置于50 μL灭菌的超纯水中,充分振荡混匀。采用煮沸法提取其核酸:100 ℃煮沸10 min,冰浴5 min,最后12 000 r/min离心5 min,离心后吸取上清液即为DNA模板,于-20 ℃保存备用。
1.5 引物合成
细菌16S rRNA基因的通用引物序列[11],由通用生物(安徽)有限公司合成引物,引物详细序列及扩增产物大小如表1所示。

表1 引物序列及目的片段大小Table 1 Primer sequences and size of target fragments
1.6 16S r RNA的PCR扩增及测序
PCR反应体系为50 μL:2 μL分离菌株核酸模板、25 μL PCR MasterMix、2 μL上下游引物、19 μL超纯水。PCR扩增程序为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 10 min。取1.25%琼脂糖进行PCR产物凝胶电泳检测,将有目的条带的PCR扩增产物回收后由通用生物(安徽)有限公司进行分离菌株16S rRNA测序,测序结果用DNAStar软件中的MegAlign程序进行同源性分析和遗传进化树的构建。
1.7 药敏试验
圆纸片扩散法测定分离菌株对六大类共18种抗菌药物(四环素类:四环素、强力霉素、米诺环素;氨基糖苷类:阿米卡星、链霉素、庆大霉素、卡那霉素;青霉素类:氨苄西林、哌拉西林;多肽类:多粘菌素B、万古霉素;林可霉素类:林可霉素;头孢菌素类:头孢唑林、头孢哌酮、头孢氨苄、头孢曲松、头孢呋辛钠、头孢他啶)的敏感性,用抑菌圈的大小判定其敏感程度。
2 结果与分析
2.1 病原菌的分离及染色结果
该分离菌株在血琼脂培养基上菌落特征为稍微隆起、表面光滑、湿润、灰白色、露珠样半透明的圆形菌落(图2),但在普通营养琼脂和麦康凯培养基上不生长。该分离菌株用革兰染色镜检,可见典型的两极浓染的红色球杆菌(图3),符合Pm的染色特征。

图2 血琼脂培养基上的分离菌菌落特征Fig.2 Colony morphology of isolated bacteria on blood agar medium

图3 革兰染色镜检结果(×1 000)Fig.3 Gram staining microscopic results (×1 000)
2.2 16S r RNA的PCR扩增及测序结果
16S r RNA的PCR扩增结果显示有1 500 bp左右的目的条带(图4)。PCR扩增产物的测序结果表明,分离菌株的基因序列与Pm菌株Q(GenBank登录号:CP033597)的序列相似性为99.86%。将分离菌株的16S rRNA测序结果与13株参照菌株相应序列进行同源性比对分析,并进行遗传进化树的构建,如图5~6。图中Seq1表示分离菌株序列,其他参考菌株用GenBank登录号代表。由图5可知,该分离菌株与多杀性巴氏杆菌参照菌株具有99.3%~100%的同源性;由图6可知,分离菌株与3个参照菌株均属于同一分支,亲缘关系较近,从而鉴定该分离菌株为多杀性巴氏杆菌。

图4 16S rRNA的PCR扩增结果Fig.4 Results of PCR amplification for 16S rRNA注:M为DL-2000 Marker;1为分离菌株;2为阴性对照。

图5 16S rRNA基因序列同源性分析Fig.5 Phylogenetic tree based on 16S rRNA sequences

图6 基于16S rRNA基因构建的遗传进化树Fig.6 Homology analysis of 16S rRNA sequence
2.3 药敏试验结果
Pm分离菌株对18种药物的抑菌圈测定结果如表2所示,分离菌株对米诺环素的敏感性最高,抑菌圈直径为19 mm;对四环素、强力霉素、庆大霉素、氨苄西林、头孢哌酮表现中度敏感,其他药物均为耐药。

表2 分离菌株的药敏试验结果Table 2 Results of drug susceptibility test of the isolates
3 结论与讨论
Pm是人兽共患病病原微生物,能够感染多种家畜、家禽、经济动物、野生动物等,导致禽霍乱、牛出血性败血症、猪肺疫、兔多杀性巴氏杆菌病等疾病。该病多为地方流行性,不同地区、不同动物体内主要的流行血清型有一定差异[12-13]。因此,研究Pm的致病性以及如何防控该病具有重要意义。李亚菲等[14]从贵州省某养鸭场分离到7株Pm,所采用的病料是脑、脾脏和肝脏组织,PCR扩增的kmt1基因序列与参考菌株相应序列的同源性高于99%。张小波等[15]从贵州遵义某养鸭场分离到1株花边鸭源Pm,其16S rRNA序列与Pm菌株LSBS1的同源性为99.93%。本研究从4只病死鸭的肝脏中分离鉴定到一株未知菌,其菌落生长特征和染色特点均与Pm相符,16S rRNA测序结果与Pm参考菌株Q的相似性为99.86%,并且亲缘关系最近。
本研究药敏试验结果表明,Pm分离菌株对米诺环素的敏感性最高,抑菌圈直径为19 mm;对四环素、强力霉素、庆大霉素、氨苄西林、头孢哌酮表现中度敏感,其他药物均为耐药。所以,推荐养殖户及时采用米诺环素进行治疗,后期反馈用药治疗效果不错。王红琳等[16]分离的一株蛋鸭源多杀性巴氏杆菌对头孢类、链霉素和四环素均耐药,与本研究结果一致。王喜等[17]从云南某鸡场分离到1株鸡源多杀性巴氏杆菌,该菌株对卡那霉素、链霉素、四环素等12种药物耐药,但对头孢氨苄、头孢他啶、氨苄西林敏感;伍澜等[5]从湖北荆州某鸡场分离到1株荚膜B型的鸡源Pm,该菌株对头孢类、四环素类、氨基糖苷类和喹诺酮类等多种药物高度敏感,与荚膜A型禽源Pm对药物的敏感性差异较大,例如于勇等[7]分离的4株荚膜A型的Pm对卡那霉素、四环素等7种抗生素表现为全部或部分耐药。严专强等[18]从我国华东、华南、西南地区的番鸭中分离鉴定了13株Pm,以及肉鸡中分离鉴定到4株Pm,这些菌株对卡那霉素、四环素、庆大霉素和链霉素等均表现耐药,与本研究不完全相符。郑小兰等[19]分离鉴定到鸭源Pm共3株,并且对多粘菌素B和头孢唑林均较为敏感,本研究却表现为耐药,但对链霉素的敏感性一致,均为耐药。陈国权等[20]从肉鸭中分离到1株Pm,同时对头孢菌素类、庆大霉素等表现敏感,本研究中却为耐药。
综上可知,不同地区各个养殖场分离的多杀性巴氏杆菌菌株对抗菌药物的敏感性有明显差异。细菌耐药性产生的原因较多,如不同养殖户的用药习惯不同,长期不规范用药、甚至滥用抗菌药的现象较为严重。建议养殖户在临床上如有禽霍乱发生,必须结合病原分离及药物敏感试验,筛选敏感药物尽早治疗,注意合理用药,降低经济损失。

