镉诱导雏鸡肝脏的损伤作用
顾成霞, 王 艳, 张 宇, 唐中齐, 叶瑞旗, 汪梦杰, 刘 畅,2,3, 曹迷霞,2, 李 磊,2,3*
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.动物营养调控与健康安徽省重点实验室,安徽 凤阳 233100;3.农业农村部猪肉质量安全控制重点实验室,安徽 凤阳 233100)
镉是毒性很强的环境污染物之一[1],为人和动物非必需元素。自然界中,镉元素主要以化合态形式存在,常与铅、汞等元素伴生。镉是动物性食品中主要污染物之一,动物常因采食受污染饲料而富集在组织内,随着食物链最终进入人体。中国环境中镉污染日趋严重[2],被镉污染的空气、土壤和食品对人体危害严重,会导致人产生骨痛、自发性骨折、骨缺损等危害[3]。镉对人和其他哺乳动物所有的组织器官都具有严重毒性,如肝、肾、睾丸等[4]。镉的毒性作用常表现为抑制DNA修复酶的活性、氧化应激、细胞死亡等[5],虽然镉不能直接造成氧化应激损伤,但镉可以消耗大量谷胱甘肽(Glutathione,GSH),抑制抗氧化酶活性,导致活性氧(Reactive Oxygen Species,ROS)的大量生成,并伴随丙二醛(Malondialdehyde,MDA)等脂质过氧化产物显著增加[6],其毒性与接触的时间、物质的剂量、接触途径等有关。
肝脏具有排泄和分泌胆汁、造血等功能。作为动物机体内最重要的解毒器官,血液流经肝脏时,部分有害的物质可被肝脏中产生的酶分解排出体外。镉进入机体,在体内形成镉-硫蛋白[7],经过血液循环选择性地在肾脏和肝脏中蓄积。肝脏是镉的主要的靶器官之一,镉可造成严重的肝脏损伤[8]。因镉暴露时间与剂量的差异,导致不同组织器官中镉的蓄积含量有所不同,继而产生的毒性效应存在差异。以往的研究更多关注镉对啮齿动物肝脏及肾脏功能的毒性作用,对镉暴露引起家禽毒性的研究相对较少。本试验以雏鸡为研究对象,观察镉暴露对雏鸡肝组织病理变化的影响,以期为预防和治疗镉致雏鸡肝损伤提供试验依据。
1 材料与方法
1.1 供试材料
1.1.1 药品与试剂 氯化镉(CdCl2,纯度>98%)购于美国sigma公司;天门冬氨酸氨基转移酶(Aspartate Transaminase,AST)、丙氨酸氨基转移酶(Alanine Transaminase,ALT)、还原型谷胱甘肽(Glutathione,GSH)、超氧化物歧化酶(Superoxide Dismutase,SOD)、丙二醛(Malondialdehyde,MDA)检测试剂盒均购自南京建成生物工程研究所;白细胞介素-1β(Interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(Tumour Necrosis Factor-α,TNF-α)试剂盒购自武汉华美生物公司,其他试剂均为分析纯。
1.1.2 试验动物 200只1日龄爱拨益加雏鸡由江苏广大畜禽有限公司提供,适应性饲养3 d,期间自由采食与饮水。
1.2 试验方法
1.2.1 试验分组与处理 将200只1日龄爱拨益加雏鸡适应性饲养3 d后,随机分成4组,每组5个重复,每个重复为10只。空白对照组灌胃生理盐水,染毒组按表1一次性灌胃不同剂量的CdCl2溶液。
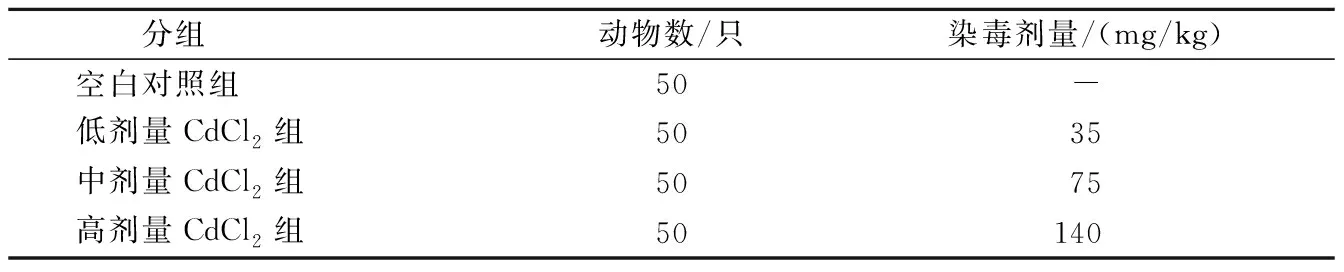
表1 试验分组与处理Table 1 Groups and treatments
1.2.2 样品采集与处理 雏鸡染毒24 h后,心脏采血处死动物,血液室温静置1~2 h,待血液充分凝固后,在2 000 r/min条件下离心10 min,吸取上层血清,分装到无菌的1.5 mL离心管中,置于-20 ℃保存备用;迅速剖解动物,分离肝脏,在每只动物肝脏相同部位取大小适当的一份组织置于4%中性多聚甲醛溶液进行固定处理,用于组织病理学检测,另取数份组织经液氮迅速冷冻后转入-80 ℃冰箱保存备用。
1.3 测定项目及分析方法
1.3.1 血清转氨酶活性测定 按照试剂盒说明操作测定血清中ALT与AST活性,将测定结果带入标准曲线计算各样本中ALT、AST活性。
1.3.2 肝脏组织病理学观察 摘取雏鸡肝脏部分叶片,置4%中性多聚甲醛进行固定,不同浓度梯度乙醇进行脱水处理24 h,肝组织快速脱水后,用二甲苯透明10 min,石蜡包埋,制成5 μm厚的切片,将制好的切片采用苏木精-伊红染色(Hematoxylin-eosin Staining,H&E),光学显微镜下观察肝细胞的病理学变化。
1.3.3 抗氧化指标的测定取 100 mg肝组织加入0.9 mL生理盐水,冰浴条件下制备组织匀浆,2 500 r/min离心10 min,吸取上清液后按照试剂盒说明书测定SOD活性和GSH、MDA含量,并以样品的蛋白浓度对结果进行校正。
1.3.4 血清中细胞因子含量的检测 血清在室温下融化,2 500 r/min离心10 min,吸取上层样品,严格按照ELIAS试剂盒说明书步骤操作。将测定结果带入标准曲线计算各样本中TNF-α、IL-1β与IL-6质量浓度。
1.3.5 数据处理和统计学分析 结果以“平均数±标准差”表示,采用SPSS 22.0软件对试验数据进行单因素ANOVA分析,多重比较采用LSD检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 临床症状观察
雏鸡经适应性饲养后,给予不同剂量CdCl2,随后观察染毒雏鸡的一般状况发现,高剂量组(140 mg/kg)雏鸡染镉后,精神沉郁,反应迟钝,8 h后该组试验动物陆续死亡,中、低剂量组(35、70 mg/kg)试验动物精神略显沉郁,无其他明显中毒症状。鉴于高剂量组镉毒性过大,造成多数动物直接死亡,故本研究主要测定了中、低剂量染镉组的相关指标。
2.2 镉对肝脏组织结构的影响
正常肝组织中,肝细胞以中央静脉为中心,向周围呈现放射状的排列方式,形成细胞厚度的细胞板,称为肝板,肝板之间以肝血窦相连。如图1所示,利用H&E染色观察肝组织的病理变化(图1),空白对照组雏鸡肝脏组织细胞排列整齐,染色均一,未发现明显病理变化。35 mg/kg CdCl2组处理24 h中出现细胞核成块聚集,染色不清晰,肝小梁拥挤。70 mg/kg CdCl2组处理24 h中空泡增多肝窦受压变窄,伴有出血的现象,中央静脉周围有少量炎性细胞浸润。肝细胞疏松,出现不同程度的肿胀。140 mg/kg CdCl2组处理24 h中细胞局部病灶坏死明显,肝小梁排列受到破坏,细胞核皱缩加剧,有少量出血现象。肝组织进行染镉处理后均出现明显的病理变化,如细胞边界模糊,肝细胞中出现空泡,炎症和凋亡增多。说明镉染毒处理对肝细胞结构出现破坏作用。
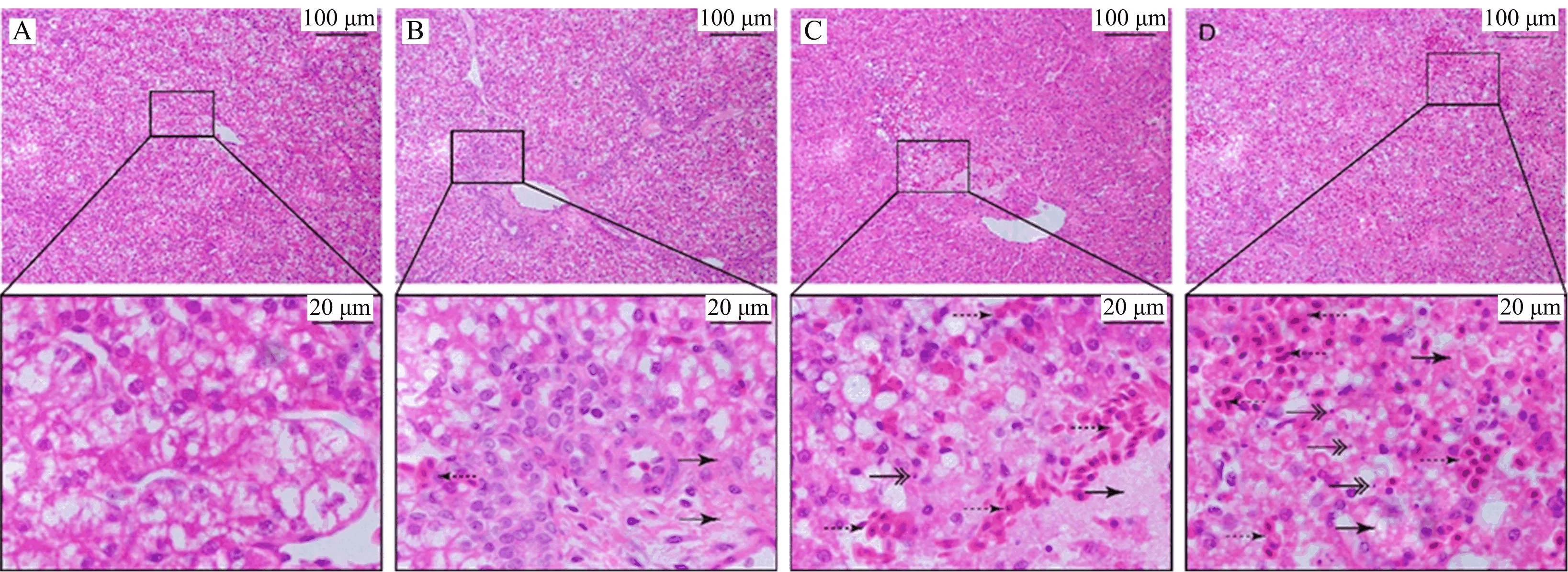
图1 CdCl2对雏鸡肝脏组织结构的影响Fig.1 Effects of CdCl2 on the histological structure of chicken liver注:A为空白对照组;B为35 mg/kg CdCl2处理24 h;C为70 mg/kg CdCl2处理24 h;D为140 mg/kg CdCl2处理24 h。“→”指示出血;“→”指示细胞坏死;“→”指示细胞核破碎。
2.3 镉对雏鸡血清中ALT/AST活性的影响
ALT和AST是存在于肝细胞内的2种转氨酶,正常情况下血液中浓度很低。当肝细胞发生损伤时,细胞通透性发生改变,ALT和AST释放到血液中[9]。本试验中,雏鸡染镉24 h后,采用赖氏比色法检测镉损伤雏鸡肝脏血清中ALT与AST的活性,结果如图2所示。与空白对照组对比,35 mg/kg与70 mg/kg CdCl2处理组雏鸡血清ALT与AST的活性均显著上升(P<0.01),表明CdCl2可造成雏鸡肝脏损伤。
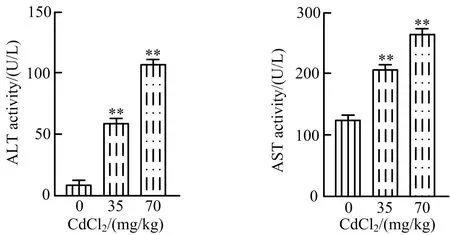
图2 CdCl2对雏鸡血清转氨酶活性的影响Fig.2 Effects of CdCl2 on serum transaminase activity in chicken serum注:**表示与空白对照比较差异极显著,P<0.01。下同。
2.4 镉对雏鸡肝脏氧化应激的影响
SOD是肝脏内重要的抗氧化酶,MDA是膜脂质过氧化中重要的产物。当机体出现镉中毒时,组织器官内的抗氧化系统遭到破坏,其中脂质过氧化物的代谢减慢,过氧化作用增强,造成肝脏的氧化损伤[10]。采用比色法,检测镉致雏鸡肝脏氧化应激损伤情况,结果如图3所示,同空白对照组相比,35、70 mg/kg CdCl2处理组GSH含量和SOD活性均显著下降(P<0.01),MDA含量显著提高(P<0.01),说明CdCl2造成雏鸡肝脏氧化应激损伤。
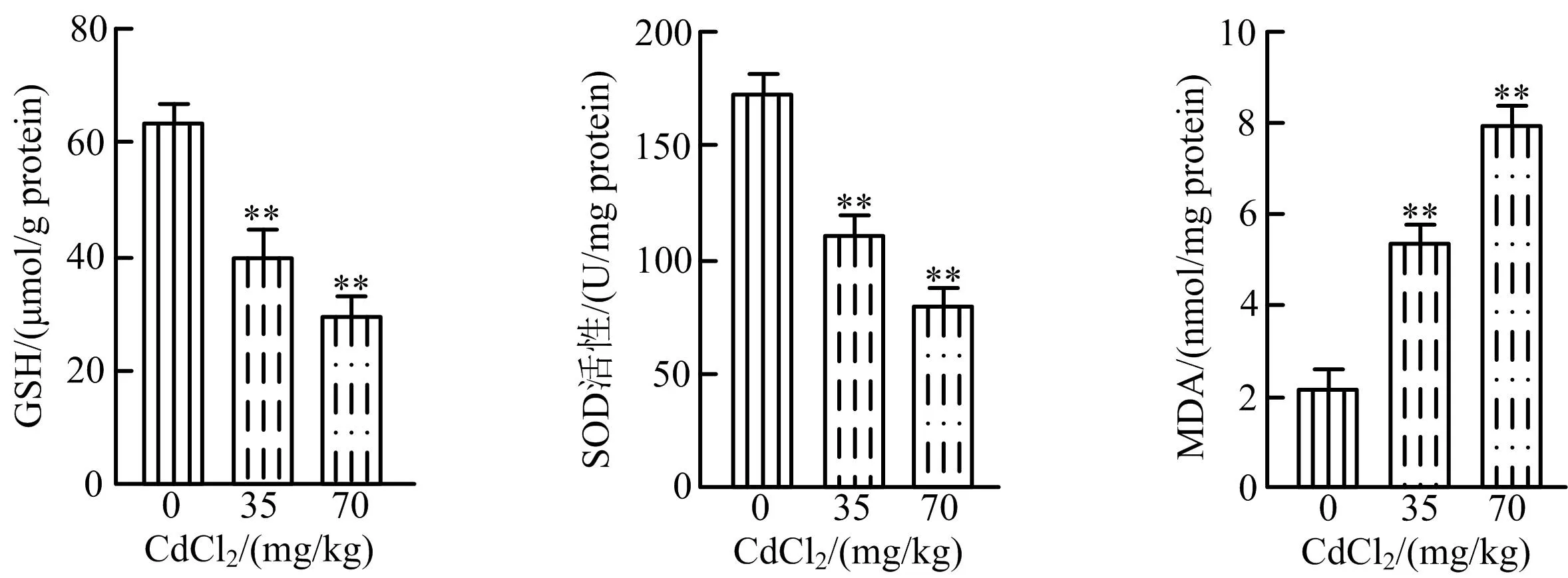
图3 CdCl2对雏鸡肝脏氧化应激损伤作用Fig.3 Effects of CdCl2 on oxidative stress injury in chicken liver
2.5 镉对雏鸡炎症反应的影响
IL-1β、IL-6和TNF-α能够诱导局部发生炎症反应,并调节免疫功能[11],促炎递质会刺激巨噬细胞释放大量的IL-1β、IL-6和TNF-α等细胞因子[12]。同时,肝脏是产生和清除细胞因子的主要场所,肝脏产生炎症可影响细胞因子代谢,对细胞因子清除作用显著降低,造成局部聚集。通过ELISA测定血清IL-1β、IL-6与TNF-α的含量,结果如图4所示。同空白对照组相比,35 mg/kg与70 mg/kg CdCl2处理组血清的IL-1β、IL-6与TNF-α均极显著上升(P<0.01),表明镉染毒处理可以造成肝组织发生炎症反应,导致肝脏出现损伤。

图4 CdCl2对雏鸡血清中IL-1β、IL-6与TNF-α质量浓度的影响Fig.4 Effects of CdCl2 on the contents of IL-1β, IL-6 and TNF-α in chicken serum
3 结论与讨论
镉的主要毒性靶器官之一为肝脏,可以引起肝脏产生严重的损伤甚至导致肝细胞坏死。AST和ALT是检测肝功能损伤的重要指标[13]。ALT参与机体蛋白质代谢,可加速氨基酸的转移。AST可促进蛋白质转氨基作用[14]。由于镉造成的肝脏损伤,导致肝细胞膜结构发生改变[15],产生一系列的损伤表现,肝细胞膜通透性增加,ALT和AST被释放入血液,引起血清中转氨酶的含量升高。本试验中,将雏鸡肝脏染镉24 h后进行采样处理检测,因高剂量CdCl2组毒性剂量过大,造成多数动物死亡,故此试验主要检测空白对照组、35 mg/kg CdCl2组、70 mg/kg CdCl2组相关数据。观察可得35 mg/kg CdCl2组、70 mg/kg CdCl2组相较于空白对照组中血清AST/ALT的活性显著升高(P<0.01),说明肝损伤模型建造成功[16]。对肝组织进行H&E染色镜下观察到35 mg/kg CdCl2组、70 mg/kg CdCl2组、140 mg/kg CdCl2组开始出现明显的病理变化,细胞边界模糊,肝细胞中出现空泡,炎性细胞和凋亡细胞增多。说明急性镉中毒引起雏鸡肝细胞组织结构受到损伤。
研究表明,急性镉中毒时,机体组织器官内抗氧化系统遭到破坏[17],对体内脂质过氧化物的清除能力降低,导致细胞膜脂质的过氧化作用增强,进而造成肝脏的氧化损伤[18]。SOD作为体内重要的抗氧化酶,能够特异地清除体内有毒自由基等物质,缓解自由基对机体的严重损害[19],本试验中35 mg/kg CdCl2组、70 mg/kg CdCl2组中SOD活性同空白对照组相比显著降低(P<0.01),活力明显受到抑制,说明染镉使肝细胞的抗氧化能力受到一定的抑制作用。GSH作为重要的抗氧化剂,能够维持机体正常的免疫作用,并具有解毒、抗氧化的功能。GSH在体内可以通过拮抗氧自由基的毒性作用,清除体内超氧阴离子及其他自由基,防止肝细胞受损。镉可导致肝细胞内GSH消耗增加[20],在本试验中,与空白对照组相比,35 mg/kg和70 mg/kg CdCl2处理组GSH水平显著降低(P<0.01),说明镉导致了肝细胞的氧化损伤。膜脂质过氧化最重要的产物是MDA[21],通过MDA含量的变化可了解膜脂质过氧化的程度,其含量的高低间接表达出细胞损伤的程度。本试验中,35 mg/kg 和70 mg/kg CdCl2处理组中雏鸡肝脏MDA含量显著高于空白对照组(P<0.01),表明急性镉染毒促进肝脏脂质的过氧化,这与何亚兰等[20]、Andjelkovic等[22]的研究结果一致。
炎症细胞因子参与并介导炎症反应,是通过一系列化学因子的作用来实现的,主要直接损伤血管内皮,导致血管通透性增加,使肝脏内的单核细胞释放出大量IL-6、IL-1β、TNF-α等其他有关炎症因子[23],引起体温升高、疼痛、白细胞渗出、血管扩张、通透性增加、过敏反应等主要炎症反应,严重的可导致多组织器官急性衰竭或死亡等。肝脏作为清除和产生细胞因子的主要场所,炎症反应会影响相关炎症因子的代谢作用,对细胞因子的清除作用减弱,而使血清中的细胞因子增多。本试验结果表明,35 mg/kg CdCl2组和70 mg/kg CdCl2组雏鸡血清中IL-1β、TNF-α和IL-6均呈现显著增加(P<0.01),说明镉进入体内到达肝脏造成机体产生损伤,引起组织中的单核巨噬细胞产生大量的细胞因子,细胞因子在肝脏内进行细胞免疫调节反应,诱导急性期反应蛋白产生,从而引起肝脏组织发生炎性反应[24],同时伴随临床症状的出现。
综上,肝脏作为急性镉中毒重要的靶器官之一,进入机体内可以使肝脏的抗氧化系统遭到破坏,体内脂质代谢增加,进而造成肝脏的氧化损伤。本试验对于重金属镉暴露的机制研究提供试验数据支持,为更好地预防家禽肝脏镉中毒提供了参考。

