非小细胞肺癌组织EMSY、PIDD表达与同源重组修复基因的相关性及其临床意义
陈丽萍,项保利,王布,姬泽萱,郭志青,赵建清
肺癌是人类最常见的恶性肿瘤,每年新发209万例,死亡176万例[1]。肺癌中约85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。NSCLC主要以手术为主的综合治疗,但治疗效果并不理想,病死率无明显改善[2]。EMSY转录抑制因子(EMSY transcriptional repressor, EMSY)是定位于DNA损伤部位的核蛋白,能结合乳腺癌易感基因2,诱导肿瘤基因组不稳定,促进卵巢癌等肿瘤发生发展[3-4]。p53诱导的死亡结构域蛋白1(p53-induced death domain protein 1,PIDD)富含亮氨酸的重复序列和死亡结构域,在细胞死亡信号传导中起衔接蛋白的作用[5]。研究发现,PIDD表达通过增强核因子κB的SUMO化修饰,增强核因子κB的活化,抑制DNA损伤后的肿瘤细胞凋亡,促进肿瘤恶性进展[6]。同源重组修复是DNA损伤后重要修复方式,其表达失调会导致驱动基因差错积累、肿瘤进展及放化疗抵抗的形成[7]。本研究通过检测NSCLC中EMSY、PIDD表达,探讨两者与同源重组修复基因表达及临床病理特征的关系,分析两者的诊断价值,报道如下。
1 资料与方法
1.1 临床资料 选择2022年1月—2023年4月河北北方学院附属第一医院呼吸与危重症医学科诊治NSCLC患者80例。男42例,女38例,年龄34~78 (64.27±6.29)岁;病程3~36(8.17±3.58)d;均无明显诱因及家族史;合并症:高血压22例,糖尿病7例;吸烟史30例;病理类型:腺癌48例,鳞癌32例;肿瘤最大径≤3 cm 55例,>3 cm 25例;TNM分期:Ⅰ~Ⅱ期54例,Ⅲ期26例;肿瘤分化程度:高中分化47例,低分化33例;合并淋巴结转移28例。本研究经医院伦理委员会审核批准通过(K2022104),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准: ①经病理组织学检查确诊为NSCLC;②患者既往无放化疗及免疫治疗等抗肿瘤治疗; ③病例临床及病理资料完整。(2)排除标准:①合并心、肝、肺等脏器异常;②有其他恶性肿瘤病史;③有肺结核、免疫系统疾病或其他严重感染。
1.3 观测指标与方法 EMSY、PIDD表达与同源重组修复基因: 术中留取NSCLC癌和癌旁组织(距癌组织>2 cm,病理证实为正常组织),于液氮中研磨,离心取上清。应用组织RNA提取试剂盒(购自北京索莱宝公司,货号R1240)提取组织总RNA,应用反转录试剂盒(购自北京索莱宝公司,货号RP1105)将总RNA反转录为cDNA。采用实时荧光定量聚合酶链反应检测组织中EMSY、PIDD及同源重组修复基因乳腺癌易感基因l(breast cancer susceptibility gene 1,BRCA1)、切除修复交叉互补基因1(excision repair cross-complementing gene 1,ERCC1)、核糖核苷酸还原酶亚单位1(ribonucleotide reductase catalytic subunit M1,RRM1)。实时荧光定量PCR试剂盒购自北京索莱宝公司,货号SR1110。实时荧光定量PCR仪器购自美国ABI公司,型号ABI 7500。引物由上海生工科技公司设计合成。引物序列见表1。反应条件:94℃ 5 min,94℃ 30 s,58℃ 34 s,72℃ 30 s,共40个循环。反应总体系共20 μl,包括2×SYBR Premix Es Taq 10 μl,上游、下游引物各1 μl,cDNA 1 μl和ddH2O 7 μl。以GAPDH为内参,采用相对比率2-△△Ct法处理试验数据。

表1 EMSY、PIDD表达与同源重组修复基因引物序列Tab.1 EMSY and PIDD expression and homologous recombination repair gene primer sequences
1.4 统计学方法 采用SPSS 26.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;计数资料以频数或率(%)表示,组间比较采用卡方检验;相关性分析采用Pearson相关分析;绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),分析EMSY、PIDD对NSCLC的诊断价值。P<0.05为差异具有统计学意义。
2 结 果
2.1 NSCLC癌组织中EMSY、PIDD及同源重组修复基因的表达 NSCLC癌组织中EMSY、PIDD、BRCA1、ERCC1、RRM1 mRNA相对表达量均高于癌旁组织,差异均有统计学意义(P<0.01),见表2。

表2 NSCLC癌组织中EMSY、PIDD及同源重组修复基因的表达比较Tab.2 Comparison of expression of EMSY, PIDD, and homologous recombination repair genes in NSCLC cancer tissue
2.2 NSCLC中EMSY、PIDD与同源重组修复基因表达的相关性 NSCLC癌组织中EMSY、PIDD mRNA与BRCA1、ERCC1、RRM1 mRNA表达均呈正相关(P<0.01),见表3。
2.3 NSCLC中EMSY、PIDD表达在不同临床病理特征中差异比较 低分化程度、有淋巴结转移及TNM 分期Ⅲ期NSCLC癌组织EMSY、PIDD mRNA表达分别高于高中分化程度、无淋巴结转移及TNM 分期Ⅰ~Ⅱ期NSCLC癌组织,差异均有统计学意义(P<0.01),见表4。

表4 癌组织中EMSY、PIDD mRNA表达在不同NSCLC临床病理特征中的比较Tab.4 Comparison of EMSY and PIDD mRNA expression in different clinical and pathological characteristics of NSCLC in cancer tissues
2.4 EMSY、PIDD mRNA表达对NSCLC的诊断价值 绘制 EMSY、PIDD mRNA及两项联合诊断NSCLC价值的ROC曲线,并计算曲线下面积(AUC),结果显示:EMSY、PIDD mRNA及两项联合诊断NSCLC的AUC分别为0.834、0.802、0.906,两项联合诊断NSCLC的AUC大于EMSY、PIDD mRNA单一诊断(Z=4.751、5.257,P均<0.001),见表5、图1。

图1 EMSY、PIDD mRNA诊断NSCLC的价值ROC曲线分析Fig.1 ROC curve analysis of the diagnostic value of EMSY and PIDD mRNA for NSCLC
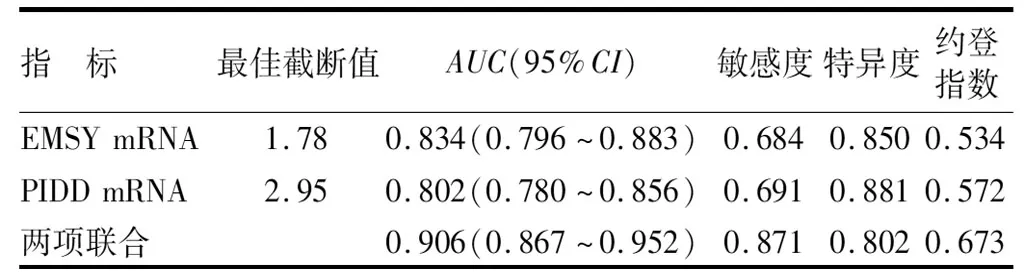
表5 EMSY、PIDD mRNA诊断NSCLC的价值比较Tab.5 Comparison of the diagnostic value of EMSY and PIDD mRNA in NSCLC
3 讨 论
NSCLC是肺癌最常见的类型,目前NSCLC的治疗包括手术、辅助放化疗等,特别是近年来靶向治疗及免疫治疗取得了巨大突破,但其仅限于部分具有特定驱动基因突变的患者。部分NSCLC患者存在放化疗抵抗或治疗一段时间后形成耐药性,均可导致术后肿瘤复发和转移,进而导致患者不良预后。深入研究NSCLC癌变机制对于NSCLC临床诊治意义重大。
同源重组修复是真核细胞内一种DNA双链断裂的修复方式,可在电离辐射、抗癌化疗药物及遗传毒性药物等损害过程中产生,DNA双链得不到修复,可导致染色体断裂和细胞死亡。BRCA1主要参与核苷酸剪切修复和同源重组修复。ERCC1是核苷酸剪切修复家族成员,与XPF形成异源二聚体,在DNA单链受损处的5’端进行剪切而发挥功能。RRM1是核苷酸还原酶调节M1亚单位,当ERCC1将DNA链中受损的部分切除后,DNA链上留下的空缺由RRM1提供的核苷酸来填补。本研究中,NSCLC中同源重组修复基因表达升高,与既往研究中免疫组化的结果一致[8],表明NSCLC中存在同源重组修复基因表达失常。NSCLC中同源重组修复基因的表达异常升高可引起断裂的DNA双链不恰当修复,导致染色体缺失、重排、转位及倒置,导致肿瘤的发生。另外,同源重组修复基因的表达异常升高能够增强肿瘤对放化疗等辅助治疗的抵抗性,导致不良预后[9]。
EMSY也称为C11orf30,基因定位于人类染色体11q13.5,编码蛋白能够结合乳腺癌中BRCA2并使其失活,导致DNA损伤后不能及时修复,导致肿瘤发生[10]。本研究中,NSCLC癌组织中EMSY表达升高,提示EMSY可能参与NSCLC的肿瘤发生。EMSY作为一种原癌基因,在卵巢癌中均存在EMSY基因启动子序列的单核苷酸性位点的突变现象,导致EMSY基因表达上调,降低对紫杉醇化疗的敏感性[11]。另有研究表明,Kelch样环氧氯丙烷相关蛋白-1能够泛素化修饰EMSY,促进EMSY蛋白经泛素蛋白酶体途径降解,而NSCLC中Kelch样环氧氯丙烷相关蛋白-1基因突变导致EMSY蛋白稳定性增加,导致EMSY表达水平升高[12]。本研究中,NSCLC中EMSY的表达与不良临床病理特征有关,提示EMSY促进NSCLC的肿瘤进展。分析其机制,NSCLC中EMSY的表达上调能够促进BRCAness表型的形成,肿瘤同源重组修复功能缺陷导致高肿瘤突变负荷,促进肿瘤细胞的恶性增殖和侵袭转移[12-13]。此外,EMSY作为染色质重塑复合体的重要组成成分,其过度表达能够抑制干扰素刺激基因的表达,抑制Ⅰ型干扰素反应及先天免疫信号通路的传导,促进了肿瘤细胞的免疫逃避[12, 14]。本研究发现,NSCLC中EMSY与同源重组修复基因表达有关,提示EMSY能影响NSCLC中同源重组修复基因的表达。研究表明,EMSY能参与NRC相互作用因子1染色质重塑复合体的形成,促进组蛋白H3的去甲基化,在转录水平上调BRCA1、ERCC1、RRM1等同源重组修复基因的表达[15]。而BRCA1、ERCC1、RRM1等同源重组修复基因的表达上调能够增强NSCLC肿瘤细胞对放化疗治疗的抵抗性,降低放化疗治疗的疗效,导致患者不良预后[7]。因此,NSCLC中EMSY促进肿瘤的发生发展,以EMSY为靶点的治疗可能是潜在的NSCLC新的治疗方案。
PIDD是依赖于p53的效应因子,在细胞核中以SUMO化修饰方式激活,并活化核因子κB,启动下游基因的转录,发挥促进恶性肿瘤发生发展的生物学作用[16]。本研究中,NSCLC中PIDD表达升高,与不良临床病理特征有关,提示PIDD参与NSCLC肿瘤发生发展。PIDD作为一种分子开关,其表达及功能受伴侣分子的影响。研究发现,受体相互作用蛋白1结合于PIDD基因,促进PIDD基因的表达,PIDD能够抑制天冬氨酸蛋白酶2,抑制p53的细胞周期阻滞效应,激活下游核因子κB通路,促进肿瘤恶性增殖[17]。有学者报道,在NSCLC中,PIDD能够增强Kelch样环氧氯丙胺相关蛋白1与核因子E2相关因子2相互作用,减少核因子E2相关因子2的泛素蛋白酶体途径降解,上调成纤维生长因子21的表达,导致肿瘤细胞侵袭能力增强[18]。本研究中,NSCLC中PIDD与同源重组修复基因表达有关,提示PIDD能影响NSCLC的同源重组修复过程。研究表明,PIDD能够与DNA依赖性蛋白激酶催化亚基相互作用,促进其募集到停滞的复制叉,激活ATR信号通路,上调同源重组修复基因表达,维持细胞在放化疗等应激条件下的细胞存活[19-20]。另外,PIDD可通过促进肿瘤中同源重组过程,增强DNA损伤修复能力,但不完整的DNA损伤修复导致肿瘤积累DNA损伤,促进肿瘤逃逸免疫监视,导致肿瘤增殖和转移[21-23]。本研究进一步分析发现,EMSY、PIDD mRNA联合检测对NSCLC具有较高的诊断价值,诊断的敏感度和特异度分别为0.871,0.802,具有潜在的临床应用价值。
综上所述,EMSY、PIDD在NSCLC癌组织中表达升高,与肿瘤分化程度、淋巴结转移及肿瘤TNM分期有关,均参与NSCLC的肿瘤进展。NSCLC中EMSY、PIDD表达可能通过促进同源重组修复基因表达,干扰肿瘤DNA损伤修复过程,是潜在的NSCLC肿瘤治疗靶点。临床医师可根据EMSY、PIDD的表达,评估NSCLC肿瘤恶性程度,指导临床诊治,以改善患者预后。但本研究也存在不足,样本量有限,未能深入研究EMSY、PIDD调控同源重组修复基因表达的机制,有待今后进行深入探索。
利益冲突:所有作者声明无利益冲突
作者贡献声明
陈丽萍:设计研究方案,实施研究过程,论文撰写;项保利、王布:提出研究思路,分析试验数据,论文审核;姬泽萱:实施研究过程,资料搜集整理;郭志青:进行统计学分析;赵建清:课题设计,论文修改
——紫 苏

