缺血性脑卒中致血管性痴呆患者血清HOXA1及SMAD3基因表达与认知功能和预后的关系
佟玲,赵倩,张淑艳,孙蜀宁
缺血性脑卒中是局限性脑组织缺血性坏死导致的脑部血液循环障碍,缺血性脑卒中后发生血管性痴呆(vascular dementia,VD)的概率为30%左右[1-2]。VD表现为语言、记忆、意识、执行等高级认知功能严重受损,同时也会出现抑郁、表情淡漠、少语、激越等精神症状,对日常生活造成严重影响[3-4]。VD易发生不同程度认知功能障碍,且预后欠佳,寻找与VD有关的生物标志物对其治疗及预后的提高具有一定积极意义[5]。同源异性盒基因A1(homeobox A1,HOXA1)和SMAD家族成员3(SMAD3)均与神经功能损伤有关,且二者存在正向调控的关系,然而目前尚无二者与缺血性脑卒中所致VD相关的报道[6-7]。因此,本研究通过探讨HOXA1和SMAD3基因表达与患者认知功能和预后的关系,为缺血性脑卒中所致VD的临床治疗提供帮助,报道如下。
1 资料与方法
1.1 临床资料 选择2021年1月—2023年2月辽宁省金秋医院神经内科收治的缺血性脑卒中患者241例为研究对象,根据3个月后是否发生VD分为痴呆组(n=117)和非痴呆组(n=124)。痴呆组中男61例、女56例,年龄52~78(65.09±10.52)岁。非痴呆组中男59例、女65例,年龄51~76(63.24±9.45)岁,2组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究已经获得医院伦理委员会批准(202011251904),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①均符合缺血性脑卒中的诊断标准[8],且为首次发病;②经颅脑MR及CT检查证实;③年龄>50岁;④临床资料完整;⑤均于治疗缺血性脑卒中后3个月复查,痴呆组患者于治疗VD出院3个月后再次复查。(2)排除标准:①肝肾功能严重异常;②凝血功能异常;③其他类型痴呆;④入院前有痴呆史;⑤由其他原因导致的VD;⑥脑出血史、脑部外伤史;⑦既往认知功能障碍史。
1.3 观测指标与方法
1.3.1 血清HOXA1和SMAD3基因表达检测:2组患者均于初次复查时(检查是否发生VD时)采集清晨空腹肘静脉血3 ml,离心并收集血清。血清SMAD3水平检测参照SMAD3 ELISA试剂盒(货号:BJ-E3912,上海邦景实业有限公司)说明书进行。采用实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)检测血清HOXA1水平。从血清中提取样品总RNA,逆转录为cDNA,以cDNA为模板进行扩增,Takara PrimeScriptTMRT reagent Kit with gDNA Eraser 反转录试剂盒(货号:RR047A,北京百奥创新科技有限公司)。HOXA1上游引物 5’-CGGCTTCCTGTGCTAAGTCT-3’,下游引物 5’-TTCATTGTGCCATCCATCAC-3’;GAPDH上游引物5’-AGCCACATCGCTCAGACAC-3’,下游引物 5’-GCCCAATACGACCAAATCC-3’。以GAPDH作为内参,2-△△CT法计算HOXA1相对表达水平,每个样品重复3次取平均值。
1.3.2 认知功能检测:痴呆组患者因VD入院后采用简易精神状态量表(mini-mental state examination,MMSE)评价患者认知功能,总分30分,根据得分将117例患者分为轻度亚组(>20分,n=43)、中度亚组(10~20分,n=46)、重度亚组(<10分,n=28)。
1.3.3 预后功能障碍分级:痴呆组患者出院3个月后进行复诊,采用日常生活活动能力(activity of daily li-ving,ADL)量表(总分100分)评估预后并进行分组[9],Ⅰ级亚组(>60分,n=48)、Ⅱ级亚组(41~60分,n=43)、Ⅲ级亚组(<41分,n=26)。评分越高患者预后越好。
1.3.4 临床资料收集:收集痴呆组患者性别、年龄、体质量指数、文化程度、入院时MMSE评分、痴呆家族史及合并基础性疾病情况。
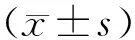
2 结 果
2.1 2组血清HOXA1和SMAD3基因表达比较 非痴呆组血清HOXA1为(1.04±0.18)μg/L,SMAD3为(34.58±6.83)μg/L,痴呆组血清HOXA1为(2.21±0.39)μg/L,SMAD3为(52.13±9.22)μg/L,痴呆组2项指标均高于非痴呆组,差异具有统计学意义(t=30.176、16.855,P<0.001)。
2.2 痴呆组不同认知功能障碍患者血清HOXA1和SMAD3基因表达比较 轻度亚组、中度亚组、重度亚组血清HOXA1和SMAD3基因表达依次升高,差异均有统计学意义(P<0.01),见表1。
2.3 痴呆组不同预后功能障碍分级患者血清HOXA1和SMAD3基因表达比较 预后功能障碍Ⅰ~Ⅱ级亚组血清HOXA为(2.05±0.37)μg/L,SMAD3为(47.83±8.71)μg/L,Ⅲ级亚组患者血清HOXA1为(2.77±0.46)μg/L,SMAD3为(67.18±11.02)μg/L,Ⅲ级亚组均明显高于Ⅰ~Ⅱ级亚组(t=8.274、9.396,P<0.001)。
2.4 痴呆组不同预后功能障碍分级患者临床资料比较 2亚组患者的性别、年龄、体质量指数、文化程度、痴呆家族史和合并症比较差异均无统计学意义(P>0.05),Ⅲ级亚组患者入院时MMSE评分>20分占比明显低于Ⅰ~Ⅱ级亚组(χ2=6.566,P=0.010),见表2。

表2 痴呆组不同预后功能障碍分级患者临床资料比较Tab.2 Comparison of Clinical Data of Patients with Different Prognostic Dysfunction Grades
2.5 缺血性脑卒中致VD患者血清HOXA1和SMAD3基因表达与MMSE评分的相关性 Spearman相关性分析结果显示,缺血性脑卒中致VD患者血清HOXA1和SMAD3基因表达与MMSE评分均呈显著负相关(r=-0.564、-0.518,P<0.01)。
2.6 血清HOXA1和SMAD3基因表达预测缺血性脑卒中致VD患者预后功能障碍为Ⅲ级的价值 绘制血清HOXA1和SMAD3基因表达预测缺血性脑卒中致VD患者预后功能障碍为Ⅲ级的ROC曲线,并计算曲线下面积(area under the curve,AUC),结果显示,血清HOXA1、SMAD3及二者联合预测缺血性脑卒中致VD患者Ⅲ级预后功能障碍的AUC分别为0.772、0.831、0.899,二者联合的AUC大于单项指标(Z/P=2.001/0.045、2.116/0.034),见图1、表3。
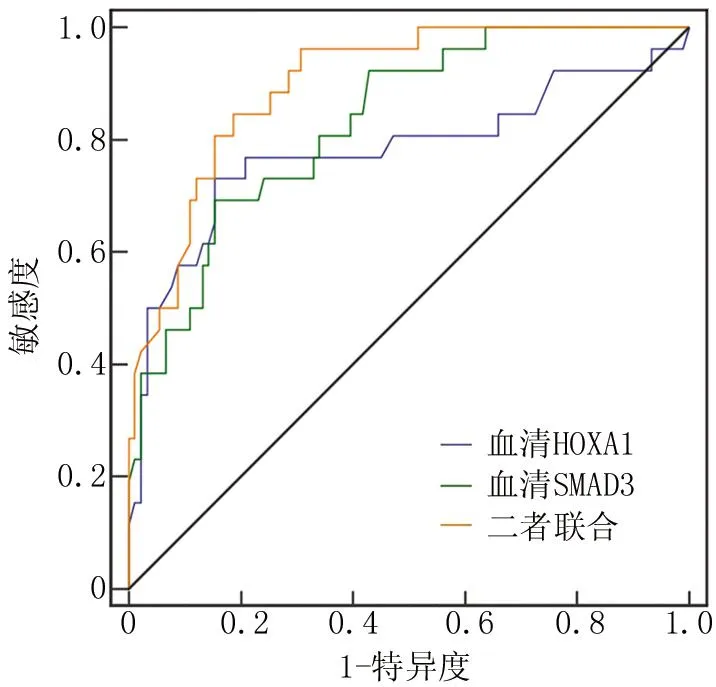
图1 血清HOXA1和SMAD3基因表达预测缺血性脑卒中致VD患者Ⅲ级预后功能障碍的ROC曲线Fig.1 ROC curve of serum HOXA1 and SMAD3 mRNA expression predicting grade III prognostic dysfunction in patients with ischemic stroke induced VD
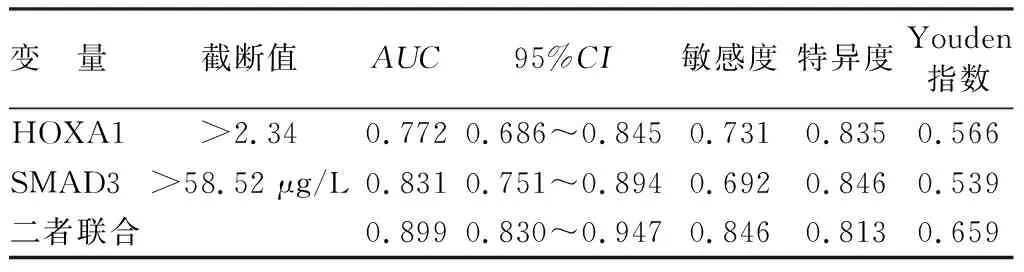
表3 血清HOXA1和SMAD3基因表达对缺血性脑卒中致VD患者预后功能障碍为Ⅲ级的预测价值分析Tab.3 Analysis of predictive value of serum HOXA1 and SMAD3 mRNA expression for grade III functional impairment in patients with ischemic stroke induced VD
3 讨 论
据统计,VD在我国65%以上人群中的发生率为1.5%,是仅次于阿尔茨海默病的痴呆类型[10]。缺血性脑卒中患者因脑组织缺氧缺血致使神经元受到一定程度损伤,导致认知功能出现异常,从而诱发VD[11]。探讨血清HOXA1和SMAD3基因表达与缺血性脑卒中致VD患者认知功能和预后的关系,或可为缺血性脑卒中致VD的防治提供帮助。
人类HOXA1基因位于7号染色体上,是一种DNA结合转录因子,是细胞分化、凋亡、增殖的关键调节基因,目前报道的关于HOXA1的研究多与癌症相关,与神经损伤、认知功能障碍相关的研究尚少[12-13]。陈玉兰等[6]研究发现,HOXA1表达抑制后,细胞氧化应激损伤得到缓解,缺氧复氧诱导的神经元损伤得到改善;然而Wei等[14]的研究表明,微小RNA-150通过上调HOXA1表达改善VD症状。本研究与陈玉兰等[6]的研究结果一致,结合前人研究结果推测HOXA1可能通过介导神经元氧化应激和凋亡影响缺血性脑卒中后VD的发生。本研究结果还表明,HOXA1可能与缺血性脑卒中致VD患者认知功能障碍严重程度和预后功能障碍分级有关。但由于目前尚无HOXA1在VD中的临床研究,因此本研究结果仍需后续验证。此外,本研究Spearman分析结果进一步表明HOXA1与患者认知功能障碍严重程度有关,ROC曲线表明血清HOXA1基因表达对缺血性脑卒中致VD患者预后功能障碍分级具有一定预测价值。
SMAD3基因定位于人15号染色体长臂区,由9个外显子和8个内含子组成,既往研究表明,SMAD3是与神经功能、认知功能相关的重要基因[15-16]。Xu等[17]进行的研究表明,抑制巨噬细胞中SMAD3表达后,阿尔茨海默病小鼠大脑中β-淀粉样蛋白的外排得到促进,从而减轻阿尔茨海默病小鼠认知功能障碍和相关病理特征。李雁翔等[18]的研究也表明,急性缺血性脑卒中患者血清SMAD3基因表达显著高于健康人群,且与患者神经功能缺损程度密切相关,可能与SMAD3刺激促炎细胞因子白介素-23的合成有关。本研究结果显示,痴呆组血清SMAD3水平较非痴呆组显著升高,推测SMAD3可能通过促进促炎细胞因子合成促进缺血性脑卒中致VD的发生[19]。本研究结果还发现,血清SMAD3基因表达随患者认知功能障碍严重程度和预后功能障碍分级的升高而升高,血清SMAD3水平与MMSE评分呈负相关,这表明SMAD3可能通过影响炎性反应强度影响患者认知功能障碍严重程度和预后功能障碍[20]。此外,ROC曲线分析结果表明,血清SMAD3水平对缺血性脑卒中致VD患者Ⅲ级预后功能障碍具有较高的预测价值。Chen等[21]研究表明,HOXA1通过与SMAD3启动子结合增强SMAD3转录,进而促进膀胱癌的增殖和转移。本研究进一步比较发现,血清HOXA1和SMAD3联合预测缺血性脑卒中致VD患者Ⅲ级预后功能障碍的价值优于二者分别单独预测,建议临床上联合预测,根据预测结果合理调整治疗方案,尽可能降低患者预后功能障碍程度。
综上所述,缺血性脑卒中所致VD患者血清HOXA1和SMAD3基因表达明显升高,二者与患者认知功能和预后密切相关,且血清HOXA1和SMAD3基因表达对缺血性脑卒中所致VD患者预后功能障碍具有较高的预测价值。然而,本研究尚未分析HOXA1与SMAD3之间的关系,二者影响缺血性脑卒中致VD患者认知功能障碍和预后功能障碍严重程度的具体机制有待后续深入研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
佟玲、孙蜀宁:设计研究方案,实施研究过程,资料搜集整理,论文撰写,论文修改;赵倩、张淑艳:分析试验数据,进行统计学分析,论文审核

