血清CX3CL1、CCL17与类风湿关节炎相关间质性肺疾病患者肺功能及预后的关系研究
朱竹菁,苏励,曲环汝,田雨,席丽君
类风湿关节炎(rheumatoid arthritis,RA)是一种系统性、慢性自身免疫疾病,近年来其在全球范围内的患病率和发病率均呈逐年上升趋势[1]。RA不仅能累及关节和周围组织,还可引起多种关节外表现,其中间质性肺疾病(ILD)是RA最具破坏性的关节外并发症,也是导致RA患者死亡的重要原因之一[2]。及时评估RA-ILD患者肺功能和预测其预后对改善患者预后非常重要。研究表明,免疫炎性反应参与RA-ILD发生发展[3]。C-X3-C基序趋化因子配体1(CX3CL1)是一种趋化因子,能通过结合C-X3-C基序趋化因子受体1(CX3CR1)促进炎性反应发生发展[4]。C-C基序趋化因子配体17(CCL17)也是一种趋化因子,能通过结合C-C基序趋化因子受体4(CCR4)促进炎性反应发生发展[5]。研究报道,CX3CL1与系统性硬化症患者ILD进展有关,CCL17与肺表面活性蛋白C基因突变引起的ILD有关,并影响患者肺功能[6-7]。本研究拟探讨血清CX3CL1、CCL17与RA-ILD患者肺功能及预后的关系,以期为改善RA-ILD患者预后提供参考依据,报道如下。
1 资料与方法
1.1 临床资料 选取2017年1月—2018年1月上海中医药大学附属龙华医院风湿科收治RA患者295例,根据是否合并ILD分为ILD组和非ILD组。ILD组115例,男23例、女92例;年龄42~75(64.10±9.23)岁; RA病程3~15年,中位数7.00(4.00,9.00)年;RA-ILD病程6~55个月,中位数22.00(13.00,28.00)个月;活动分期:急性活动期54例,亚急性活动期33例,慢性迁延期18例,稳定期10例;基础病:高血压19例,糖尿病10例。非ILD组180例,男36例、女144例;年龄39~83(62.76±9.43)岁; RA病程1~14年,中位数7.00(4.00,9.00)年;活动分期:急性活动期84例,亚急性活动期51例,慢性迁延期28例,稳定期17例;基础病:高血压27例,糖尿病13例。2组性别、年龄、RA病程、活动分期比较,差异无统计学意义(P>0.05),具有可比性。本研究已经获得医院伦理委员会批准(2016-XS-513),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①RA符合《类风湿关节炎诊断及治疗指南》诊断标准[8];②RA-ILD符合《特发性肺纤维化诊断和治疗中国专家共识》诊断标准[9],经高分辨率电子计算机断层扫描(HRCT)确诊。(2)排除标准:①合并肺结核、慢性阻塞性肺疾病、急性肺损伤等其他引起肺功能异常的肺部疾病;②合并恶性肿瘤;③未行HRCT检查和临床资料缺失;④合并急慢性感染;⑤非RA引起的ILD;⑥入院时已经发生进展性RA-ILD。
1.3 观测指标与方法
1.3.1 血清CX3CL1、CCL17水平检测:RA患者入院次日晨采集空腹肘静脉血3 ml, 离心留取上层血清,使用上海瓦兰生物科技有限公司提供的酶联免疫吸附试剂盒检测CX3CL1、CCL17水平。
1.3.2 肺功能检查:RA患者入院后均使用德国耶格肺功能仪(MasterScreen Diffusion组合式)测量第1秒用力呼气容积(FEV1)、用力肺活量(FVC)、FEV1/FVC和肺一氧化碳弥散量(DLCO)。FEV1正常值:男性为3.0~4.0 L,女性为2.0~3.0 L;FVC正常值:男性为4.0~5.0 L,女性为3.0~4.0 L;FEV1/FVC正常值:70%~80%;DLCO正常值:26.5~32.9 mmHg。
1.3.3 RA标志物检测:RA患者入院次日晨采集空腹肘静脉血5 ml,使用全自动生化分析仪(日本日立,型号 LABOSPECT 008 α;原装配套试剂盒)检测类风湿因子、抗环瓜氨酸肽(CCP)抗体、C反应蛋白、红细胞沉降率、免疫球蛋白G。
1.3.4 预后评价:通过电话或门诊对RA-ILD患者随访5年(6个月随访1次),统计预后不良发生情况,随访截止于发生终点事件[进展性RA-ILD和死亡,进展性RA-ILD[10]包括纤维进展性RA-ILD、RA-ILD急性加重(表现为呼吸衰竭,影像学可观察到新的弥漫性肺泡损害)]或2023年1月。根据预后情况将RA-ILD患者分为预后不良亚组和预后良好亚组。

2 结 果
2.1 2组血清CX3CL1、CCL17水平比较 ILD组患者血清CX3CL1、CCL17水平高于非ILD组(P<0.05),见表1。

表1 ILD组与非ILD组血清CX3CL1、CCL17水平比较Tab.1 Comparison of serum CX3CL1 and CCL17 levels between ILD group and non ILD group
2.2 2组肺功能指标比较 ILD组患者FEV1、FVC、FEV1/FVC、DLCO低于非ILD组(P<0.01),见表2。

表2 ILD组与非ILD组肺功能指标比较Tab.2 Comparison of lung function indicators between ILD group and non ILD group
2.3 2组亚组RA标志物比较 随访5年,无失访病例,115例RA-ILD患者预后不良发生率为46.96%(54/115),其中死亡14例,纤维进展性RA-ILD12例,RA-ILD急性加重28例。预后不良亚组与与预后良好亚组类风湿因子、抗CCP抗体、C反应蛋白、红细胞沉降率、免疫球蛋白G水平比较差异无统计学意义(P>0.05),见表3。

表3 预后不良亚组与预后良好亚组RA标志物比较Tab.3 Comparison of RA biomarkers between poor prognosis subgroups and good prognosis subgroups
2.4 血清CX3CL1、CCL17水平与肺功能指标的相关性 Pearson相关性分析显示,RA-ILD患者血清CX3CL1、CCL17水平与FEV1、FVC、FEV1/FVC、DLCO呈负相关(r=-0.762、-0.711、-0.577、-0.534、-0.707、-0.692、-0.735、-0.672,P均<0.001)。
2.5 不同预后RA-ILD患者临床/病理特征比较 预后不良亚组RA-ILD病程长于预后良好亚组,普通型间质性肺炎比例、HRCT评分、CX3CL1、CCL17水平高于预后良好亚组,FEV1、FEV1/FVC、DLCO和使用肿瘤坏死因子抑制剂比例低于预后良好亚组(P<0.05),2亚组患者性别、年龄、活动分期、基础病、吸烟、关节畸形、气促比例、FVC等比较差异无统计学意义(P>0.05),见表4。

表4 不同预后RA-ILD患者临床/病理特征比较Tab.4 Comparison of clinical/pathological characteristics of RA-ILD patients with different prognoses
2.6 多因素Logistic回归分析RA-ILD患者预后不良的危险因素 以RA-ILD患者预后不良为因变量(赋值:是为“1”;否为“0”),以上述结果中P<0.05项目为自变量进行多因素Logistic回归分析,结果显示:普通型间质性肺炎和HRCT评分、CX3CL1、CCL17升高为RA-ILD患者预后不良的独立危险因素,FEV1、FEV1/FVC、DLCO升高为独立保护因素(P<0.05),见表5。
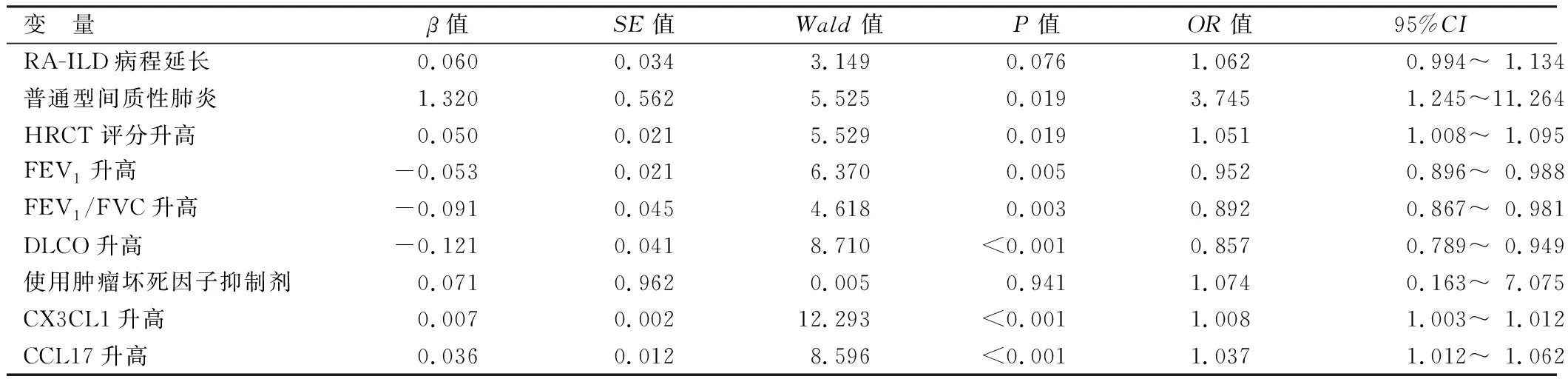
表5 多因素Logistic回归分析RA-ILD患者预后不良的危险因素Tab.5 Multivariate logistic regression analysis of risk factors for poor prognosis in RA-ILD patients
2.7 血清CX3CL1、CCL17水平预测RA-ILD患者预后不良的价值 绘制血清CX3CL1、CCL17水平预测 RA-ILD患者预后不良价值的ROC曲线,并计算曲线下面积(AUC),结果显示:血清CX3CL1、CCL17水平联合预测RA-ILD患者预后不良的AUC为0.875,大于CX3CL1、CCL17单独预测的0.783、0.788(Z=2.807、2.698,P=0.005、0.007),见表6和图1。
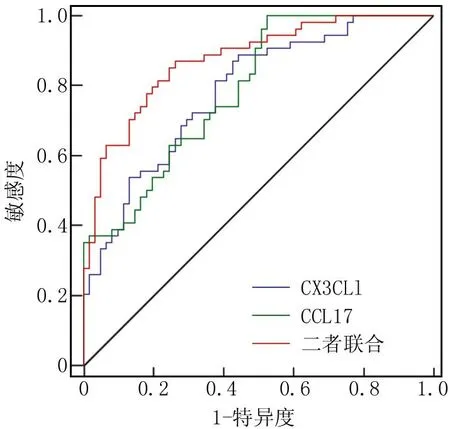
图1 血清CX3CL1、CCL17水平预测RA-ILD患者预后不良的ROC曲线Fig.1 ROC curve of serum CX3CL1 and CCL17 levels predicting poor prognosis in RA-ILD patients

表6 血清CX3CL1、CCL17水平预测RA-ILD患者预后不良的价值分析Tab.6 Value analysis of serum CX3CL1 and CCL17 levels in predicting poor prognosis in RA-ILD patients
3 讨 论
ILD是多种原因引起的非间质炎性反应和纤维化疾病,最终可引起肺间质纤维化和肺泡功能丧失[11]。RA作为一种以侵蚀性关节炎为主要表现的自身免疫病,极易侵犯到呼吸系统导致ILD,RA-ILD病情进展较慢,但仍有部分患者可在5年内进展为严重限制性肺功能障碍或病情急性加重,最终导致死亡[12]。目前临床多采用抗炎、免疫抑制剂、抗纤维化等药物治疗RA-ILD,但由于其机制尚未完全明确预后仍然较差[13]。本研究中RA-ILD患者预后不良发生率为46.96%,与国内学者报道接近[10],说明RA-ILD预后不良率较高。
炎性反应是RA-ILD发生发展的重要机制之一,RA免疫异常和某些特异性抗体能促进炎性细胞因子大量生成,造成肺间质炎性反应和纤维化,进而导致RA-ILD发生发展[14]。趋化因子是一类对免疫细胞具有趋化作用的小分子肽物质,能通过结合其特异性受体募集炎性细胞触发炎性级联反应[15]。CX3CL1是趋化因子C-X3-C亚家族唯一成员,能结合其唯一受体CX3CR1激活相关信号通路促进炎性反应进展[16]。既往研究指出[17],CX3CL1在RA小鼠滑膜成纤维细胞中高表达,提示CX3CL1可能参与RA相关病理过程。同时实验显示,抑制CX3CL1能阻断核因子-κB信号通路介导的肺动脉高压小鼠炎性反应,进而改善肺功能[18]。CX3CL1在特发性肺纤维化的成纤维细胞和细胞外基质中过量表达,下调CX3CL1能阻断CX3CL1/CX3CR1轴抑制特发性肺纤维化发展[19]。CCL17是趋化因子C-C亚家族成员,能通过结合其受体CCR4抑制免疫细胞功能或激活多种胞内细胞信号通路促进炎性反应发生发展[20]。CCL17在RA患者纤维样滑膜细胞中高表达参与炎性反应启动,而下调CCL17能改善RA炎性反应[21]。同时CCL17在辐射诱导的放射性肺纤维化模型中呈高表达[22]。因此推测,CX3CL1、CCL17可能参与RA-ILD过程。
本结果显示,RA-ILD患者血清CX3CL1、CCL17水平升高,并随着肺功能降低而升高,是预后不良的独立危险因素。分析原因可能是血清CX3CL1水平升高能激活CX3CL1/CX3CR1轴,CCL17水平升高能激活CCL17/CCR4轴,通过促进促炎细胞浸润或激活相关通路导致肺部炎性损伤加重,进而影响肺功能和降低预后。研究也指出,下调RA-ILD小鼠CX3CL1表达能抑制肺部促炎型巨噬细胞浸润,进而改善肺纤维化和功能[23];阻断CCL17表达能改善RA中树突状细胞浸润和炎性因子分泌[5]。同时CX3CL1与CCL17还能分别通过激活信号转导和转录激活因子与转化生长因子-β/母亲抗肢瘫同系物信号通路,加剧肺部纤维化,导致肺功能和预后降低[24-25]。本结果还显示,普通型间质性肺炎和HRCT评分升高也是RA-ILD患者预后不良的独立危险因素。普通型间质性肺炎是基于HRCT进行病理分型,其特征是两肺外周和基底部不一致结构扭曲、网状异常、蜂窝灶,这些特征改变是RA-ILD肺功能降低的重要因素;HRCT评分是根据RA-ILD纤维化程度建立的评分,其分值越高表示纤维化程度越高,因此预后更差[26]。
最后本研究通过绘制ROC曲线发现,血清CX3CL1、CCL17水平联合预测的AUC为0.875,显著大于CX3CL1、CCL17单独预测。这说明检测二者水平有助于RA-ILD患者预后预测,且二者联合检测能提升RA-ILD患者预后不良的预测价值。
综上所述,RA-ILD患者血清CX3CL1、CCL17水平升高与肺功能降低密切相关,是预后不良的独立危险因素,血清CX3CL1、CCL17水平联合检测对预测RA-ILD患者预后不良的价值较高。
利益冲突:所有作者声明无利益冲突
作者贡献声明
朱竹菁:提出研究思路,实施研究过程,论文撰写和修改;苏励:设计研究方案,论文审核;曲环汝、田雨:数据收集和统计学分析;席丽君:实施研究过程,资料搜集整理

