血清copeptin、adropin与阻塞性睡眠呼吸暂停低通气综合征患者睡眠结构和颈动脉粥样硬化的关系分析
陈杰,刘涛,范艳锋,裴俊芳,赵瑾,窦占军
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是指在睡眠过程中反复发生呼吸暂停以及低通气的一种睡眠呼吸障碍性疾病[1-3],该病可导致间歇性缺氧、睡眠结构紊乱、内分泌紊乱、交感神经兴奋性增强、机体氧化应激等,引起多器官功能损害而出现一系列并发症[4]。颈动脉粥样硬化(atherosclerosis,AS)是OSAHS常见的靶器官损害类型,颈AS形成可导致脑血管疾病的发生[5]。和肽素(copeptin)属于一种糖肽,由39个氨基酸组成,可调节收缩小动脉,与睡眠质量相关,能介导炎性反应和应激反应,促进血管内皮损伤,进而参与AS形成发展,研究显示copeptin在阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)患者体内升高[6]。能量平衡相关蛋白(adropin)是一种分泌性蛋白,由能量稳态相关基因编码,在调节糖脂代谢、调节睡眠结构、保护血管内皮、延缓AS形成等方面发挥重要作用,其在OSAHS中呈异常表达[7]。本研究分析了血清copeptin、adropin与OSAHS患者睡眠结构和颈AS的关系,报道如下。
1 资料与方法
1.1 临床资料 2021年5月—2023年5月山西医科大学第二医院呼吸科诊治OSAHS患者178例,其中发生AS者41例(23.03%)为AS发生组,余OSAHS患者137例为AS未发生组。2组患者性别、年龄、体质量指数、饮酒史、糖尿病占比、高血脂占比比较,差异均无统计学意义(P>0.05);与AS未发生组比较,AS发生组高血压占比、吸烟史占比、空腹血糖(fasting plasma glucose,FPG)、睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)、氧减指数(oxygen desaturation index,ODI)、血清copeptin升高(P<0.05),夜间最低指脉氧饱和度(lowest SpO2,L-SpO2)、adropin降低(P<0.05),见表1。本研究已经获得医院伦理委员会批准[(2021)XY第(047)号],患者或家属知情同意并签署知情同意书。
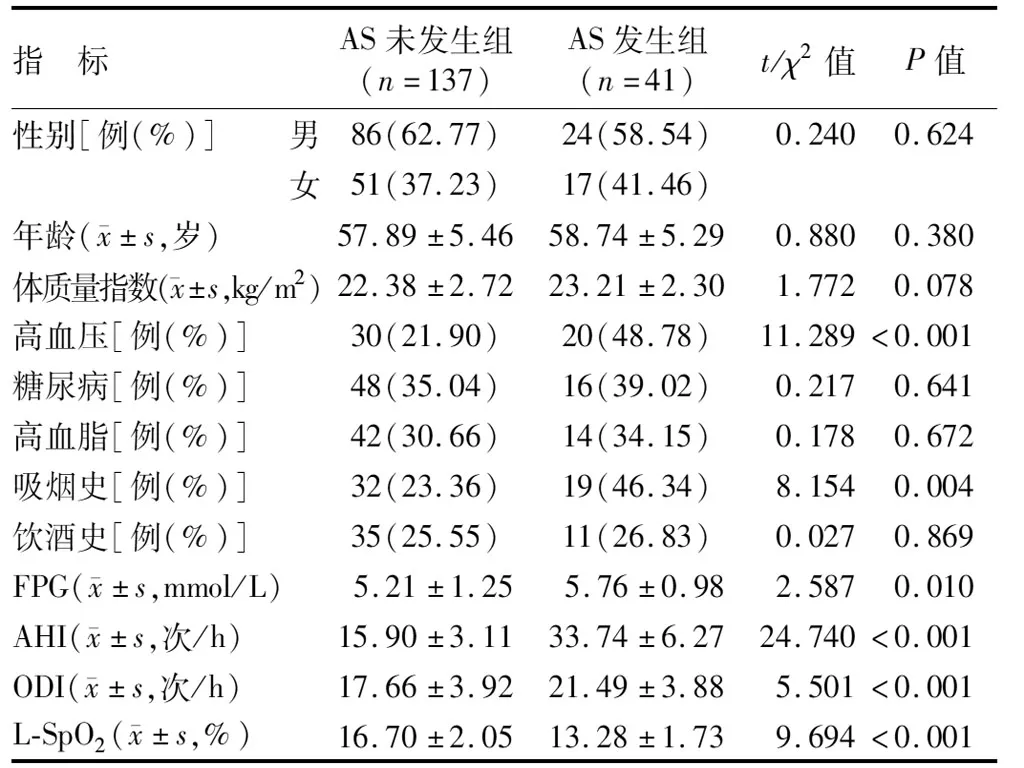
表1 AS未发生组与AS发生组OSAHS患者临床资料比较Tab.1 Comparison of clinical data between OSAHS patients in the non AS group and the AS group
1.2 病例选择标准 (1)纳入标准:①OSAHS的诊断符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)》[3]中相关标准,根据病史、体征和便携式监测(portable monitoring,PM)或多导睡眠监测(polysomnography,PSG)结果确诊;②年龄18~80岁;③病历资料完整;④心肝肾肺功能正常。(2)排除标准:①合并血液系统疾病、恶性肿瘤、免疫系统疾病、甲状腺疾病、精神异常;②近14 d内发生急性呼吸窘迫综合征、急性创伤或进行大型手术史;③基础疾病控制不佳;④妊娠期或哺乳期女性;⑤依从性较差;⑥入组前已行无创气道正压通气治疗;⑦合并其他类型睡眠障碍;⑧酗酒者。
1.3 观测指标与方法
1.3.1 血清copeptin、adropin水平检测:于入组后采集患者空腹肘静脉血5 ml,离心留取血清,采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定血清copeptin、adropin水平。copeptin试剂盒购于上海江莱生物科技有限公司;adropin试剂盒购于上海恒斐生物科技有限公司。
1.3.2 睡眠结构评估:采用Alice6多导睡眠监测系统(美国飞利浦公司),共18导联,包括脑电图、眼动图、肌电图,通过该系统自带的Profusion PSG软件,获取参数[睡眠潜伏期、觉醒次数、总睡眠时间、快速眼动睡眠(rapid eye movemenent,REM)占总睡眠时间百分比(REM%)]。晚10:00至早6:30为监测时间,监测前24 h内禁服茶、咖啡等。
1.4 OSAHS病情程度判定标准[3]轻度组:AHI 5~15次/h;中度组:AHI 16~30次/h;重度组:AHI>30次/h。
1.5 AS判定标准[8]采用HY8000型彩色多普勒超声诊断仪(神威泰康北京医疗器械有限公司)进行检查,于OSAHS患者颈动脉分叉以下1 cm处(探头频率为3~9 Hz),测量颈动脉内膜中层厚度(carotid artery intima-media thickness,CIMT即管腔外膜—中膜交界位置与内膜面之间垂直距离),测量3次后取均值。将CIMT ≥1.0 mm者纳入AS发生组,CIMT <1.0 mm者纳入AS未发生组。

2 结 果
2.1 2组血清copeptin、adropin水平比较 与AS未发生组比较,AS发生组血清copeptin升高、adropin降低(P均<0.01),见表2。

表2 2组OSAHS患者血清copeptin、adropin水平比较Tab.2 Comparison of Serum Copeptin and Adropin Levels between Two Groups of OSAHS Patients
2.2 不同病情程度OSAHS患者血清copeptin、adropin及睡眠结构情况比较 轻度组、中度组、重度组血清copeptin、睡眠潜伏期、觉醒次数依次升高,差异均有统计学意义(P<0.01),血清adropin、总睡眠时间、REM%依次降低,差异均有统计学意义(P<0.01),见表3。

表3 不同病情程度OSAHS患者血清copeptin、adropin及睡眠结构情况比较Tab.3 Comparison of Serum Copeptin, Adropin, and Sleep Structure in OSAHS Patients with Different Degree of Disease
2.3 血清copeptin、adropin与OSAHS患者睡眠结构的相关性 Pearson检验结果显示,OSAHS患者血清copeptin与睡眠潜伏期、觉醒次数均呈正相关(P<0.01),与总睡眠时间、REM%均呈负相关(P<0.01);OSAHS患者血清adropin与总睡眠时间、REM%均呈正相关(P<0.01),与睡眠潜伏期、觉醒次数均呈负相关(P<0.01),见表4。

表4 血清copeptin、adropin与OSAHS患者睡眠结构的相关性Tab.4 Correlation between serum copeptin, adropin and sleep structure in OSAHS patients
2.4 多因素Logistic回归模型分析OSAHS患者发生AS的影响因素 以OSAHS患者是否发生AS为因变量(发生AS=1,未发生AS=0),将上述结果中差异有统计学意义的指标作为自变量,纳入Logistic回归模型进行分析。结果显示,血清copeptin升高、AHI升高、合并高血压、吸烟史是OSAHS患者发生AS的危险因素(P<0.01),血清adropin升高则为保护因素(P<0.01),见表5。
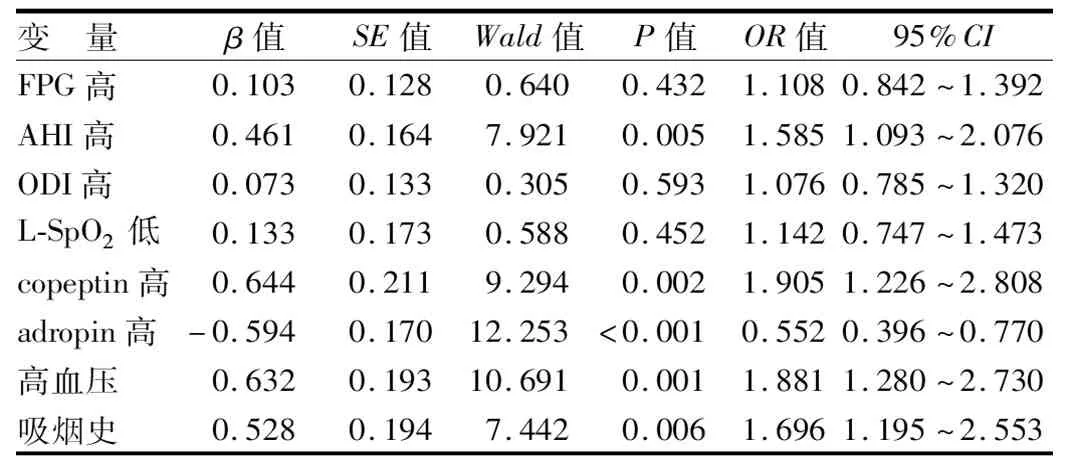
表5 OSAHS患者发生AS的多因素Logistic回归模型分析Tab.5 Multivariate logistic regression model analysis of AS occurrence in OSAHS patients
2.5 血清copeptin、adropin对OSAHS患者发生AS的预测价值 绘制血清copeptin、adropin对OSAHS患者发生AS的预测价值ROC曲线,并计算曲线下面积(AUC),结果发现,血清copeptin、adropin及二者联合预测OSAHS患者发生AS的AUC分别为0.745、0.780、0.877,二者联合的AUC大于单项指标(Z/P=4.234/0.006、3.861/0.011),见表6、图1。
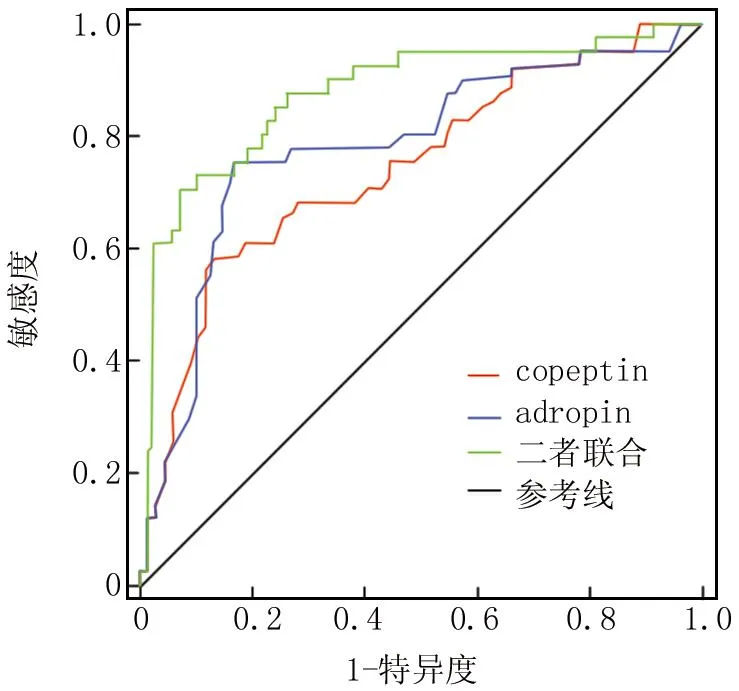
图1 血清copeptin、adropin预测OSAHS患者发生AS的ROC曲线Fig.1 ROC curve for predicting AS occurrence in OSAHS patients using serum copeptin and adropin

表6 血清copeptin、adropin对OSAHS患者发生AS的预测价值分析Tab.6 Analysis of the predictive value of serum copeptin and adiposin for the occurrence of AS in OSAHS patients
3 讨 论
OSAHS是一种全身系统性疾病,由于睡眠过程中呼吸暂停或者低通气频繁发作,引起反复的间歇性缺氧、胸腔内负压增加、高碳酸血症、觉醒及微觉醒,导致交感神经兴奋性增强、氧化应激或炎性反应增强、神经内分泌紊乱加重等,使OSAHS合并颈AS的发生率显著升高,严重影响患者生存时间和生活质量[1]。本研究中OSAHS合并颈AS的发生率为23.03%,与王林宣等[9]的报道相似,提示OSAHS合并颈AS的发生率较高。故探寻与OSAHS睡眠结构和颈AS发生相关的生物学标志物有重要的临床意义。
copeptin是精氨酸加压素(arginine vasopressin,AVP)C末端的一部分,AVP是下丘脑—垂体—肾上腺轴(hypothalamic pituitary adrenal axic,HPA)的重要激素之一,由下丘脑视上核及室旁核细胞分泌,具有缩血管、升高血压、抗利尿等功能,还可参与酸中毒、缺氧等应激反应[10]。AVP可通过与相应受体结合,发挥促进血小板聚集、血管收缩等作用,致使血栓或AS形成、糖脂代谢异常等,进而增加心脑血管疾病的发生风险[11]。AVP结构极不稳定,呈脉冲样释放,受血小板影响较大,在血清中半衰期短,使其在临床应用受限。copeptin与AVP等摩尔释放,copeptin在体内基本不降解(除肾脏排泄外),相较于AVP,其结构更稳定,临床测定更方便,可作为AVP检测的同源替代物。当机体处于寒冷、高渗透压、缺氧、低血压等应激状态时,copeptin可由下丘脑释放入血[12]。相关研究显示,copeptin在高血压、心肌梗死、脑梗死等心脑血管疾病中呈高表达,在疾病危险分层以及预后评估中具有一定应用价值[13]。国外研究指出[14],OSAS患者体内的copeptin水平较高,且其可作为识别OSAS早期心血管并发症高危患者的潜在标志物,同时高血清copeptin与1型糖尿病无症状者颈动脉内膜中层厚度增加有关。本研究显示,血清copeptin水平随着OSAHS病情程度的增加而升高,且血清copeptin与睡眠潜伏期、觉醒次数呈正相关,与总睡眠时间、REM%呈负相关,提示血清copeptin可能参与OSAHS患者睡眠结构失衡的调节过程,血清copeptin浓度上升或可促使OSAHS患者发生睡眠障碍。分析原因为夜间反复间歇性缺氧,患者交感神经系统代偿性激活,交感神经刺激AVP系统,致使AVP大量释放,故作为AVP同源替代物的copeptin也随之升高;而血清copeptin水平越高者提示其夜间间歇性缺氧程度越大,故睡眠结构紊乱越严重[15]。本研究多因素Logistic回归模型结果还显示,血清copeptin升高是OSAHS患者发生AS的危险因素,既往报道也指出copeptin与AS形成呈正相关[16]。分析copeptin可能通过影响脂质代谢及与其相应偶联受体结合,而参与AS形成,也可能通过介导炎性反应,促进血管内皮损伤而促使AS形成。
adropin由76个氨基酸组成,在代谢平衡方面其能改善血糖平衡,调节血脂异常;在后肢缺血模型中其可调节血管形成,增加毛细血管密度,对于延缓AS形成具有一定作用[17]。近年来,adropin被认为是一种血管内皮功能调节因子,它可通过调节内皮一氧化碳合成酶(endothelial carbon monoxide synthase,eNOs)表达,诱导NO生成,进而对血管内皮发挥保护作用[18]。也有研究认为[19],adropin可通过阻抑 ROCK-MLC2通路,减小缺氧低糖损伤后内皮细胞通透性,以保护血管内皮。而上述病理过程(血管内皮功能受损、糖脂代谢异常等)与AS的形成及发展关系密切[20]。有报道显示[7],OSAHS患者较低的循环adropin水平与内皮功能障碍密切相关,循环adropin水平可作为OSAHS患者出现临床症状前预测内皮功能障碍发生发展的早期生物标志物。本研究结果显示,重度OSAHS患者血清adropin水平显著低于轻中度患者,中度患者血清adropin水平显著低于轻度患者,且血清adropin与总睡眠时间、REM%呈正相关,与睡眠潜伏期、觉醒次数呈负相关。说明血清adropin水平降低与OSAHS病情及睡眠结构紊乱有关。多因素Logistic回归模型结果显示,血清adropin升高是OSAHS患者发生AS的保护因素,分析原因为OSAHS患者存在不同程度的间歇性缺氧,可导致机体血管内皮功能损害,增加AS发生风险,而血清adropin在血管内皮损伤中具有一定保护作用,故adropin水平升高者其发生AS的风险越低[21]。此外,AHI高及合并高血压、吸烟史也是OSAHS患者发生AS的危险因素,这与以往研究相符[22-24]。本研究进一步绘制ROC曲线发现,血清copeptin、adropin联合检测预测OSAHS患者发生AS的AUC为0.877,显著优于单项指标检测的0.745和0.780。由此表明血清copeptin联合adropin检测对预测OSAHS并发AS具有重要意义。
综上所述,血清copeptin、adropin水平与OSAHS患者睡眠结构紊乱和颈AS的发生关系密切,两项指标联合检测对于OSAHS患者颈AS形成有较高的预测价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
陈杰:提出研究思路,实施研究过程,论文撰写,论文修改;刘涛、范艳锋:实施研究过程,资料搜集整理;裴俊芳、赵瑾:进行数据处理和统计学分析;窦占军:设计研究方案,分析试验数据,论文审核

