结核分枝杆菌EsxV∕W 融合蛋白对耻垢分枝杆菌表型及巨噬细胞功能的影响
余海燕,李玉洁,任 芹,杨国平
(大理大学基础医学院,云南 大理 671000)
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染引起的一种持续并严重危害公众健康的慢性传染病。卡介苗是目前唯一批准且广泛用于预防结核病的疫苗,但只对儿童具有保护作用,且保护力在80%左右〔1〕,不能保护青少年和成人免受感染〔2〕。因此,迫切需要开发新的更有效的抗结核疫苗和阐明MTB 与宿主之间的相互作用机制用于结核病的预防和治疗。
研究〔3〕显示MTB 中的基因与卡介苗存在16 个差异区域(region of difference,RD)1~16,其中11 个MTB 特异性基因组区域(RD1、RD4~7、RD9~13 和RD15)在所有卡介苗菌株中缺失。MTB 的Rv3619c和Rv3620c分别编码EsxV 和EsxW 蛋白,位于MTB的RD9 区,是卡介苗中缺失基因,参与MTB 的毒力发挥,有利于杆菌在宿主细胞内的存活;此外,研究〔4-6〕发现EsxV 与EsxW 可诱导Th1 型保护性免疫,是重要的T 细胞抗原,可调节机体免疫应答反应,提示esxV和esxW是MTB中的毒力基因及与宿主相互作用中发挥免疫调节的基因。与同属于ESAT-6 家族的早期分泌靶抗原6(early secretory anti-gen-6,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)在MTB 感染中发挥的作用相似,研究〔7-9〕表明编码ESAT-6 及其伴侣CFP-10的Rv3875和Rv3874基因位于MTB 特异性基因组RD1 区,是卡介苗中的缺失基因及MTB 重要的毒力因子,对MTB 感染中毒力的发挥和免疫调节起关键作用。
与卡介苗生长缓慢、基因操作困难、在免疫功能低下人群存在感染的风险相比,耻垢分枝杆菌(Mycolicibacterium smegmatis,MS)是一种生长快,与MTB 基因高度同源,能高效表达外源性基因的非致病性分枝杆菌,被广泛用于MTB 感染免疫研究的模式替代菌株〔10〕。研究〔11〕还发现esxV与esxW在MS 基因组中缺失,不表达EsxV 和EsxW 蛋白,为此本研究构建能表达EsxV∕W 融合蛋白的重组MS,体外模拟构建重组MS 入侵巨噬细胞时面临的压力条件,探究其在多种压力环境中的耐受情况以及对巨噬细胞功能的影响,为阐明EsxV∕W 融合蛋白在MTB与宿主相互作用中的功能提供研究基础。
1 材料
1.1 菌株、载体、细胞及实验动物耻垢分枝杆菌mc2155株、穿梭质粒pMV261、表达质粒pET-28a、ANA-1巨噬细胞由大理大学基础医学院微生物学与免疫学教研室保存;6~8 周龄BALB∕c 小鼠,体质量18~20 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-004。
1.2 主要试剂质粒小提试剂盒、DNA 产物纯化试剂盒、DNA Marker、Pro-Light HRP 化学发光检测试剂(天根生化科技有限公司,批号:U9225、U8717、W9319、W9924);限制性内切酶EcoR Ⅰ及Hind Ⅲ、T4 DNA 连接酶(Thermofisher公司,批号:91282203、9126655、01035784);小鼠抗组氨酸(histidine,His)标签抗体、蛋白Marker、青∕链霉素混合液(100×)、牛血清白蛋白(组分V)、溶菌酶、咪唑、SDS、吐温-80(Solarbio 公司,批号:20200631、PR1950、20220310、128P05727、423Q049、1224P031、712L031、1114D016);可显影蛋白Marker(Servicebio 公司,批号:MPC2209003-1);粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)(peprotech 公司,批号:315-03);HRP标记的羊抗小鼠IgG(博士德生物工程有限公司,批号:BST15F19BG50);南美血源胎牛血清、细胞培养基RPMI 1640(Gibco 公司,批号:2176404、8123163);ELISA 试剂盒(欣博盛生物科技有限公司,批号:M230427-102b);NO 检测试剂盒(碧云天生物技术有限公司,批号:110922230303);Middlebrook7H9 培养基(美国BD 公司,批号:928045);胰蛋白胨、酵母提取物(Solarbio 公司,批号:I607BA0035、I606BA0002)。
2 方法
2.1 重组融合基因序列的构建及引物的设计从NCBI 的Gene数据库中获取Rv3619c和Rv3620c的碱基序列,去掉Rv3619c基因末端终止子和Rv3620c基因启动子,经疏水性Linker连接。选择合适的酶切位点并加上保护性碱基。使用Primer Premier 5软件设计esxV/W重组基因序列的扩增引物,上游引物:5'-GGAATTCATGACCATCAAC-3',含EcoRⅠ酶切位点;下游引物:5'-CCCAAGCTTTCAGCTGCTG-3',含Hind Ⅲ酶切位点。聚合酶链反应(polymerase chain reaction,PCR)扩增条件:95 ℃预变性2 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min,共35 个循环;72 ℃继续延伸10 min。1% 琼脂糖凝胶电泳鉴定。重组克隆质粒pMD18-T-esxV∕W的基因序列和引物均由北京擎科生物科技有限公司合成。
2.2 重组蛋白EsxV∕W 的诱导表达、纯化及鉴定使用限制性内切酶EcoRⅠ和Hind Ⅲ双酶切重组克隆质粒pMD18-T-esxV∕W及表达载体pET-28a 以形成黏性末端,回收双酶切产物esxV∕W重组基因和pET-28a,经T4 DNA 连接酶连接后热激转入大肠杆菌DH5α 感受态细胞,涂布于LB 固体平板(含50 mg∕mL 卡那霉素),37 ℃倒置培养过夜,挑取卡那霉素抗性筛选的单克隆菌落经PCR 鉴定后,提取菌液中重组表达质粒pET-28a-esxV∕W,热激转入表达菌株BL21(DE3)感受态细胞。将鉴定正确的对数生长期pET-28a-esxV∕W重组BL21 菌株按1∶100 比例接种于LB 培养液,37 ℃、200 r∕min,振荡培养至OD600=0.6 后加入终浓度为0.8 mmol∕L 的异丙基-β-D-硫代半乳糖苷(isopropylβ-D-thiogalactoside,IPTG),于16 ℃诱导表达20 h,冰水浴超声裂解菌体后收集上清,用吸附镍柱纯化,经10、20、30 mmol∕L咪唑溶液洗涤杂蛋白后,用100 mmol∕L 咪唑溶液洗脱目的蛋白EsxV∕W,对纯化后的蛋白进行SDSPAGE和Western blot验证。
2.3 鼠抗EsxV∕W 重组蛋白多克隆抗体的制备纯化的EsxV∕W 重组蛋白以50 μg+(GM-CSF 蛋白佐剂)∕只,经皮下注射免疫BALB∕c 小鼠,共3 只。对照组3 只注射等体积0.9%氯化钠溶液(只首次免疫注射)。每2 周免疫1 次,共3 次,第3 次免疫后1 周内眦取血,分离血清,-80 ℃保存备用。
2.4 esxV/W 融合基因重组MS 的构建及表达鉴定使用限制性内切酶EcoRⅠ和Hind Ⅲ双酶切重组克隆质粒pMD18-T-esxV∕W及穿梭载体pMV261,回收双酶切产物esxV∕W和pMV261,经T4 DNA 连接酶连接后热激转入大肠杆菌DH5α 感受态细胞,涂布于LB 固体平板(含50 μg∕mL 卡那霉素),37 ℃倒置培养过夜,挑取卡那霉素抗性筛选的单克隆菌落经PCR 鉴定后,提取阳性菌液中重组表达质粒pMV261-esxV∕W,电击转入MS 感受态细胞,涂布于2×YT 固体平板(含50 μg∕mL 卡那霉素),挑取筛选阳性的单克隆菌落经PCR 鉴定正确后将重组菌命名为MS-EsxV∕W,同时构建含空载质粒pMV261 的重组菌MS-vec。取对数期的MS-EsxV∕W 菌液45 ℃热击诱导1 h 后于冰上超声裂解菌体,收集裂解上清液及沉淀,以制备的鼠抗EsxV∕W 融合蛋白多克隆抗体为一抗,HRP-IgG 为二抗,Western blot鉴定重组融合蛋白EsxV∕W 在MS中的表达。
2.5 重组MS菌落形态、成膜能力及生长曲线的测定将OD600值一致的MS-vec 与MS-EsxV∕W 重组菌的菌液稀释后涂布于2×YT固体平板,37 ℃培养3~5 d,观察重组菌的菌落形态并拍照;取OD600值一致的MS-vec 与MS-EsxV∕W 重组菌的菌液,接种于含7H9-OADC、苏通、2×YT、LB 液体培养基的12 孔板中,37 ℃培养箱中静置培养3~5 d,观察生物膜的形成情况并拍照;使MS-vec 与MS-EsxV∕W 重组菌的菌液初始OD600=0.02,37 ℃、200 r∕min 振荡培养,每6 h取菌液测其OD600值并绘制生长曲线。
2.6 菌落计数法检测重组MS在不同环境条件下的耐受力取1.0 mLOD600值一致的对数期MS-vec、MS-EsxV∕W 重组菌菌液接种于20 mL 2.5 mg∕mL 溶菌酶(处理0、3 h)、1 μg∕mL 孔雀绿(处理0、6 h)、pH 3.0(处理0、3、6 h)、0.02% SDS(处理0、2、4、6 h)、5 mmol∕L H2O2(处理0、3、6 h)及10 mmol∕L NaNO2(处理0、3、6 h)的M7H9 培养基,分别在上述不同时间吸取100 μL 菌液进行10 倍梯度稀释,取适宜稀释度的100 μL稀释菌液涂板,37 ℃倒置培养3~5 d,计算重组MS 的存活率。细菌存活率=(处理组菌落数∕对照组菌落数)×100%。
2.7 重组MS 对ANA-1 细胞NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-6(interleukin-6,IL-6)释放的影响取对数生长期的MS-vec 与MS-EsxV∕W,按10︰1 的感染复数侵染ANA-1 细胞,分别于侵染后12、24、36、48 h 收集培养上清液,Griess 法检测上清液中NO 的含量,ELISA法检测上清液中TNF-α及IL-6含量。
2.8 重组MS在ANA-1细胞中的存活情况分别于MS-vec、MS-EsxV∕W 侵染ANA-1 细胞24、48、72 h,以终浓度为0.025%的SDS裂解细胞15 min,将细胞裂解液均匀涂布于2×YT 固体培养基,37 ℃倒置培养3~5 d,计算重组MS 的胞内存活率,分析重组菌在胞内的存活情况。细菌胞内存活率=(存活菌落数∕初始菌落数)×100%。
2.9 统计分析所有实验均采用3 个及以上独立样本数据的均值进行比较,使用Graphpad Prism 9.4软件进行统计分析,2 组间比较采用独立样本t检验,3 组及3 组以上采用Two-Way ANOVA 进行比较,以α=0.05 为检验水准,P<0.05 为差异有统计学意义。
3 结果
3.1 原核表达载体和MS-EsxV∕W 的构建及鉴定重组克隆质粒pMD18-T-esxV∕W经内切酶EcoRⅠ、Hind Ⅲ双酶切后,获得大小约为637 bp 的单一目的条带。见图1A。将其克隆至pET-28a载体中,菌落PCR 显示esxV∕W重组基因成功插入pET-28a 载体。见图1B。取双酶切产物esxV∕W基因与穿梭质粒pMV261连接后经PCR鉴定构建的重组穿梭表达质粒pMV261-esxV∕W成功。见图1C。电转至MS感受态细胞中,建立过表达EsxV∕W 的MS,即MSEsxV∕W,通过PCR 扩增鉴定目的基因esxV∕W的表达,结果表明含重组基因的MS-EsxV∕W 构建成功。见图1D。
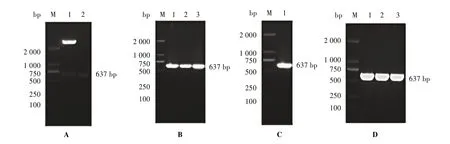
图1 esxV∕W融合基因的PCR扩增及重组菌的PCR鉴定电泳图
3.2 融合蛋白EsxV∕W 的原核诱导表达、纯化及鉴定含重组表达质粒pET-28a-esxV∕W的BL21经0.8 mmol∕L IPTG、16 ℃、诱导20 h 后,收集裂解细菌上清液及沉淀,上清液中的EsxV∕W 融合蛋白经吸附镍柱纯化,100 mmol∕L 咪唑溶液洗脱获得大小约为28 kDa 的单一目的条带,大小与预期相符。见图2A。经Western blot 检测,在大小为28 kDa 位置显现出清晰条带。见图2B。表明所得蛋白为EsxV∕W融合蛋白。重组菌MS-EsxV∕W 经热击诱导后进行Western blot 检测,结果显示重组融合蛋白在22~28 kDa 位置间出现单一条带。见图2C。表明重组融合蛋白EsxV∕W 在MS中表达成功。

图2 融合蛋白EsxV∕W的诱导表达、纯化电泳及Western blot鉴定图
3.3 重组MS 的菌落形态、生物膜的形成及生长曲线检测结果单菌落观察显示,MS-vec 与MSEsxV∕W 在平板上菌落均呈干燥的淡黄色菜花样,菌落直径MS-vec 为(0.95±0.05)cm,MS-EsxV∕W 为(1.00±0.05)cm,大小相近,差异无统计学意义(P>0.05);生物膜检测结果显示,MS-vec、MSEsxV∕W 在M7H9、苏通、LB 及2×YT 液体培养基中生物膜形成情况基本一致;通过检测重组菌在不同时间点的生长情况可以看出,MS-vec 与MSEsxV∕W 在生长的各个时间点生长速率无明显变化(P>0.05)。见图3。以上结果表明EsxV∕W 融合蛋白异源表达于MS,对其菌落形态、生物膜形成及生长速率无显著影响。
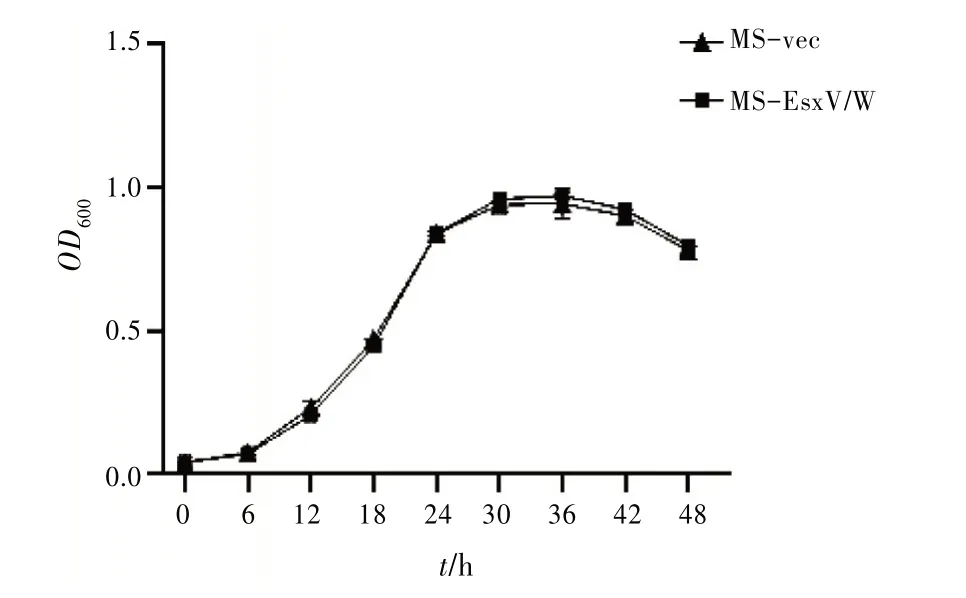
图3 MS-vec与MS-EsxV∕W生长曲线
3.4 重组MS在不同环境条件下存活能力分析结果显示,与MS-vec 相比,MS-EsxV∕W 在溶菌酶、孔雀绿及低pH 等环境条件下存活率无明显变化,差异无统计学意义(P>0.05)。见图4A~C。在SDS 环境条件下存活率显著降低,差异有统计学意义(P<0.01)。见图4D。在H2O2及NaNO2环境条件下存活率显著增高,差异有统计学意义(P<0.01)。见图4 E~F。表明EsxV∕W 融合蛋白异源表达于MS后不改变MS 对溶菌酶、孔雀绿及低pH 应激环境的耐受力,但降低对SDS 的耐受力,增强对H2O2及NaNO2环境的耐受力。
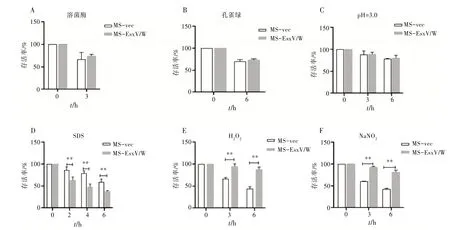
图4 MS-vec、MS-EsxV∕W在不同环境条件下存活能力比较
3.5 重组MS 对ANA-1 细胞NO、TNF-α 及IL-6 释放的影响检测结果表明侵染后与MS-vec 相比,MS-EsxV∕W ANA-1 细胞NO 释放量在48 h 显著升高,差异有统计学意义(P<0.01)。见图5A。TNF-α释放量在12、24、36 h 均显著升高,差异有统计学意义(P<0.01)。见图5B。IL-6 释放量在36 h 显著升高,差异有统计学意义(P<0.01)。见图5C。表明过表达EsxV∕W 融合蛋白的重组MS 可促进ANA-1 细胞TNF-α和晚期NO、IL-6的释放。
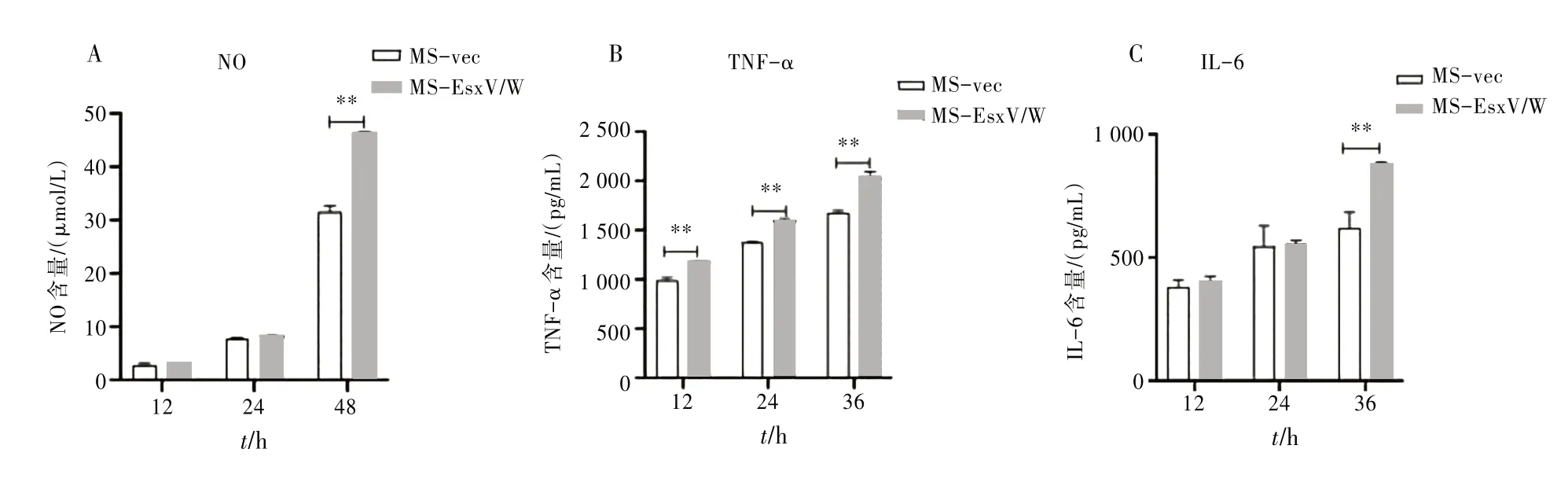
图5 MS-vec、MS-EsxV∕W对ANA-1分泌NO及细胞因子的影响
3.6 重组MS 在巨噬细胞内的存活菌落计数法检测重组MS 在ANA-1 内的存活情况,结果显示与MS-vec 相比,MS-EsxV∕W 的胞内存活率更高,差异有统计学意义(P<0.01)。见图6。表明过表达EsxV∕W融合蛋白可促进重组MS在ANA-1内的存活。

图6 MS-vec、MS-EsxV∕W在ANA-1内的存活率
4 讨论
存在MTB 基因组而在卡介苗传代中丢失的RD区基因被认为是卡介苗毒力与免疫原性减弱的原因,并与MTB 的毒力发挥密切相关;RD 区基因编码蛋白亦是结核亚单位疫苗及作为卡介苗加强免疫策略的候选优势抗原;此外,RD 区基因还作为MTB感染的血清学检查标志物〔12〕。因此对RD 区基因的功能研究既是分析MTB 致病机理,也是筛选结核亚单位疫苗候选抗原的有效途径。
MTB 作为一种胞内寄生菌,巨噬细胞是其主要的宿主细胞,MTB 感染宿主后分泌的蛋白质可被运输至宿主细胞内发挥毒力和免疫调节作用,从而影响宿主的抗MTB 免疫应答反应,最终逃避宿主细胞的免疫杀伤并在宿主体内繁殖和扩散,建立感染。对MTB 分泌的效应蛋白与宿主细胞之间相互作用过程的研究有助于理解MTB 的致病过程。研究表明MTB 的RD1 区基因esat-6(esxA)与cfp-10(esxB)参与MTB 的致病过程及MTB 感染中的免疫调节作用〔7-9〕。RD7 区基因esxO(Rv2346c)编码蛋白可增强卡介苗在感染巨噬细胞内的存活〔13〕;esxV∕W作为RD9 区基因,既往研究表明单独的EsxV 或EsxW 是重要的T 细胞抗原〔5,14〕,但其与宿主细胞的相互作用过程不清楚,为此本研究构建MTBesxV∕W融合基因在MS 中的异源表达菌株MS-EsxV∕W,分析其在与宿主细胞相互作用中发挥的功能。通过测定重组菌株的菌落形态、生物膜和生长曲线,发现EsxV∕W 不影响MS 的菌落形态、生物膜形成及生长速率。MTB 在入侵巨噬细胞过程中,巨噬细胞会对其施加各种不利于菌体生存繁殖的环境压力,例如溶菌酶、酸性、表面活性压力、氧化压力、活性氮中间体等,来抵御MTB 的感染。本研究体外模拟MTB 在侵染巨噬细胞过程中遇到的溶菌酶、孔雀绿、低pH、SDS(表面活性压力)、H2O2(氧化压力)、NaNO2等环境压力条件,发现EsxV∕W 融合蛋白异源表达于MS 后没有明显改变MS 在溶菌酶、孔雀绿及酸性环境下的生存能力,但在SDS 表面活性压力下的抵抗力降低,对H2O2及NaNO2环境的抵抗力增强。同时检测重组MS 感染巨噬细胞后其胞内存活情况,发现EsxV∕W 融合蛋白异源表达于MS 后可促进MS 在巨噬细胞内的存活,这可能与表达EsxV∕W融合蛋白增强了MS 对巨噬细胞内氧化压力以及NaNO2恶劣环境的抵抗力有关,表明esxV∕W融合基因在MTB感染中的毒力方面发挥一定作用。
研究还发现表达EsxV∕W 融合蛋白的重组MS侵染巨噬细胞可促进巨噬细胞NO 的分泌,及诱导巨噬细胞促炎细胞因子TNF-α 与IL-6 分泌,具有诱导Th1 型细胞分化的作用,表明EsxV∕W 参与MTB感染中诱导宿主免疫调节作用。
综上所述,EsxV∕W 融合蛋白是MTB 中的毒力蛋白及发挥免疫调节作用的蛋白,可改变MS 的表型并调控ANA-1巨噬细胞的免疫应答反应,本研究有助于完善对MTB 的esxV∕W融合基因功能的认识,为进一步探索MTB 的致病机理,寻求MTB 中的免疫优势抗原和抗结核疫苗靶抗原奠定基础,推动新的安全有效的抗结核疫苗的研发。

