感染后肠易激综合征肠道菌群及血清代谢物对内脏敏感性影响
闫 波,潘 颖,田平平
(安徽医学高等专科学校医学技术学院,合肥 230601)
肠易激综合征(irritable bowel syndrome,IBS)是一种持续或间歇发作,以腹痛、腹胀、排便习惯和(或)大便性状改变为临床表现,而缺乏胃肠道结构和生物化学异常改变的肠道功能紊乱性疾病。其中感染后肠易激综合征(post-infection irritable bowel syndrome,PI-IBS)占IBS的10%〔1〕。目前IBS病因尚不明确,研究〔2〕发现IBS 与内脏高敏感性、胃肠道动力异常、肠道低度炎症刺激、肠道菌群失调等有关。其中内脏高敏感性是IBS 的主要病理生理机制之一,也是IBS患者胃肠功能紊乱、腹痛及症状多样化的最主要病理生理基础,是IBS的生物学标志〔3-4〕。
肠道菌群在维持肠道内环境、肠道疾病的发生和自稳过程中起关键作用,肠道微生态的改变是引发和加重IBS 内脏高敏感反应状态、影响胃肠道动力的关键病理生理环节。肠道微生物代谢产生维生素、脂肪酸、胆汁酸等产物,短链脂肪酸多为厌氧菌发酵产物,如乙酸、丙酸、丁酸等对胃肠道功能产生影响〔5〕。本研究采用血清代谢组学分析和16S rDNA 测序分别检测血清代谢物和肠道微生物变化,探索PI-IBS 小鼠中肠道菌群和代谢的相关性,进一步明确肠道菌群及其代谢物在PI-IBS 发生发展中的作用。
1 材料与方法
1.1 材料SPF 级雄性NIH 小鼠,体质量20~25 g,购自斯贝福生物技术有限公司,动物合格证号:SCXK(京)2019-0010。小鼠饲养于安徽医科大学实验动物中心,分笼饲养、自由饮食,12 h 光照、黑暗交替节律。所有小鼠实验前在同一环境中适应性喂养7 d〔2〕。
1.2 方法
1.2.1 PI-IBS 模型制备与分组 采用含400~500条旋毛虫幼虫的0.2 mL 0.9%氯化钠溶液灌胃NIH小鼠,构建PI-IBS 模型〔6〕。将所有小鼠随机分为对照组和PI-IBS 组,每组9 只。PI-IBS 组给予旋毛虫灌胃,对照组给予等体积的0.9%氯化钠溶液,直至感染8 周后评估内脏敏感性,判断造模是否成功。
1.2.2 腹壁撤退反射(abdominal withdrawal reflex,AWR) 利用AWR 评分进行各组小鼠内脏敏感性测定。将小鼠放在透明盒上,使之能自由活动,但不能转身、掉头。给予不同体积水进行结直肠扩张(0.25、0.35、0.50、0.65 mL)〔7〕,观察小鼠对不同程度扩张压力的行为反应。操作者和观察者采取双盲的方法根据小鼠对刺激的反应进行AWR 评分〔2,8〕,取3次评定的平均值作为结果。
1.2.3 样本采集 小鼠粪便样本置于无菌管中用于16S rDNA 测序。小鼠眼球取血置于EP 管中,静置2 h后,3 000 r∕min 离心15 min,取上清液-80 ℃保存备用。
1.2.4 16S rDNA 测序与分析 采用CTAB 法提取样本的基因组DNA,检测DNA 的纯度和浓度。根据测序区域的选择,使用带Barcode 的特异引物和高保真DNA 聚合酶对选定的V3~V4 可变区进行聚合酶链反应(polymerase chain reaction,PCR)扩增。PCR 产物用2%琼脂糖凝胶电泳检测,并对目标片段进行切胶回收。参照电泳初步定量结果,对PCR 扩增回收产物定量检测,按照每个样本的测序量要求,进行相应比例的混合。使用NEB Next®Ultra™DNA Library Prep Kit 建库试剂盒构建文库。构建好的文库通过Agilent Bioanalyzer 2100 生物分析仪和Qubit 荧光分光光度计质检,文库质检合格后上机测序。
所有样品的有效数据用Uparse 软件完成聚类分析,其中有97%相似度的序列聚类成为运算分类单元(operational taxonomic unit,OTU),然后注释OTU 代表序列的物种。用greengene 数据库注释。利用Mothur 软件计算α 多样性(Chao1 指数、ACE指数、香农指数、辛普森指数),β多样性分析计算Weighted Unifrac距离。
用t检验和STAMP 分析方法检验2 组样本的物种组成和群落之间是否存在统计学差异。线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析显示关键细菌的改变,并设置线性判别分析(linear discriminant analysis,LDA)评分的筛选值为2。
1.2.5 血清代谢组学分析 取血清100 μL,加入400 μL 预冷甲醇∕乙腈(1:1),涡旋混合,-20 ℃静置30 min,4 ℃16 000 r∕min 离心20 min,取上清液,真空干燥,复溶,涡旋,离心,取上清液进样质谱分析。采用Agilent 1290 Infinity LC 超高效液相色谱系统HILIC 色谱柱进行分离。流动相A:水+25 mmol∕L乙酸铵+25 mmol∕L 氨水,B:乙腈;梯度洗脱程序如下:0~1 min,85%B;1~12 min,85%~65%B;12~12.1 min,65%~40%B;12.1~15 min,40%B;15~15.1 min,40%~85%B;15.1~20 min,85%B。柱温25 ℃;流速0.3 mL∕min;进样量2 μL。分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。样品经UHPLC 分离后用Triple TOF 6600 质谱仪进行质谱分析。ESI 源条件如下:离子源气体1 为60,离子源气体2 为60,幕帘气体为30,源温度为600 ℃,离子喷雾电压浮动±5 500 V(正负2 种模式);二级质谱采用信息依赖性采集获得,并且采用峰强度值筛选模式,参数设置如下:去簇电压为±60 V,碰撞能量固定在(35±15)eV,动态排除同位素离子范围为4 Da,每次扫描获取碎片图10个。
用MzXML 文档处理原始数据,然后进行峰对齐、保留时间校正以及用XCMS 提取峰面积。根据峰值强度将原始数据归一化,处理后的数据采用R 软件包进行分析。使用置换测试评估模型稳健性。在正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)模型中,计算变量重要性投影(variable importance in the projection,VIP)值以证明其对分类的影响。使用SPSS 24.0 软件通过t检验或非参数检验比较2 组间的差异,差异代谢物筛选以VIP>1 和P<0.05 为标准。用KEGG数据库进一步分析代谢物的通路。
1.3 统计分析采用SPSS 24.0 软件对数据进行统计分析。计量资料以(±s)表示,2 组间的比较采用t检验,P<0.05 为差异有统计学意义。通过Spearman分析差异代谢物和差异菌群的相关性。
2 结果
2.1 2 组小鼠AWR 评分采用AWR 评分评估PIIBS 内脏敏感性变化,与对照组比较,PI-IBS 组小鼠在水体积为0.25、0.35、0.50、0.65 mL时,其结直肠扩张反应明显增强,AWR 评分均明显升高,差异有统计学意义(P<0.05)。见表1。
表1 2组小鼠AWR评分(±s,n=9)
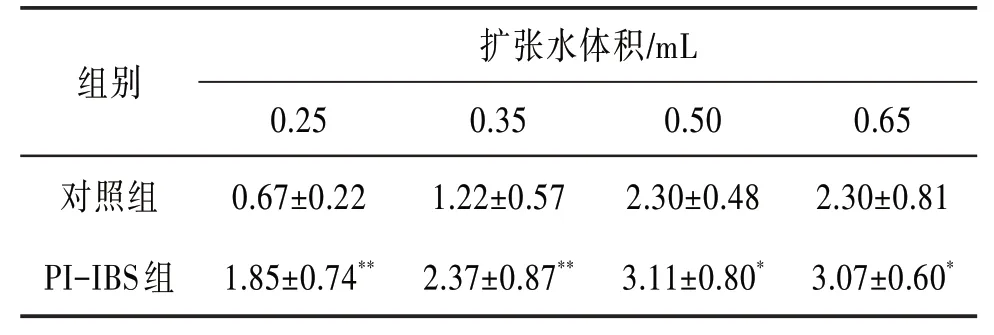
表1 2组小鼠AWR评分(±s,n=9)
注:与对照组比较*P<0.05,**P<0.01。
组别对照组PI-IBS 组扩张水体积∕mL 0.25 0.67±0.22 1.85±0.74**0.35 1.22±0.57 2.37±0.87**0.50 2.30±0.48 3.11±0.80*0.65 2.30±0.81 3.07±0.60*
2.2 2组小鼠肠道菌群物种的改变小鼠肠道菌群变化结果显示,Chao1指数、ACE 指数、香农指数、辛普森指数在对照组和PI-IBS 组小鼠间差异无统计学意义(P>0.05)。见图1。基于Weighted Unifrac距离的β多样性组间差异分析的结果显示,2 组间差异有统计学意义(P<0.05)。见图2。
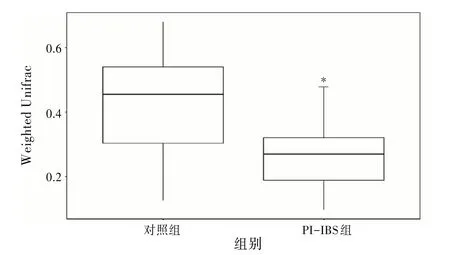
图2 2组小鼠肠道菌群的β多样性比较
16S rDNA分析小鼠粪便菌群变化,共鉴定出10个门,以拟杆菌门Bacteroidetes 和厚壁菌门Phylum Firmicutes 为主。见表2。在属水平上,与对照组相比,PI-IBS组小鼠粪便中小鼠肠道宏基因组、粪杆菌属Faecalibacterium、鞘杆菌属Ileibacterium相对丰度明显增加,表皮杆菌属Cutibacterium相对丰度降低,差异有统计学意义(P<0.05)。见图3。采用LEfSe分析比较2组肠道菌群丰度在各物种分类水平上的差异,基于LEfSe 线性判别分析结果显示,对照组的特征细菌是毛螺菌属的g_Lachnospiraceae_UCG_006,PI-IBS 组的特征细菌是小鼠肠道宏基因组mouse gut metagenome和另枝菌属的g_Alistipes。
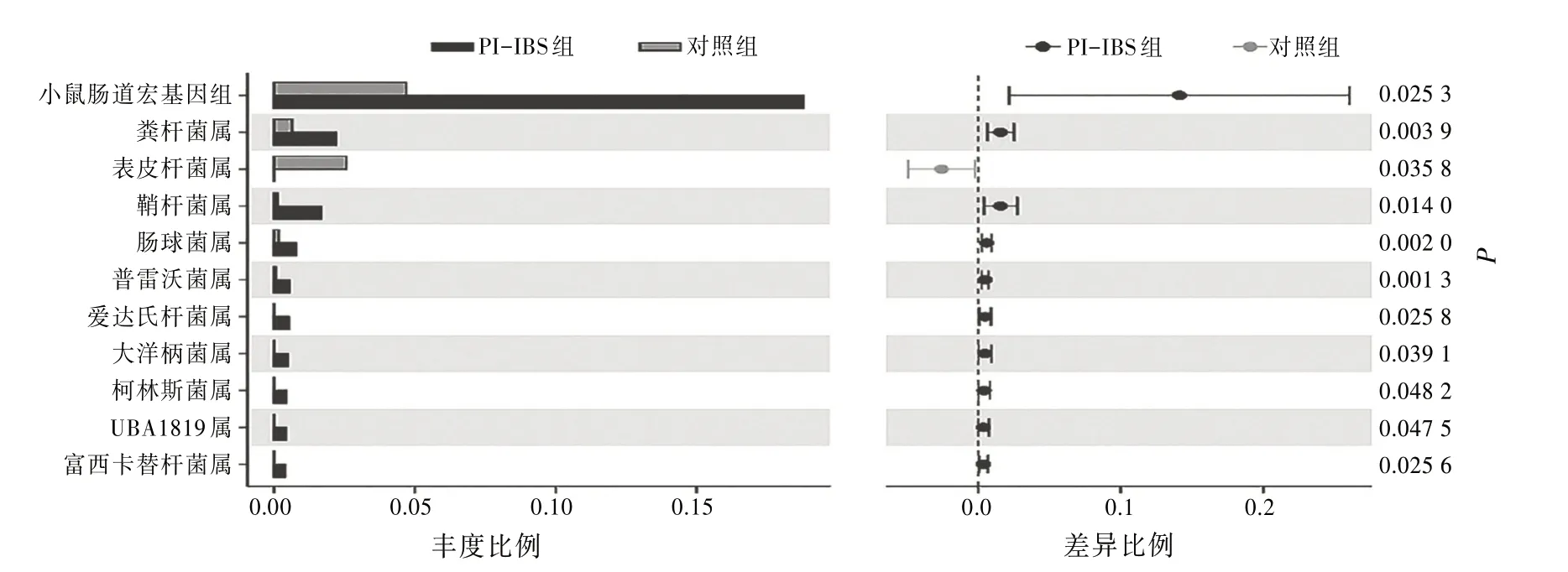
图3 2组菌群在属水平上的差异比较
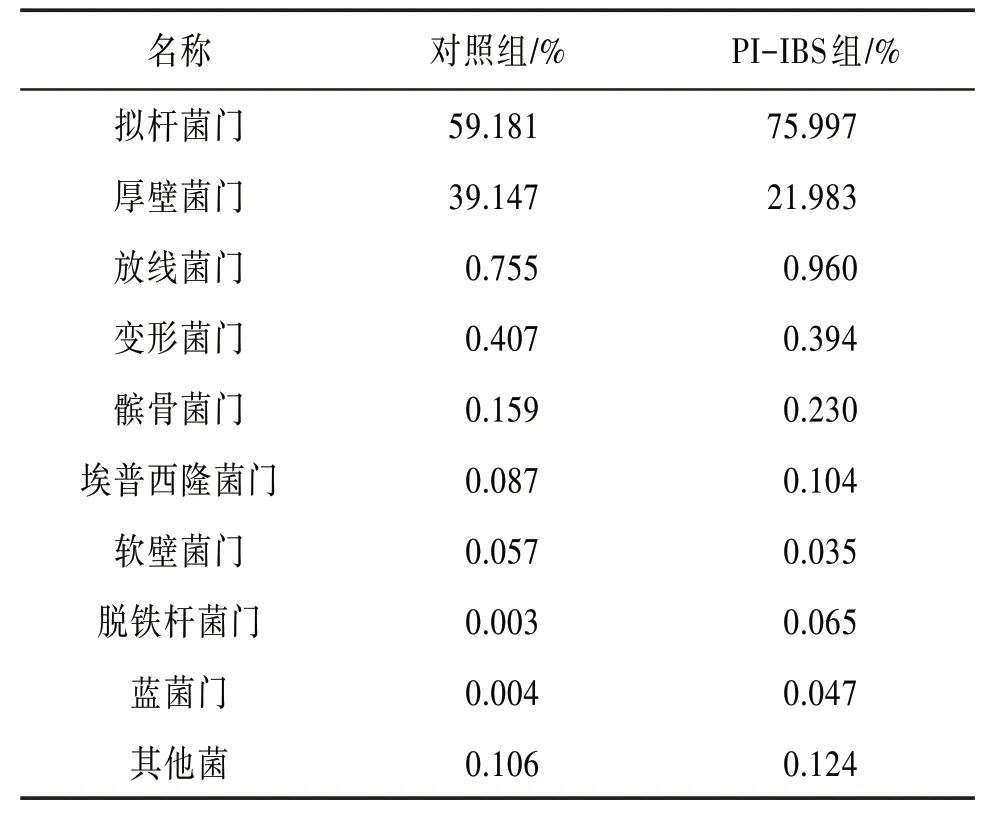
表2 2组菌群在门水平上主要物种相对丰度
2.3 2 组小鼠血清代谢物的改变和代谢通路分析在正、负离子模式下,对照组和PI-IBS 组小鼠中共鉴定出1 296 种代谢物。这些代谢物由多种成分组成,主要包括脂质和类脂质分子、有机酸及其衍生物、有机杂环化合物、含氧有机化合物等。见表3。在OPLS-DA 模式下,对照组与PI-IBS 组的样本分布不同,表明2 组代谢具有显著差异。见图4。以VIP>1,P<0.05为标准,共筛选出22种组间差异代谢物,包括L-瓜氨酸、DL-苯丙氨酸、苹果酸、乙酰肉碱、乙酰胆碱等。见表4。基于KEGG 富集分析筛选的代谢通路,包括氨基酸的生物合成、半胱氨酸和蛋氨酸代谢、精氨酸生物合成、突触囊泡循环等16条代谢通路。见图5。
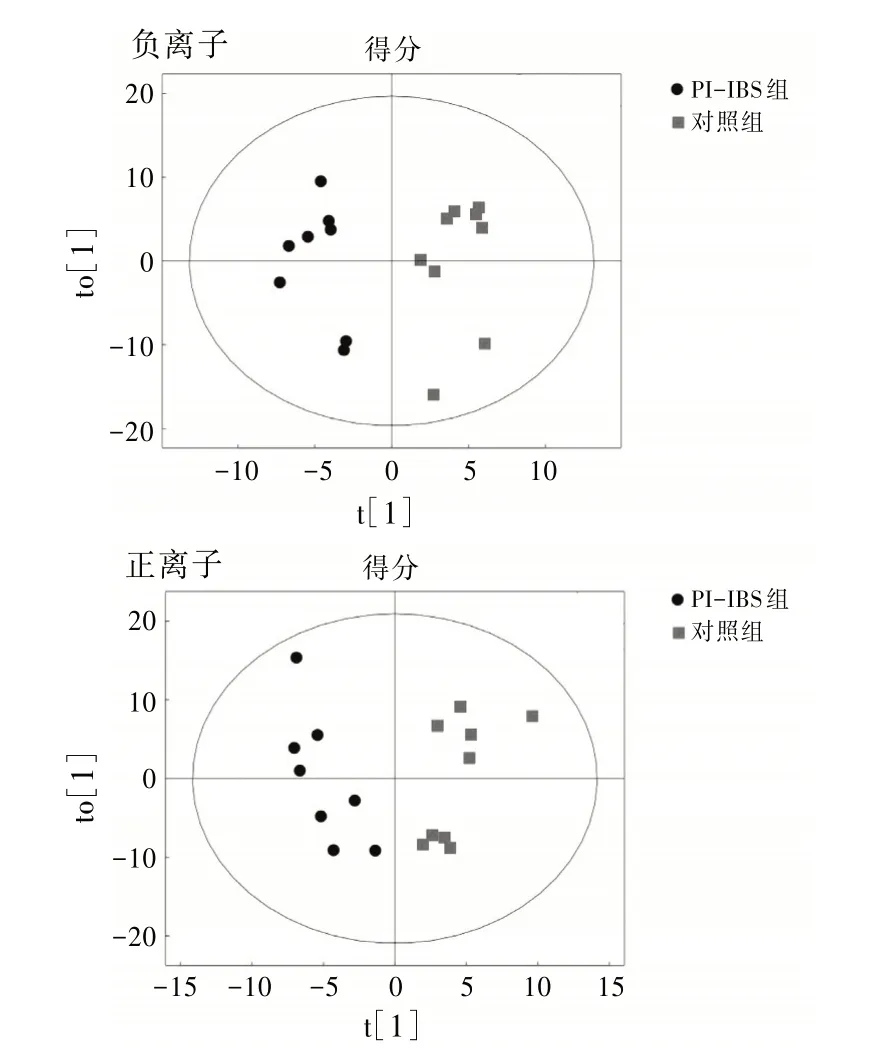
图4 正、负离子模式下2组间OPLS-DA
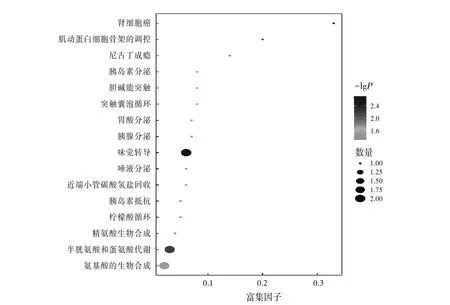
图5 差异代谢物富集通路
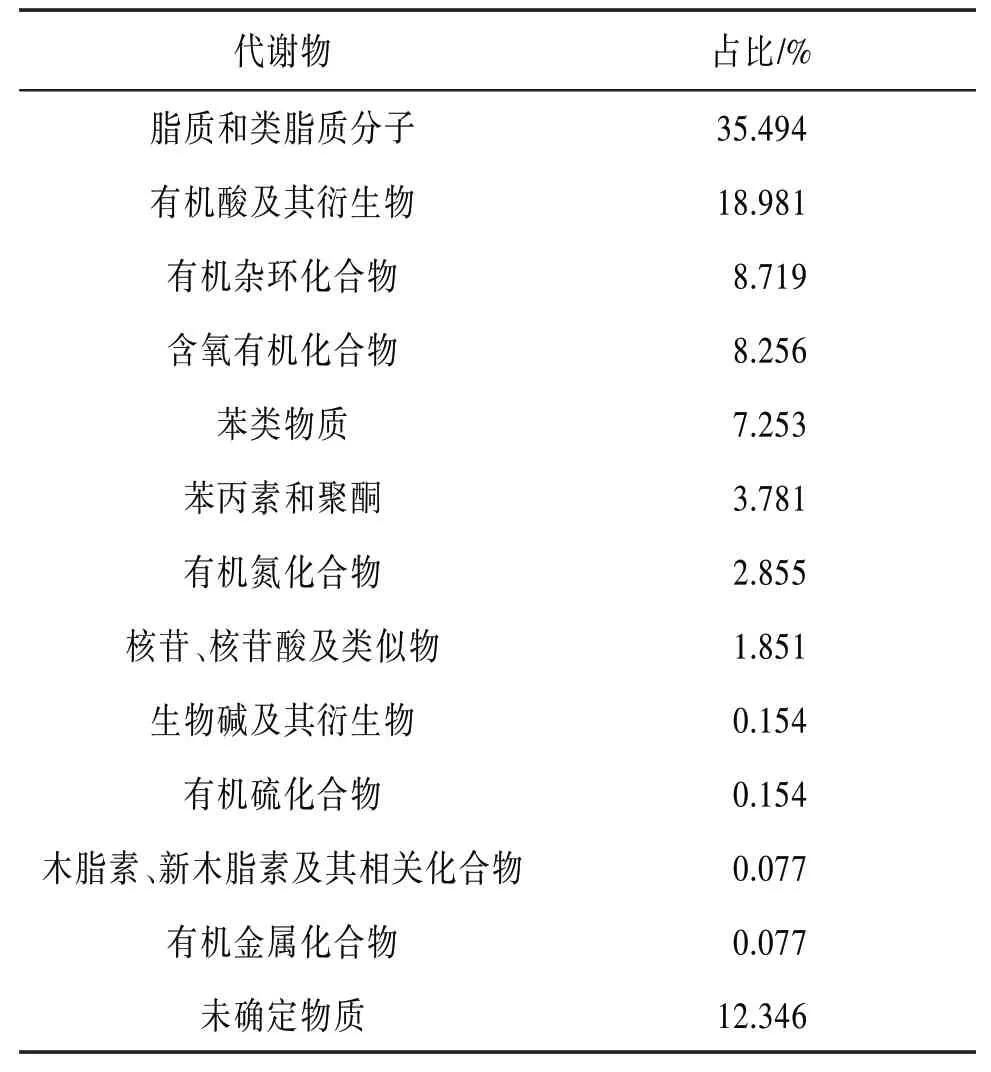
表3 代谢物中化学成分分类占比情况

表4 2组鉴定后的显著差异代谢物
2.4 2组小鼠差异肠道菌群与差异代谢物的相关性肠道菌群变化与体内代谢物产生有关,并参与各种疾病的发生。对PI-IBS组小鼠筛选出的差异菌群和差异代谢物进行相关性分析。图6 直观展示了差异菌群和差异代谢物之间存在一定的相关性。其中,mouse gut metagenome与乙酰胆碱呈显著正相关。
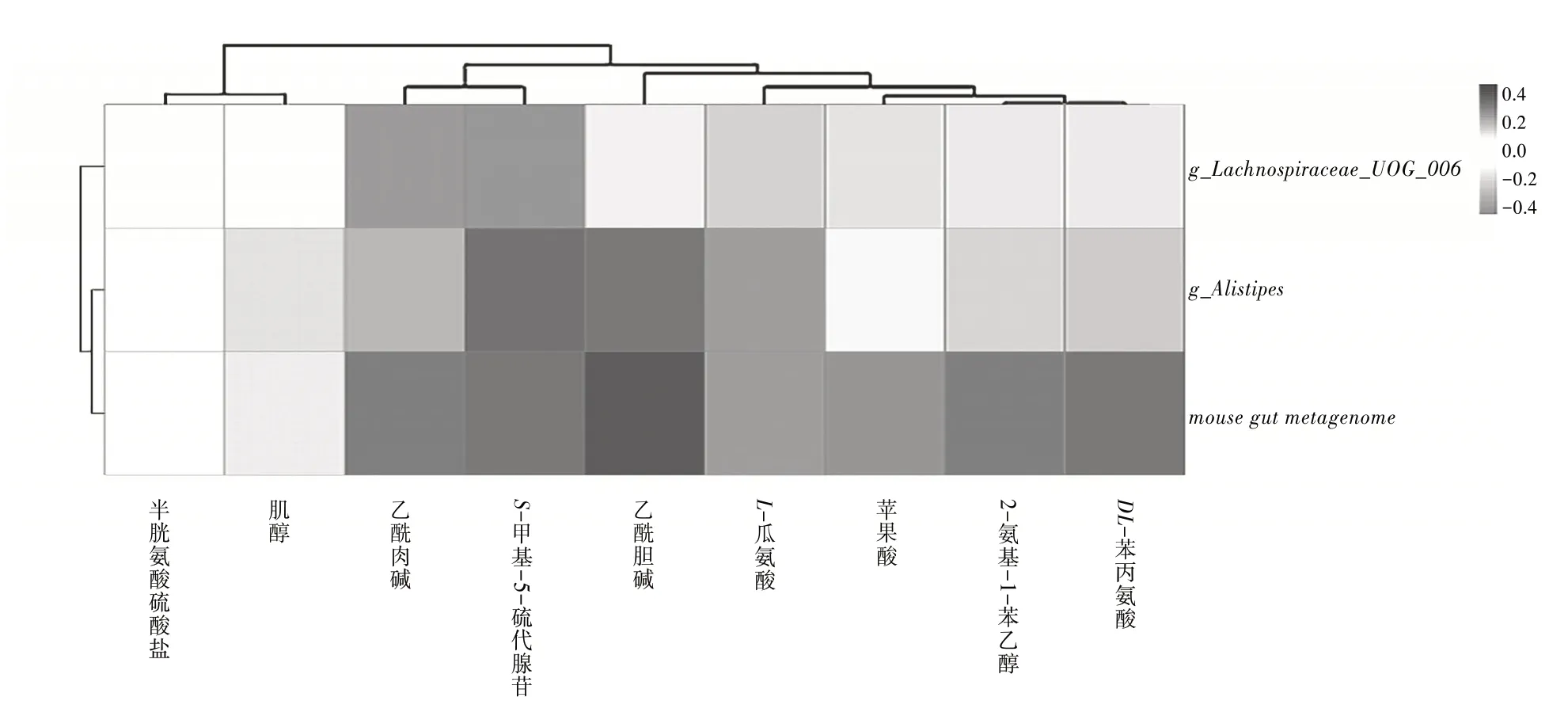
图6 差异菌群和差异代谢物相关性热图
3 讨论
内脏超敏反应和肠道微生物导致的慢性炎症是PI-IBS 患者的潜在重要致病因素。内脏高敏反应是PI-IBS 的主要特征之一,在旋毛虫感染NIH 小鼠后的PI-IBS模型中已经被证实〔9〕。
PI-IBS 的发生与肠道菌群失调密切相关,健康人群和PI-IBS 患者之间微生物群分布存在显著差异。在PI-IBS 患者中,Bacteroidesssp 显著增加,Uncultured clostridiales减少〔10〕。研究〔11〕也证实肠道菌群的改变可以明显改善PI-IBS小鼠的内脏超敏反应。本研究中,与对照组相比,PI-IBS组小鼠中小鼠肠道宏基因组、类杆菌属、鞘杆菌属相对丰度明显增加,表皮杆菌属相对丰度明显降低。通过LEfSe 线性判别分析,发现IBS小鼠肠道微生物标志物g_Alistipes,Alistipes属的不同菌株被证明具有与不同疾病和病症相关的独特生理作用〔12〕。Alistipes可产生吲哚,参与色氨酸的代谢〔13〕。由于色氨酸也是血清素的前体,因此增加的Alistipes丰度可能会破坏肠道血清素系统的平衡。本课题组前期的研究中也发现血清素5-羟色胺在PI-IBS 小鼠中发生明显改变〔14〕。在IBS 患者中,较高水平的Alistipes与腹痛的频率更高有关,推测Alistipes与肠道炎症有关〔15〕。因此,Alistipes可能通过影响色氨酸的代谢影响PI-IBS 的发生。
PI-IBS 肠道菌群相关的代谢物会通过肠道屏障入血,作用于相应靶器官,影响疾病的发生。本研究收集PI-IBS 组和对照组小鼠血清进行非靶向代谢组学分析。结果表明,2 组间有22 种代谢物存在显著差异,这些差异代谢物主要富集于氨基酸的生物合成、半胱氨酸和蛋氨酸代谢、精氨酸生物合成、突触囊泡循环等16条代谢通路。PI-IBS组小鼠L-瓜氨酸明显增加,并参与氨基酸的生物合成和精氨酸生物合成代谢通路。肠道菌群通过影响L-精氨酸代谢改善结肠炎的炎症反应〔16〕,瓜氨酸和精氨酸代谢改变与微生物态失调有关〔17〕。研究〔18〕证实瓜氨酸也是小肠吸收功能的潜在敏感生物标志物。IBS 存在代谢异常,与L-瓜氨酸参与的氨基酸和精氨酸的生物合成通路有关。
越来越多的证据表明,硫氨基酸在蛋白质结构、代谢、免疫和氧化中起着至关重要的作用〔19-20〕。小儿克罗恩病患者粪便中的氨基酸半胱氨酸和蛋氨酸均显著增加〔21〕。多种肠道微生物参与半胱氨酸和蛋氨酸的合成和代谢,如金黄色葡萄球菌、大肠埃希菌等〔22-23〕。本研究发现PI-IBS 组小鼠的半胱氨酸和蛋氨酸代谢通路上调,参与代谢通路的半胱氨酸硫酸盐明显增多,表明肠道菌群可能通过调节含硫的半胱氨酸和蛋氨酸代谢影响PI-IBS。
本研究中,PI-IBS 组小鼠血清中的乙酰胆碱较对照组明显增加,主要富集在突触囊泡循环、肌动蛋白细胞骨架的调控等多条通路。研究〔24〕表明增加乙酰胆碱的摄取可以缓解IBS 鼠的内脏敏感性。在一项旋毛虫制备的PI-IBS 小鼠实验中,马来酸曲美布汀通过抑制高乙酰胆碱改善肠道高反应性〔25〕。此外,本研究的相关性分析结果表明,乙酰胆碱与mouse gut metagenome呈显著正相关。因此,乙酰胆碱参与的代谢通路与其相关肠道微生物可能是PIIBS发病机制的关键途径。
综上所述,PI-IBS 小鼠不仅存在肠道菌群失调,血清代谢物也发生明显改变,主要涉及氨基酸代谢和乙酰胆碱参与的代谢通路。这些代谢物的改变可能与肠道菌群失调有关。研究结果从多组学角度为进一步阐释PI-IBS 的作用机制指明了潜在新方向。但深入探讨差异代谢物改变与菌群变化的关系有待进一步研究。

