二十碳五烯酸和DHA差异抑制上皮间质转化和胶原沉积并缓解肠纤维化
冯政轩, 樊子怡, 陈诗薇, 谢政广, 陈凯阳, 周敏琪, 方 剑
(绍兴文理学院医学院, 浙江 绍兴 312000)
肠纤维化是炎症性肠病(inflammatory bowel disease,IBD)的一种严重并发症,其以肠间质细胞过度增殖、肠壁细胞外基质(extracellular matrix,ECM)过度沉积和肠道黏膜肌层过度生长为特征,导致肠道狭窄、肠梗阻和瘘管形成等一系列进展[1]。随着生物制剂时代的到来,对于肠纤维化治疗手段的研究已有许多进展,但肠道狭窄的发生率并未显著降低。目前尚未找到针对肠纤维化的有效药物的治疗方法[2]。虽然手术治疗已被证明对肠纤维化患者有益但无法根治,70%~90%的患者1年内会出现内镜下复发,高达35%的患者10年内需再次行肠道切除手术[3]。为此,迫切需要有效减轻肠道纤维化的替代防治策略。
Omega-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFAs)包括二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),已在人群和动物实验中证实,其诱导并维持IBD患者慢性炎症症状缓解[4],特别是EPA及其衍生物resolvin E3(RvE3)在其他器官中还具有抗纤维化作用[5]。尽管ω-3 PUFAs在其他器官中抗纤维化作用已有报道,但在IBD中由于肠道微环境的严重紊乱,肠纤维化的发病机制非常复杂,因此需要进一步研究。虽然慢性肠道炎症是IBD患者肠纤维化的有利诱因,但仅仅控制肠道炎症无法阻止疾病进展,也不能逆转已形成的纤维化[6]。慢性炎症反复刺激肠道导致细胞外基质(extracellular matrix,ECM)过度积累和纤维化的形成。研究表明,来源于上皮间质转化(epithelial-to-mesenchymal transition,EMT)的肌成纤维细胞是产生ECM的关键细胞,也是IBD患者肠纤维化的发病因素之一。本研究以2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)构建IBD相关肠纤维化模型,比较DHA、EPA单独干预以及DHA和EPA联合干预对IBD小鼠肠纤维化的影响,并从肠黏膜屏障功能、ECM代谢平衡及自噬通路活化等方面深入挖掘DHA、EPA差异调节作用,为明确DHA、EPA在IBD相关肠道纤维化防治中的应用价值提供科学依据。
1 材料与方法
1.1 动物
8周龄雄性BALB/C小鼠(20~22 g)共40只,购自上海斯莱克实验动物有限公司,饲养于绍兴文理学院附属第一医院实验动物中心SPF级实验室。温度(25±3)℃,相对湿度(50±10)%,噪声强度≤60 dB,光/暗循环12 h,期间小鼠自由摄水取食,隔日更换垫料、饲料和饮水瓶。所有动物福利和实验程序均遵循国家实验动物管理的法律、法规、技术标准及有关规定,并经绍兴文理学院附属第一医院动物伦理委员会批准。
1.2 材料
高纯度DHA、EPA纯化油脂和鱼油订购于上海互众药业有限公司,乙酯型DHA纯化油脂DHA含量为99.20%,乙酯型EPA纯化油脂EPA含量为98.92%。鱼油中总ω-3 PUFAs含量为98.05%,其中DHA含量为47.25%,EPA含量为48.24%。TNBS(德国Sigma公司);粪便饮血试剂盒(南京建成生物工程研究所);小鼠ELISA试剂盒肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10,IL-10)、白细胞介素-17(interleukin-17,IL-17)、转化生长因子-β(transforming growth factor-β,TGF-β)和胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)购于杭州联科生物技术股份有限公司;用于Western印迹和免疫组化检测抗体购自英国Proteintech公司。
1.3 动物模型建立和治疗方案
参考《Nature Protocols》的方法建立TNBS诱导IBD相关小鼠肠纤维化模型[7],将40只8周龄雄性BALB/C分为空白对照组、TNBS诱导肠纤维化小鼠模型组、DHA干预组、鱼油干预组和EPA干预组,每组8只。适应性饲养1周,除空白对照组外,其他各组造模的小鼠禁食不禁水24 h,予腹腔注射4%的水合氯醛(200 μL/20 g)麻醉,将直径约为2 mm的医用聚乙烯管从肛门插入至距肛门边缘约3~4 cm处。给予小鼠100 μL含1.0~2.5 mg的TNBS+45%乙醇溶液灌肠,然后将小鼠提住尾部倒置1~2 min,防止药液流出,每周重复实验,共7周。每周灌肠液中TNBS量为:1.0、1.25、1.5、1.75、2.0、2.25、2.5 mg。
结合前期研究和文献报道[8,9],确定DHA、EPA和鱼油干预剂量为400 mg/kg·bw。为确保不增加小鼠的额外能量摄入,并且能够与ω-3 PUFAs形成稳定的水包油型乳化体系,本研究采用10%阿拉伯树胶溶液作为配制ω-3 PUFAs的溶剂。在建模前,空白对照组和TNBS模型组小鼠每天给予10%阿拉伯胶灌胃,共4周;DHA干预组、鱼油干预组和EPA干预组则给予400 mg/kg·bw的DHA、鱼油或EPA灌胃。在建模期间,空白对照组和TNBS模型组小鼠继续给予每天10%阿拉伯胶灌胃,共7周;DHA干预组、鱼油干预组和EPA干预组则继续给予400 mg/kg·bw的DHA、鱼油或EPA灌胃,实验分组及治疗方案见Fig.1A所示。在造模期间每日记录小鼠体重,从小鼠体重下降、粪便性状及便血情况进行疾病活动指数计算。结束实验时,留取血清和结肠组织样本,保存于-80 ℃超低温冰箱备用。
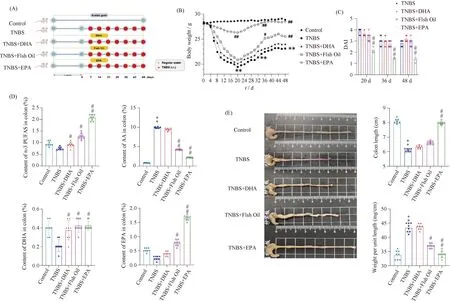
Fig.1 ω-3 PUFAs attenuate intestinal fibrosis in TNBS mice model (n=8) (A) Schematic overview of the models. Mice were given 100 μL of TNBS+45% ethanol solution containing 1.0-2.5 mg by gavage, and the experiment was repeated weekly for 7 weeks. Before modelling, mice in the control and TNBS-induced IBD model groups were given 10% gum arabic by gavage daily for 4 weeks, while mice in the DHA group, fish oil group and EPA group were given 400 mg/kg·bw of DHA, fish oil or EPA respectively by gavage. During the modelling period, mice in the control and TNBS-induced IBD model groups continued to be given 10% gum arabic by gavage daily for 7 weeks, and mice in the DHA, fish oil and EPA groups were given 400 mg/kg·bw of DHA, fish oil or EPA respectively by gavage. (B) The change of body weight of mice was shown for each group. (C) Disease activity index of mice in each group were monitored. (D) Effect of ω-3 PUFAs on the levels of long chain polyunsaturated fatty acids in the colon of mice. (E) The representative images of macroscopic appearance of colons and the measurement of colon length and weight were shown (*P<0.05, **P<0.01, compared with the control group. #P<0.05, ##P<0.01, compared with the TNBS model group)
1.4 结肠组织标本采集与处理
小鼠麻醉后采用眼眶取血法收集外周血于1.5 mL Eppendorf管中,静置30 min,4 ℃,1 500 g,离心30 min,收集的血清用于检测炎症因子和促纤维化因子。小鼠行颈椎脱臼,消毒腹部,并沿腹中线充分暴露腹腔,获得小鼠回盲部到肛门的完整结肠,测量结肠长度和重量。迅速放入预冷的生理盐水中冲洗掉血液及污物,取靠近肛门处0.5~1.0 cm的结肠组织到10%福尔马林溶液中固定,用于组织病理切片染色;剩余组织分装至无菌无酶EP管中并放入-80 ℃冰箱保存,用于检测脂肪酸含量、qRT-PCR和Western印迹分析。
1.5 气相色谱法检测小鼠结肠中脂肪酸含量
结肠组织中脂肪酸提取与检测方法参考康景轩等人[10]发表的文章,实验步骤主要包括浸提、脂肪酸甲酯化和上机检测三个过程。先将小鼠组织解冻,称取约50 mg结肠组织于离心管中,加入5 mL氯仿/甲醇溶液(2∶1,V/V),在4 ℃组织匀浆机中充分碾磨,旋涡后4 ℃过夜浸提。加1 mL 0.9% NaCl溶液,分层后保留氯仿层,加正己烷和14%三氟化硼/甲醇溶液各1 mL,在90~110 ℃金属浴中加热1 h。冷却后,加1 mL去离子水,1 000 g离心5 min,取上清,用30 ℃的氮气吹干,再加入200 μL正己烷溶解,上机检测。
1.6 小鼠结肠组织病理学分析
对充分固定的结肠组织进行梯度脱水与透明、浸蜡与包埋、切片与捞片、脱蜡复水、H&E、Masson和天狼星红染色、梯度脱水、透明和树胶封片,委托临床病理中心专业技师全盲阅片,并参考方剑等人的论文中小鼠结肠炎组织学评分标准对H&E染色进行评分[8],Theiss等人肠纤维化评分标准对Masson及天狼星红染色进行结肠纤维化程度评分[11]。
1.7 qRT-PCR分析
按照《分子克隆实验指南(第四版)》中的Trizol法提取小鼠结肠组织中的总RNA,按全式金EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒获得cDNA。以上步骤所得的cDNA按TransScript® II Multiplex Probe One-Step qRT-PCR SuperMix UDG操作说明书进行,并定量PCR检测目标基因,所有引物均从Primer Bank数据库获得(https://pga.mgh.harvard.edu/primerbank/index.html),并委托华大基因公司合成,GAPDH作为内参,引物列表见Table 1。计算2-ΔΔCt来分析目的基因的相对表达量。

Table 1 Sequences of primers designed for qRT-PCR
1.8 Western免疫印迹检测
称取约100 mg结肠组织于1.5 mL EP管中,加200 μL组织裂解液,用4 ℃组织匀浆机充分碾磨组织,经漩涡振荡,置于冰水浴30~60 min,20 000 g,4 ℃离心20 min,按照细胞核蛋白质中与细胞浆蛋白质中抽提试剂盒说明书(碧云天生物技术有限公司)提取蛋白质,用BCA法定量蛋白质浓度,于95 ℃金属浴变性5 min。按《分子克隆实验指南(第四版)》中的方法,根据目标蛋白质分子量大小配制对应的SDS-PAGE胶。利用化学发光底物处理后用凝胶成像系统检测,Image J软件进行数据分析。
1.9 免疫组织化学染色
10%甲醛充分固定结肠组织,石蜡包埋、制成5 μm切片,用二甲苯脱蜡水化,用柠檬酸钠(pH 6.0)高压修复2.5 min,置于3% H2O2室温孵育30 min,阻断内源性过氧化氢酶,经PBS洗涤30 min共3次,用5%二抗来源血清封闭60 min,按一抗说明书稀释抗体,在湿盒中4 ℃孵育过夜(12~16 h)。再与标记有生物素的二抗室温孵育30 min,经PBS洗涤30 min共3次,滴加SABC-POD工作液,室温孵育30 min,加新配制DAB显色液显色,之后行脱水、透明、封片和上机观察,应用AxioVision release 4.8软件计算阳性区域与总视野区域中的光密度比计算。
1.10 统计学方法
采用IBM SPSS 26.0软件进行统计分析,计量资料经正态性检验,符合正态分布的数据以均数±标准差表示,经方差齐性检验后,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用事后检验LSD-t检验。计量资料数据符合正态性并方差齐,则相关性分析使用Pearson检验,结果用R值表示相关性,P<0.05表示差异有统计学意义,P<0.01表示差异有显著性。使用Graphpad Prism 9.1.0绘制图片。
2 结果
2.1 二十碳五烯酸对肠纤维化小鼠的抗炎作用优于DHA
2.1.1 TNBS诱导肠纤维化小鼠模型构建的鉴定 通过每日监测各组小鼠体重变化和疾病活动指数(disease activity index,DAI),实验结束时对结肠长度与水肿程度评估,确认造模是否成功,结果正如Fig.1所示。与空白对照组相比,TNBS模型组小鼠体重逐渐下降,结合Table 1可知,造模开始前1 d(0 d)各组小鼠体重无统计学差异,在实验周期第20 d时TNBS模型组小鼠体重(19.44 ± 0.07)达到最低点(P<0.01)。相较于空白对照组,TNBS模型组小鼠在实验周期第20 d [4 (3.71, 4.04)]和第48 d DAI评分[3 (1.93, 4.76)]显著升高(P<0.01),见Fig.1和Table 2。实验周期结束时,与空白对照组相比,TNBS模型组结肠充血缩短、结肠重量/长度比值均高于空白对照组(P<0.01)。根据小鼠结肠组织的H&E染色组织病理学评分显示(Fig.2),相比于空白对照组,TNBS模型组小鼠组织病理学评分显著提高(P<0.01)。血清学检测结果同样证实,TNBS模型组中促炎症因子TNF-α、IL-6和IL-17表达水平显著高于空白对照组(P<0.01),Treg特异性细胞因子IL-10的表达水平明显低于空白对照组(P<0.01),结果正如Fig.2和Table 3所示。对小鼠结肠组织的Masson及天狼星红染色进行肠纤维化程度分析发现(Fig.3),与空白对照组相比,TNBS模型组小鼠组织肠纤维化评分显著提高(P<0.01)。可见,已成功构建TNBS肠纤维化小鼠模型。

Fig.3 ω-3 PUFAs attenuate intestinal fibrosis in TNBS mice model was evaluated by histology and fibrosis degree (n=8) (A, B) Representative images of Masson, and Sirus red stained sections of distal colon specimens were shown (×40, scale bar 500 μm; ×100, scale bar 200 μm). Fibrotic alterations were reflected by the fibrosis score. The absolute thickness of the submucosa in each group. (C) The concentrations of serum TGF-β, IGF-1, and hydroxyproline were quantified by ELISA kits at the end of the experiment. (D) Correlation analysis of EPA content in the colon with intestinal fibrosis score. (*P<0.05, **P<0.01, compared with the control group. #P<0.05, ##P<0.01, compared with the TNBS model group)
2.1.2 ω-3 PUFAs对肠纤维化小鼠结肠组织脂肪酸构成存在差异 用气相色谱(gas chromatography,GC)法分析各组小鼠结肠组织中脂肪酸的构成,结果见Fig.1D。空白对照组和TNBS模型组整个实验周期均无ω-3 PUFAs干预,故2组小鼠结肠中ω-3 PUFAs组成均处于基线水平,且无统计学差异。相较于TNBS模型组,DHA、EPA和鱼油干预组ω-3 PUFAs含量差别具有统计学差异(P<0.01),表现为EPA干预组小鼠结肠中ω-3 PUFAs含量最高,DHA干预组最低。与TNBS模型组相比,DHA、鱼油和EPA干预组结肠中的DHA和EPA富集程度均提高(P<0.05),其中EPA干预组小鼠结肠中EPA含量高于DHA和鱼油干预组(P<0.05),值得注意的是DHA、鱼油和EPA干预组小鼠结肠中DHA含量维持在同一水平。与TNBS模型组相比,EPA干预组小鼠结肠中花生四烯酸(arachidonic acid,AA)含量最低(P<0.01),其次是鱼油干预组,DHA干预组则无统计学差异。可见,DHA、鱼油和EPA干预均可提高小鼠结肠中ω-3 PUFAs水平,但EPA干预组对提高肠纤维化小鼠结肠组织中ω-3 PUFAs、DHA和EPA水平效果最好,同时还能有效降低小鼠结肠组织中AA水平。
2.1.3 从疾病活动指数分析ω-3 PUFAs缓解肠纤维化小鼠结肠组织炎症存在差异 根据各组小鼠体重变化典型时间点评定疾病活动指数(DAI),结果正如Fig.1C和Table 2所示。与体重丢失变化趋势一样,各组小鼠DAI评分在第20 d达到最高峰,其中DHA和鱼油干预组评分最高,EPA干预组最低。与TNBS模型组DAI评分[4 (3.71, 4.04)]相比,EPA干预组DAI评分[2 (2.00, 2.37)]显著降低(P<0.01),DHA干预组DAI评分[3.5 (3.46, 3.78)]和鱼油干预组DAI评分[3.5 (3.13, 3.62)]无统计学差异。第36 d后DAI评分进一步回升,但仍表现为EPA干预组DAI评分[1.5 (2.88, 2.43)]最低,DHA [3 (1.81, 5.40)]和鱼油干预组[2.75 (1.97, 4.66] DAI评分有所下降,但两组无统计学差异。实验结束时EPA干预组小鼠DAI评分与DHA、鱼油干预组有差异(P<0.01),结合图Fig.1C所示,DAI评分呈现TNBS模型组>DHA干预组>鱼油干预组>EPA干预组,EPA干预组小鼠肠炎程度最轻。结果正如图Fig.1E所示,空白对照组小鼠结肠组织颜色正常,无充血和水肿;而TNBS模型组结肠组织肠道充血、水肿,结肠长度短于空白对照组(P<0.01),而结肠重量/长度比值高于空白对照组(P<0.01);DHA干预组、鱼油干预组和TNBS模型组类似,小鼠结肠长度、结肠重量/长度比值与TNBS模型组无统计学差异;EPA干预组小鼠结肠长度、结肠重量/长度比值与空白对照组无统计学差异。提示,EPA干预能明显减轻肠纤维化小鼠结肠水肿、充血等炎症症状,其效果优于DHA和鱼油干预。
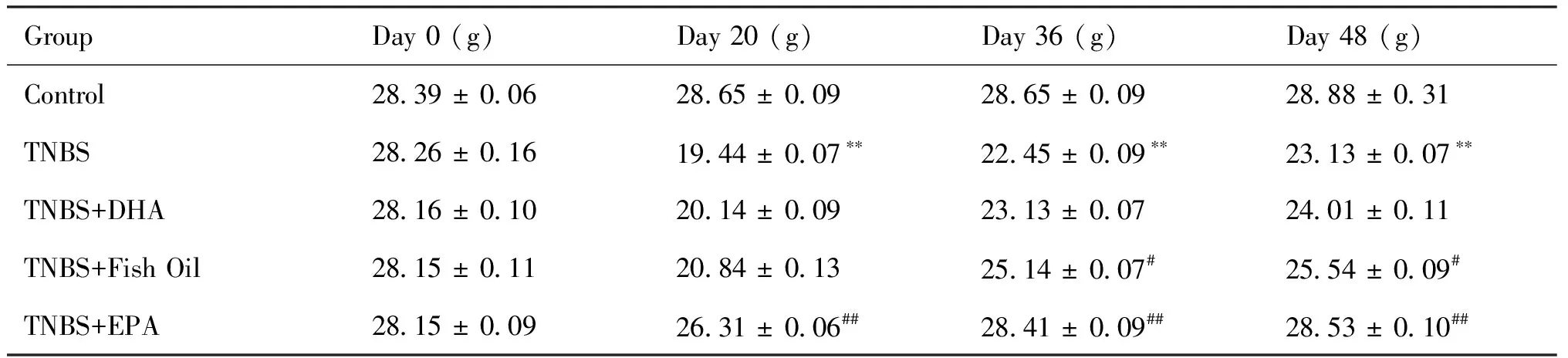
Table 2 The body weight changes of mice (n=8)
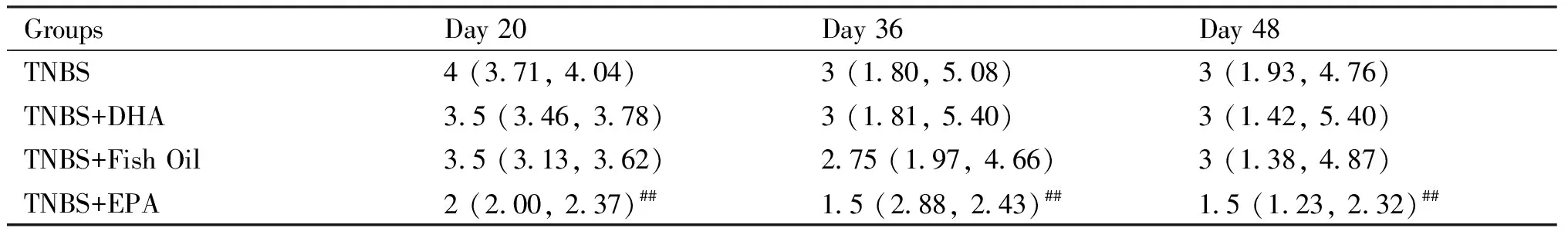
Table 3 The disease activity index changes of mice (n=8)
2.1.4 从组织病理学分析ω-3 PUFAs缓解肠纤维化小鼠结肠组织炎症存在差异 根据各组小鼠结肠组织中隐窝结构、炎细胞浸润和黏膜厚度等方面进行组织病理学评分,结果正如Fig.2和Table 3所示。与空白对照组相比,TNBS模型组小鼠结肠隐窝结构严重变形或扭曲,杯状细胞大量耗竭,炎性细胞浸润到浆膜层,上皮多处糜烂或溃疡,黏膜层厚度显著抬高。相较于TNBS模型组,鱼油干预组的组织学评分下降(P<0.05),EPA干预组评分最低(P<0.01),而DHA干预组则无统计学差异。与空白对照组相比,TNBS诱导后血清和组织中TNF-α(96.75±3.70),Th17细胞诱导分化因子IL-6(118.38±3.58)和特异性细胞因子IL-17(836.88±7.70)表达水平均显著上调(P<0.01)。相反,TNBS模型组Treg细胞特异性细胞因子IL-10(112.00±1.20)分泌显著减少(P<0.01)。相较于TNBS模型组,EPA干预显著提高了TNBS诱导的肠纤维化小鼠结肠中IL-10(386.14±3.73)表达水平(P<0.01),明显下调促炎因子IL-17(445.14±9.03)、IL-6(38.43±1.51)和TNF-α(24.14±1.83)的表达水平,其次为鱼油干预组(P<0.05),然而DHA干预组与TNBS模型组无统计学差异。通过分析各组小鼠第20 d、第48 d DAI评分、组织病理学评分和血清、组织中各炎症因子间的相关性分析,发现第20 d DAI评分与血清中IL-6呈正相关(R= 0.64,P<0.05),与IL-17呈正相关(R= 0.41,P<0.05),与IL-10呈负相关(R=-0.57,P<0.05),与组织学评分呈正相关(R= 0.42,P<0.05)。由此可见,EPA干预能恢复Th17/Treg细胞在TNBS诱导的肠纤维化中的平衡,维持肠道免疫稳态。

Table 4 Inflammatory cytokines content in serum of mice (n=8)
2.2 二十碳五烯酸对肠纤维化小鼠的抗纤维化作用优于DHA
2.2.1 从纤维化程度分析ω-3 PUFAs缓解肠纤维化小鼠纤维化存在差异 上述分析结果提示,ω-3 PUFAs对肠纤维化小鼠抗炎效果存在差异,EPA的抗炎作用优于DHA。为了进一步确认ω-3 PUFAs的抗纤维化作用,从TNBS诱导建立肠纤维化模型开始,继续给予各组小鼠不同类型的ω-3 PUFAs干预(Fig.1A)。通过Masson和天狼星染色发现(Fig.3),空白对照组小鼠结肠黏膜下存在少量胶原沉积;ELISA法检测组织中胶原主要成分羟脯氨酸,以及血清和组织中的促纤维化因子TGF-β、IGF-1表达水平均最低。与空白对照组相比,TNBS模型组大量胶原蛋白沉积在黏膜及黏膜下层,测量黏膜下层的最大及最小厚度具有统计学差异(P<0.01,P<0.05),肠纤维化评分最高(P<0.01),组织中胶原主要成分羟脯氨酸,以及血清和组织中的促纤维化因子TGF-β、IGF-1表达水平均最高。DHA和鱼油干预组与TNBS模型组无差异;EPA干预组小鼠肠纤维化减轻,羟脯氨酸水平显著降低(P<0.01),肠纤维化评分和黏膜下层的最大及最小厚度与空白对照组无差别。接着分析结肠中EPA含量与肠纤维化评分之间的相关性,发现两者存在负相关(R2= 0.7383,P<0.0004;R2= 0.4608,P<0.0152),结果见Fig.3D。以上结果提示,EPA干预能明显减轻小鼠肠黏膜纤维化症状,其作用效果优于DHA。
2.2.2 ω-3 PUFAs抑制肠纤维化小鼠结肠组织ECM沉积存在差异 MMPs/TIMPs失衡介导ECM产生和降解之间的不平衡,从而加剧IBD患者的肠道纤维化。为进一步了解ω-3 PUFAs对肠纤维化小鼠结肠组织ECM沉积发挥的差异作用,将各组小鼠结肠组织进行免疫组织化学和qRT-PCR分析,结果见Fig.4。相较于空白对照组,TNBS模型组小鼠结肠组织中TIMP-1表达显著上调(P<0.01),MMP-2、9表达显著下调(P<0.01);qRT-PCR和免疫组织化学结果进一步显示,TNBS模型组小鼠结肠黏膜和黏膜下层Col1a2和Col3a2表达量高于空白对照组(P<0.01),这与Masson和天狼星染色结果相一致。与其相反,EPA干预组能有效减少小鼠结肠黏膜和黏膜下层中Col1a2和Col3a2的表达水平,而DHA和鱼油干预组则与模型对照组无差异。以上结果显示,EPA干预可以通过调节TIMPs/MMPs之间的平衡来减弱肠纤维化小鼠黏膜中ECM沉积。

Fig.4 ω-3 PUFAs alleviate fibrotic deposition by promoting ECM metabolic homeostasis in TNBS mice (n=8) (A, B) The expression of Col1a2, and Col3a2 was detected by immunohistochemical staining of distal colon specimens (×40, scale bar 500 μm; ×100, scale bar 200 μm). (C) For quantitative analysis of the results of immunohistochemistry, the average optical density was calculated as IOD/total area. (D) The mRNA expression of ECM metabolic-related proteins was determined using quantitative real-time PCR. (*P<0.05, **P<0.01, compared with the control group. #P<0.05, ##P<0.01, compared with the TNBS model group)
2.3 二十碳五烯酸抑制上皮间质转化并减少胶原沉积作用优于DHA
2.3.1 ω-3 PUFAs抑制肠纤维化小鼠肠上皮间质转化存在差异 EMT是指在特定病理、生理以及免疫等因素作用下,具有极性的上皮细胞失去细胞特性,细胞间连接遭到破坏,而获得间质细胞的表型特征,在形态学上发生由上皮细胞向间质细胞转变的过程。表现为上皮细胞的表面标志物例如闭合蛋白(claudins)、咬合蛋白(occludin)、闭合小环蛋白(zonula occludens-1,ZO1)、E-钙黏着蛋白(E-cadherin)和细胞角蛋白(cytokeratin-8、20,CK-8/20)等表达逐渐减少或者消失,而间质细胞表面标志物例如波形蛋白(vimentin)、成纤维细胞特异蛋白1(ferroptosis suppressor protein 1,FSP1)、平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等逐渐增多。结果正如Fig.5所示,与空白对照组相比,TNBS模型组小鼠结肠中闭合蛋白1、咬合蛋白、闭合小环蛋白和E-钙黏着蛋白相对表达量明显下降(P<0.01);qRT-PCR同样证实E-钙黏着蛋白、细胞角蛋白-8/20的相对表达量低于空白对照组(P<0.01)。与其相反,TNBS模型组小鼠结肠中平滑肌肌动蛋白、成纤维细胞特异蛋白1和波形蛋白相对表达量显著升高(P<0.01)。值得注意的是,EPA干预组能恢复上皮细胞紧密连接标志蛋白质的表达,同时显著抑制间质细胞表面蛋白质的表达,但DHA及鱼油干预效果不明显。我们推测,EPA干预可拮抗TNBS破坏小鼠结肠上皮细胞紧密连接蛋白质的表达,增强肠纤维化小鼠肠黏膜机械屏障功能,防止肠上皮细胞脱离上皮层聚集到间质组织中转化为成纤维细胞,进而抑制EMT的发生。
2.3.2 ω-3 PUFAs抑制EMT并减少胶原沉积存在差异 自噬是一种高度保守的分解代谢过程,它在细胞内维持稳态发挥重要作用,也是EMT过程的重要调节因子。结果正如Fig.5所示,TNBS模型组小鼠结肠上皮细胞中自噬相关蛋白质p62和LC3表达量均显著低于空白对照组(P<0.01),提示自噬活性降低,DHA和鱼油干预组也明显下调,两组无统计学差异;EPA干预组p62和LC3表达量有所上调,与空白对照组接近。由此可见,EPA干预能有效缓解肠纤维化小鼠结肠自噬活性,恢复细胞内稳态平衡。mTOR是自噬的主要负调节器,通过抑制ULK1(Unc-51-like kinase 1)来抑制自噬过程;然而,AMP依赖的蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)是自噬的主要正调节器,其激活有助于促进细胞的自噬作用。相较于空白对照组,TNBS模型组小鼠结肠上皮细胞中mTOR表达水平明显升高(P<0.01),而p-AMPK和ULK1表达水平显著下调(P<0.01)。相较于TNBS模型组,EPA干预组增强了p-AMPK和ULK1的表达量,下调了mTOR的表达量,与空白对照组接近;值得注意的是,DHA和鱼油干预组中p-AMPK和ULK1表达量显著下调(P<0.01),其中DHA干预组下调更明显,而mTOR的表达量则相反,与TNBS模型组接近。
EMT的启动受多种EMT相关转录因子(EMT-associated transcription factor,EMT-TF)例如Snail2、Slug和Twist的调控。相较于空白对照组,TNBS模型组小鼠结肠组织中Snail2、Twist表达量显著上调(P<0.01);这与ECM沉积关键标志蛋白纤连蛋白(fibronectin)、胶原蛋白Ⅰ(collagenⅠ)和胶原蛋白Ⅲ(collagen Ⅲ)的表达结果相一致(Fig.5A)。与其相反,EPA干预组能有效减少小鼠结肠黏膜中Snail2、Twist、纤连蛋白、胶原蛋白Ⅰ和胶原蛋白Ⅲ的表达水平,而DHA和鱼油干预组则与模型对照组无差异。以上结果表明,EPA干预可抑制肠上皮细胞EMT,进而缓解肠纤维化小鼠结肠ECM沉积,而自噬途径对p62/snail2信号通路的抑制可能参与其中。
3 讨论
目前对肠纤维化的机制研究有了更深入了解,但针对肠道狭窄的治疗方法有限,导致大部分患者需要进行内窥镜干预甚至外科手术,然而应用这些治疗方法后的疾病复发率较高[1, 12]。针对IBD的抗炎疗法并不能预防、减轻或逆转肠纤维化[3]。新近研究指出,慢性炎症可能是启动纤维化过程的必要条件,并在调节肠纤维化进程中发挥至关重要的作用[13]。因此,寻求有效减轻肠纤维化的替代防治策略成为临床的未满足需求。本研究发现:(1)EPA在小鼠体内对TNBS诱导的肠纤维化具有显著的保护作用,其效果优于DHA和鱼油干预。这一效果与EPA有效的抗炎和抗纤维化作用密切相关。(2)EPA干预能恢复肠纤维化小鼠Th17/Treg平衡,促进肠道免疫稳态。(3)EPA干预通过抑制肠上皮细胞EMT,调节TIMPs/MMPs平衡,进而缓解肠纤维化小鼠结肠ECM沉积,而自噬途径对p62/snail2信号通路的抑制可能参与其中。
慢性炎症是肠纤维化进程中的强烈激活因子[14]。在多种促炎因子的长期诱导下,间充质细胞增多,ECM沉积加剧纤维化。课题组之前的研究发现,EPA在结肠炎小鼠中具有抗炎和保护肠道黏膜屏障的作用。相较于低剂量(100 mg/kg·bw)或高剂量DHA(400 mg/kg·bw)干预,高剂量EPA(400 mg/kg·bw)干预能够更有效地缓解葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎小鼠,表现为提高结肠组织中EPA含量,降低AA水平,显著降低促炎因子IFN-γ、TNF-α和IL-6的表达水平,增加抗炎细胞因子IL-10水平[8]。目前认为,Th1和Th17细胞在肠道炎症期间参与纤维化进程,主要归因于它们产生的促炎细胞因子[15]。更多证据表明,IL17诱导上皮细胞发生EMT,并对成纤维细胞和结肠肌成纤维细胞产生多种促炎作用[16]。报道显示,抗IL-17A抗体通过抑制EMT进而抑制肠道纤维化的发展[17]。此外,IL-17A敲除小鼠在炎症皮肤模型中表现出抗纤维化作用[18]。本研究发现,TNBS显著增加结肠中Th17细胞分化,同时抑制Treg细胞分化,可能导致免疫反应增强。与DHA和鱼油干预组相比,EPA干预显著下调肠纤维化小鼠血清和组织中IL-6和IL-17的表达水平,同时增加Treg细胞因子IL-10的表达。因此,本文认为EPA协同调控Th17和Treg有助于改善肠道免疫微环境,进而缓解肠道纤维化。
已有充足的证据表明,存在与炎症无关的肠道纤维化机制。即使去除炎症刺激并采取抗肿瘤坏死因子治疗等措施,肠道纤维化仍可能发生[19]。提示肠纤维化也是一个主动的、自我维持的过程,而非完全被动。肠纤维化以ECM沉积为特征,ECM由活化的肠间充质细胞产生,包括肌成纤维细胞(myofibroblasts)、成纤维细胞(fibroblasts)和平滑肌细胞(smooth muscle cells)。所有产生肠道内ECM的细胞之间具有协同作用,并受多种分子介质调控,其中TGF-β是最有效的介质。本研究中发现,EPA干预能有效抑制肠纤维化小鼠中TGF-β、IGF和α-SMA等促纤维化介质的表达,从而阻止肠纤维化。由于MMPs活性降低和/或TIMPs表达增加可能导致ECM过度沉积,进而导致IBD的纤维化。本研究利用qRT-PCR和Western免疫印迹检测发现,在TNBS诱导的肠纤维化小鼠模型中,相较于DHA和鱼油干预组,EPA干预能有效上调MMP-2和MMP-9的表达水平,使TIMP-1表达下调。随着正常肠组织被ECM蛋白所取代,ECM的过量积聚是肠纤维化的重要病理特征。ECM的成分包括胶原蛋白、弹性蛋白和纤维连接蛋白。本研究显示,EPA干预通过降低小鼠结肠黏膜中Col1a2和Col3a1的表达量进而减轻ECM积聚作用。
间充质样细胞的局部增加也是肠纤维化的重要特征。胶原合成由活化的成纤维细胞驱动,这些细胞存在于所有正常组织和器官的间质中,是纤维形成的主要介质。除了常驻成纤维细胞外,还可以通过EMT将上皮细胞和内皮细胞转化为活化的成纤维细胞,成纤维细胞的局部增加促进了纤维化进程。在EMT过程中,上皮细胞失去了其上皮特性,例如极性和黏附性,且降低了上皮标志物的表达,如E-钙黏着蛋白和细胞角蛋白-8/20。随后,这些细胞获得间质表型,包括梭形细胞形态、可塑性、运动性、ECM产生能力同时间标志物表达增加,如N-钙黏着蛋白、波形蛋白、FSP1和α-SMA。Scharl等人[20]证实了EMT在IBD相关肠纤维化发病机制中的作用。考虑到EMT过程可能是可逆的,抑制局部间质样细胞的增加,可能成为治疗肠纤维化的潜在有效策略。本研究证实,相较于DHA和鱼油干预,EPA能更有效上调E-钙黏着蛋白表达,降低N-钙黏着蛋白和波形蛋白水平,恢复肠上皮细胞表型。本文推测,EPA干预可能恢复TNBS模型鼠中结肠上皮细胞紧密连接蛋白的表达,增强肠纤维化小鼠的肠黏膜机械屏障,防止肠上皮细胞从上皮层脱离并聚集到间质组织中转化为成纤维细胞,从而抑制EMT。
自噬体的形成由ULK1复合体和Beclin1复合体共同启动,而后由LC3进一步加工延伸。货物受体p62将自噬靶点招募到自噬体中,最终与溶酶体结合形成自噬溶酶体,降解细胞内容物[21]。研究显示,mTOR通过抑制ULK1复合物的活性作为自噬起始的主要抑制剂[22];而AMPK是自噬的主要正调节器,通过激活ULK1复合物促进细胞自噬。自噬与EMT之间存在相互作用,它们共同促进肠纤维化。Snail与Twist作为重要的EMT相关转录因子[23],激活自噬途径可以下调Snail与Twist的表达,进而抑制EMT进程[24]。本研究发现,相较于DHA和鱼油干预,EPA干预对自噬通路激活有积极作用,可上调ULK1、LC3和p62的表达量;同时,EPA通过激活AMPK磷酸化和抑制mTOR表达,活化ULK1,促发自噬通路。相反,EPA干预组能显著降低小鼠结肠黏膜中Snail2、Twist、纤连蛋白、胶原蛋白 I和胶原蛋白III的表达水平,而DHA和鱼油干预组与模型对照组无差异。根据以上结果本文推测,EPA干预可能通过促进自噬途径抑制p62/snail2信号通路介导上皮细胞的EMT,从而缓解肠纤维化小鼠肠道ECM的沉积。在一项利用异位移植模型进行的肠纤维化研究中,植入的结肠组织在7 d后表现出自噬缺陷和胶原沉积[25],而诱导成纤维细胞发生自噬途径则显著降低胶原蛋白质表达水平[25]。此外,在自噬抑制剂处理的小鼠的结肠组织中,发现促炎介质的表达增加和促肠纤维化的CD16+-M2巨噬细胞浸润[26]。同时,也有研究发现,刺激自噬途径会阻碍EMT,从而减轻DSS诱导的肠道纤维化[27];诱导自噬可抑制与TNBS慢性结肠炎相关的肠纤维化[26]。在其他器官的纤维化研究中也有相关报道:抑制自噬能介导肺泡上皮细胞的p62/SQSMT1-NF-κB-Snail2通路导致EMT,并通过旁分泌信号促进局部肌成纤维细胞分化[28]。肺泡上皮细胞中mTOR的过度激活和肺中受损的自噬参与了肺纤维化的发病机制[29]。然而,新近的研究显示,对于DSS诱导的肠纤维化模型,抑制自噬通路可以阻止成纤维细胞的活化并抑制ECM分泌,从而缓解与UC相关的肠纤维化,而在CCD-18Co肠纤维化细胞的人原代结肠成纤维细胞中,抑制自噬通路能有效阻止肠成纤维细胞的活化[30]。由此可见,自噬在IBD相关肠纤维化发展中的作用是复杂且有争议的,自噬的上调和下调都被认为与肠纤维化的进展有关,本研究推测,EPA可能促进自噬途径进而有效缓解肠纤维化。
以上研究提示,EPA和DHA差异性地抑制上皮细胞向间充质细胞转化和减少胶原沉积,缓解肠道炎症和纤维化,而自噬途径可能在抑制EMT中发挥作用。EPA有望成为防治肠纤维化的新型食源性候选物质,但肠纤维化的发病机制复杂,EPA通过调控自噬缓解肠纤维化的具体分子机制亟待进一步阐明。

