青蒿素通过TIGIT/CD155信号轴调控4T1乳腺癌细胞转移与凋亡
冯亚婵, 张皓杰, 杜 朝, 郭学玲, 王英泽
(河北科技大学食品与生物学院细胞工程研究室, 石家庄 050018)
乳腺癌(breast cancer,BRCA)替代肺癌成为全球第一大癌,是严重影响我国女性生命健康的重大疾病之一。并且,随着晚育、生育减少以及紊乱生活作息的日益增多,全世界各地女性乳腺癌发病率迅速增长[1]。研究发现,约33%的乳腺癌患者在诊断时已进展为晚期转移性疾病,并且大约80%的患者死于乳腺癌转移[2]。因此,亟待新的治疗手段阻止乳腺癌的进一步转移恶化。但是,癌症转移涉及到新生血管生成、上皮-间质转化、肿瘤转移相关基因表达调控等,其病理生理过程相当复杂[3-5]。目前,临床上对于转移性乳腺癌的治疗主要依靠化疗,但单独化疗的高毒性显著降低患者的生存质量。因此仍迫切需要探寻安全有效的药物用于乳腺癌患者临床治疗。近年来,中医药在肿瘤治疗中的应用日益突出。并且,越来越多的中药有效成分再利用成为抗癌药物发现并开发的替代方法,大大缩短了药物开发时间,增加了转移性肿瘤患者的治疗机会。
青蒿素(artemisinin,ART)是从天然植物黄花蒿中提取出的内含过氧化桥基团的倍半萜内酯成熟药物[6]。近年来研究发现,ART能够抑制肿瘤细胞增殖、促进DNA损伤反应、阻断肿瘤进展关键信号通路(例如Wnt/β-catenin),使其在肿瘤治疗领域备受关注[7-9]。Mohd Farhan[10]等人研究发现,ART以浓度依赖性方式显著降低了葡萄膜黑色素瘤细胞的迁移和侵袭能力,且进一步研究表明,ART的抗癌作用可能是通过抑制PI3K/AKT/mTOR途径介导的。Deeptashree Nandi[11]等人研究显示,ART通过破坏其靶标的启动子区域的转录作用来显著下调FoxM1的转录活性,从而抑制许多致癌驱动因素的作用。此外,青蒿素对前列腺癌的治疗作用也有相关研究[12]。然而,针对ART对乳腺癌转移的作用效果及作用机制报道较少。本研究通过检测ART对4T1乳腺癌细胞增殖、迁移和侵袭、细胞周期和细胞凋亡等的影响,明确了ART对转移性乳腺癌的抑制迁移和诱导凋亡的作用,初步揭示了其作用机制可能涉及对TIGIT/CD155信号轴的调控,为深入研究ART的抗肿瘤作用提供一定的数据支撑和理论支持。
1 材料与方法
1.1 药物与试剂
青蒿素、0.1%结晶紫染色液、细胞固定液、细胞周期试剂盒、高效RIPA组织细胞裂解液、脱脂奶粉(索莱宝科技有限公司,北京);Biozellen植物源基质胶(比丽(Biozellen)生物有限公司,美国);线粒体膜电位试剂盒(雷根生物有限公司,北京);ROS试剂盒、蛋白酶抑制剂、蛋白质上样缓冲液(5×)(碧云天生物技术公司,上海);MTS试剂盒(Promega生物科技有限公司,北京);细胞凋亡试剂盒(YESEN生物科技有限公司,上海);DMEM培养基、1640培养基、胎牛血清、PBS缓冲液(Gibco公司,美国);PCR引物(Invitrogen科技公司,美国);SDS-PAGE凝胶快速配制试剂盒、超敏化学发光试剂盒(赛维尔生物科技有限公司,武汉)。
1.2 仪器
酶标仪、台式高速冷冻离心机与二氧化碳培养箱(Thermo Fisher Scientific,美国);流式细胞分选仪(Becton Dickinson and Company,美国);倒置荧光显微镜(Nikon,日本);实时荧光定量PCR仪(ABI,美国);电泳仪(北京六一仪器厂,北京)。
1.3 细胞株及溶液
4T1小鼠乳腺癌细胞株购自丰晖生物科技有限公司(长沙);HC11小鼠胸腺上皮细胞株购自赛维尔生物科技有限公司细胞库(武汉)。
ART溶液:准确称取28.2 mg ART,加二甲基亚砜(DMSO)溶解,混匀,备用。后续用基本培养基进行梯度稀释。
1.4 细胞培养
使用含10%胎牛血清和1%青霉素/链霉素的1640完全培养基培养小鼠乳腺癌细胞4T1及小鼠胸腺上皮细胞HC11。各实验均采用状态良好的对数生长期细胞进行。
1.5 MTS法测定细胞活力
分别取4T1及HC11细胞接种至96孔板中,每孔5×104个细胞,培养24 h。培养结束后,每孔加入100 μL不同浓度(0(对照组)、10、100、200、400、500、600和800 μmol/L)的ART,每个浓度设置5个复孔,另设空白培养基组;药物作用24、48、72 h时,每孔加入10 μL MTS溶液,继续培养3~4 h使用酶标仪在498 nm波长下测定每孔的光密度(A),计算相对细胞活力。相对细胞活力(%)=(实验组A498=空白培养基组A498)/(对照组A498=空白培养基组A498)×100%。实验至少重复3次。
1.6 4T1细胞转移能力检测
1.6.1 划痕实验[13]将4T1细胞接种于12孔板中,细胞密度为1×106个/mL,500 μL/孔,培养至80%~90%融合;使用200 μL无菌移液管尖端在孔的中间划出“伤口”,再用PBS冲洗除去细胞碎片;以浓度为0(对照组)、100和200 μmol/L的ART溶液处理,每组2个重复孔;ART处理后0、12、24、48 h,使用荧光倒置显微镜观察并拍照。使用Image J软件测量伤口面积。实验至少重复3次。
1.6.2 基质凝胶包被的跨孔侵袭实验[14]按照Biozellen细胞培养基基质胶说明书稀释A胶及C胶,并置于Transwell小室上层,在4 ℃冰箱孵育2~3 h;利用1640培养基将4T1细胞制成8×106个/mL悬液,各Transwell小室上层加入0.8 mL细胞悬液,小室下层分别加入浓度为0(对照组)、100和200 μmol/L的ART溶液,每组2个重复孔,并设立阴性对照组;培养48 h,借助棉签轻轻移除位于基质凝胶涂层或未涂层腔室上表面的细胞,存在于膜下表面的侵袭性迁移细胞用预冷固定液固定,用结晶紫染色,使用倒置显微镜观察,选用10个以上不同视野计数,若视野中细胞数超过50个细胞用Image J软件细胞计数[15]。实验至少重复3次。
1.6.3 细胞集落形成实验 将4T1细胞以每孔1×104个/孔的密度接种于6孔板中,每孔1 mL,培养24 h;再以浓度为0(对照组)、100和200 μmol/L的ART处理,每组2个重复孔;处理48 h,用PBS清洗细胞3次,以4%的预冷固定液固定细胞后用结晶紫染色,使用倒置显微镜观察,选取10个以上不同视野计数,若视野中细胞数超过50个细胞用Image J软件细胞计数[15]。实验至少重复3次。
1.7 4T1细胞凋亡能力检测
1.7.1 细胞ROS检测 将4T1细胞接种于24孔板中,细胞密度为1×105个/mL,500 μL/孔,培养24 h;以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理,每组设置3个重复孔;处理24 h,消化收集细胞并用稀释好的ECFH-DA荧光探针溶液重悬,37 ℃孵育20~30 min,用培养基清洗2~3次并用PBS重悬细胞,使用流式细胞仪检测。细胞活性氧的数量可以用平均荧光值表示,细胞荧光信号也通过荧光显微镜进行测量和记录。实验至少重复3次。
1.7.2 细胞线粒体膜电位检测[16]将4T1细胞接种于24孔板中,细胞密度为1×105个/mL,500 μL/孔,培养24 h;以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理,每组设置3个重复孔;处理24 h,将消化清洗后的细胞与JC-1工作液在37 ℃下孵育20 min,再用PBS洗涤2~3次;使用流式细胞仪检测。采用Flow Jo软件进行线粒体膜电位的分析,线粒体膜电位(Δψm)用JC-1红色/绿色荧光强度比值来表示,细胞的2种荧光信号也能通过荧光显微镜进行测量和记录。实验至少重复3次。
1.7.3 细胞周期检测 利用DNA含量检测方法确定细胞周期的变化,将4T1细胞接种于12孔板中,细胞密度为5×105个/ mL,500 μL/孔,培养细胞24 h,以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理,每组设置3个重复孔;处理24 h,消化收集细胞并用PBS清洗2~3次,再用70%的预冷乙醇重悬;收集好的细胞并置于4 ℃下过夜处理;再用PBS清洗1次,加入RNase A重悬,37 ℃水浴30 min;最后加入PI染液4 ℃避光孵育30 min;使用流式细胞仪检测,用Flow Jo软件进行线粒体膜电位的分析,细胞周期阻滞情况以荧光值的差异进行表示。实验至少重复3次。
1.7.4 细胞凋亡检测 将4T1细胞接种于24孔板中,细胞密度同ROS检测,培养24 h,以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理;处理细胞24 h,消化收集细胞,PBS清洗2~3次并加入1×结合缓冲液(binding buffer)、PI和Annexi V-FITC避光孵育10~15 min;加入1×结合缓冲液(binding buffer)混匀,使用流式细胞仪检测,以Flow Jo软件分析细胞凋亡情况,细胞的2种荧光信号也通过荧光显微镜进行测量和记录。实验至少重复3次。
1.8 4T1细胞转移及凋亡机制初步探索
1.8.1 生物信息分析基因表达及靶点预测 从TIMER 2.0数据库(http://timer.cistrome.org/)中验证TIGIT基因在不同肿瘤组织及正常组织中的表达情况及相关数据,并对关键靶点基因进行预后分析[17-19]。另外,将TIGIT基因对应蛋白质导入STRING数据库(https://cn.string-db.org/),限定物种为“Mus musculus”,并以置信度≥0.4,隐藏离散的点,得到潜在作用靶点与相互作用关系。
1.8.2 qPCR检测基因表达 将细胞接种于6孔板中,细胞密度为1×106个/mL,2 mL/孔,培养24 h;以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理;处理细胞24 h,使用TRIzol试剂提取细胞总RNA成分;逆转录获得cDNA,并进行实时荧光定量基因检测;qPCR反应条件如下:95 ℃ 10 min,95 ℃ 30 s,62 ℃ 30 s,72 ℃ 15 s,40个循环。各个实验组均为3个样本重复,实验重复3次。使用GAPDH作为内参基因。
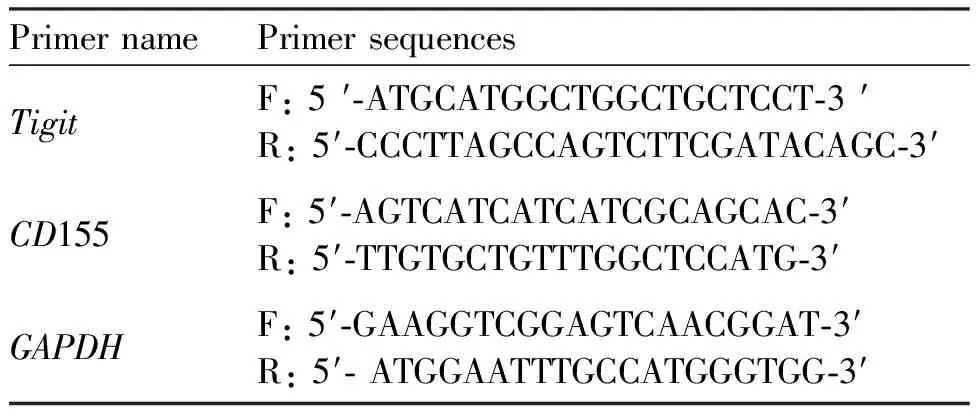
Table 1 Primer sequences
1.8.3 Western印迹检测蛋白质水平 样品制备:将细胞接种于6孔板中,细胞密度为1×106个/mL,2 mL/孔,培养24 h;以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理;处理细胞24 h,使用细胞蛋白质裂解液(RIPA:蛋白酶抑制剂=100∶1)裂解细胞;取上清转移至新的离心管中。
SDS-PAGE电泳:在蛋白质中加入蛋白质上样缓冲液,95 ℃煮沸5 min制备样品。再使用12%的分离胶与5%的浓缩胶,电泳条件为160 V,1 h用于分离样品蛋白质。转膜与封闭:使用甲醇激活PVDF膜,PVDF膜和SDS-PAGE胶按顺序放好,将转膜电泳槽置于冰水浴中300 mA,50 min电泳,将上一步凝胶中的蛋白质转移至PVDF膜上。再使用脱脂牛奶室温水平摇床封闭1 h。抗体孵育:加入一抗(抗体浓度:1∶1 000),4 ℃孵育过夜。二抗(抗体浓度:1∶5 000)室温孵育1 h。成像:使用ECL检测试剂盒显色,采用电泳凝胶成像分体系统成像。
1.8.4 流式检测基因表达 将细胞接种于24孔板中,细胞密度为1×105个/mL,500 μL/孔,培养24 h;以浓度为0(对照组)、100、200、400和800 μmol/L的ART处理;另外单独接种相同密度的HC11细胞于24孔板中,不进行药物处理作为细胞阴性对照;处理及培养24 h,胰酶消化收集细胞;使用PBS清洗细胞2~3次,冰上避光孵育TIGIT-PE抗体30 min;采用流式细胞术检测4T1及HC11细胞表面TIGIT变化。各个实验组均为3个样本重复,实验重复3次。
1.9 统计学方法
使用Image J软件及Flow Jo软件进行统计分析。所有实验均一式三份。数据大多表示为平均值±标准偏差SD。使用单向方差分析进行统计分析,P<0.05被认为具有统计学意义。
2 结果
2.1 青蒿素能够抑制4T1乳腺癌细胞增殖
为了考察ART能否抑制4T1乳腺癌细胞增殖,本文使用不同浓度的ART处理细胞,然后以MTS方法检测了4T1乳腺癌细胞的活力,结果见Fig.1A。就不同浓度的ART处理效果而言,无论处理时长是24 h、48 h还是72 h,低浓度(0~200 μmol/L)ART对于细胞活力无明显抑制作用;中、高浓度(400~800 μmol/L)ART显著或极显著抑制细胞增殖,细胞活力都低至70%以下,而且这种抑制作用呈现出明显的浓度依赖性,结果确切表明ART可以抑制4T1细胞增殖。从不同处理时长的效果表明,低浓度ART处理48 h时,细胞活力略小于处理72 h,后者又略小于处理24 h,表明48 h以内这种轻微的抑制作用有时长依赖性,48 h之后,与ART抑制作用相比,细胞状态恢复占主导地位。与此不同,中、高浓度ART处理表现出明显的时长依赖性。
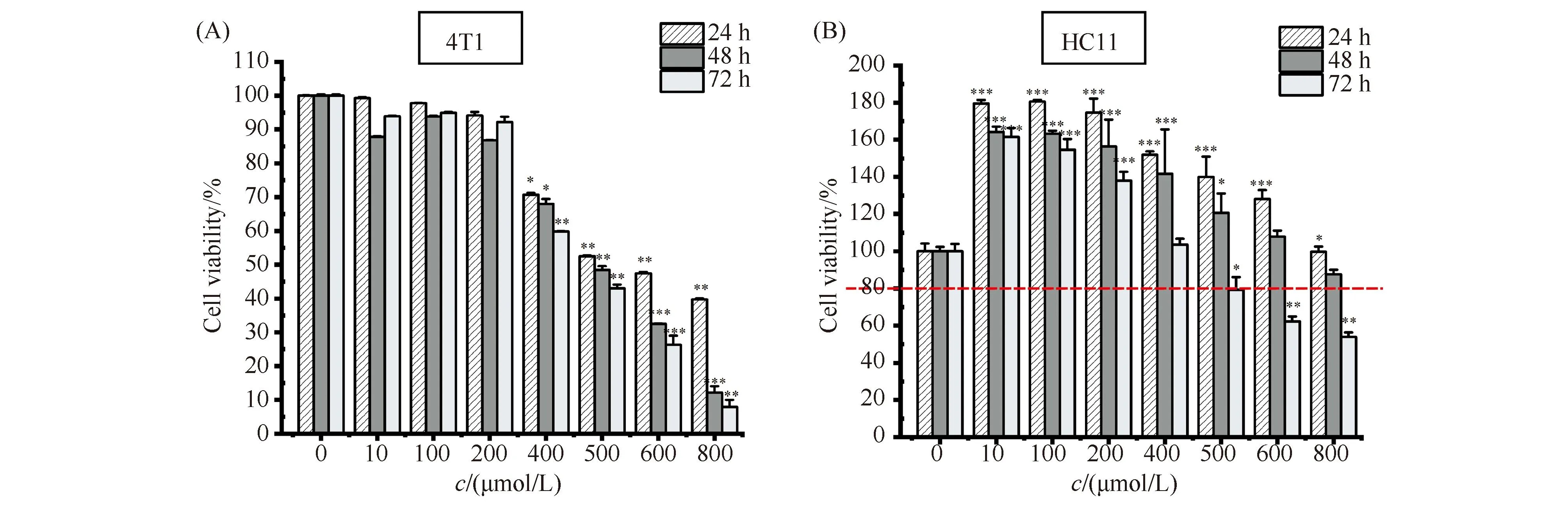
Fig.1 Detecting the inhibitory effect of ART on cell viability (A,B) Mouse 4T1 breast cancer cell and mouse HC11 mammary epithelial cells (5×104 cells/well) were plated into 96 wells and the cells were exposed for increasing concentration of ART for 24, 48, 72 hours, respectively. Cell proliferation was measured by the MTS assay. *P <0.05, ** P <0.01, *** P <0.001. The P-values were calculated using an unpaired two-tailed Students’ t-test
作为对照的HC11细胞对ART处理表现出了不同于4T1细胞的活力变化模式,结果见Fig.1B。低浓度ART显著促进HC11细胞增殖。中浓度(400~600 μmol/L)ART呈现轻微抑制效果,但细胞活力维持在80%以上,而且随着处理时间延长,这种效果有所增强。高浓度(800 μmol/L)ART表现出抑制作用,但只有长时间处理(48 h和72 h)细胞活力才显著降低,且降幅远低于经相同条件处理的4T1细胞。
综上所述,ART可以抑制4T1细胞增殖,而且,这种抑制作用在本文所选中的高浓度呈现出浓度依赖性和处理时长依赖性。特别是这种处理作用表现出细胞类型的特异性,对HC11细胞几乎未见抑制作用,即使高浓度长时间处理可以抑制,也远低于同样条件对4T1细胞的抑制幅度,结果提示,ART具备恶型特异杀伤能力及细胞安全性。
2.2 青蒿素可以抑制乳腺癌4T1细胞迁移
在明确了ART能够抑制4T1细胞增殖之后,本文进一步检测了它是否能够抑制4T1细胞迁移。首先,通过细胞划痕实验考察不同浓度ART对4T1细胞迁移能力的影响,结果见Fig.2。与对照组相比,ART处理均减少4T1细胞的迁移面积,说明ART能够显著抑制乳腺癌细胞迁移。并且表明ART处理时长相同时,200 μmol/L浓度下的迁移面积总是小于100 μmol/L浓度下的迁移面积,说明这种抑制作用存在浓度依赖性。另一方面,ART处理浓度一致时抑制细胞迁移效果都随着处理时间延长而增大,说明这种抑制作用同样存在时长依赖性。
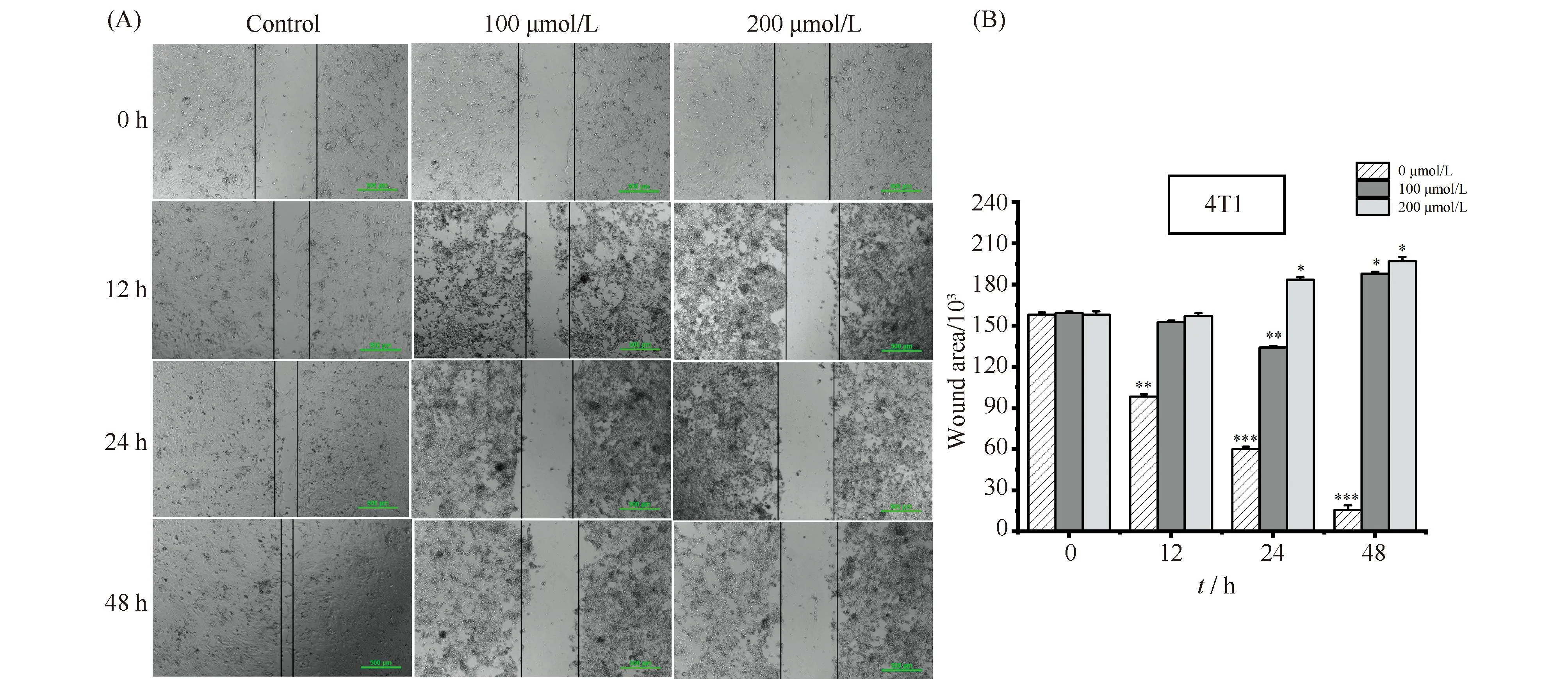
Fig.2 Detecting the effect of ART on the migratory capacity of cells (A) ART markedly inhibited migration of 4T1 cell after treatment with different concentrations (100, 200 μmol/L) and different durations (12, 24, 48 hours). Untreated cells were used as control. Scale bar is 500 μm. (B) The wound area of migration 4T1 cell upon treatment and data represented as a bar graph with respect to untreated (control) cells, which also served as our experimental controls. Data represented as mean±standard error of the mean (n=3). *P<0.05, **P<0.01, *** P<0.001. The P-values were calculated using an unpaired two-tailed Students’ t-test
2.3 青蒿素抑制乳腺癌4T1细胞侵袭及集落形成
为了探讨ART对4T1细胞侵袭能力的作用,本文采用Transwell实验检测了ART是否具备抑制4T1细胞侵袭的能力。结果正如Fig.3A, B所示,各浓度ART处理均能使附着在Transwell腔室底部的侵袭性细胞数量明显减少,量化分析显示,不同浓度ART均显著抑制了4T1细胞侵袭,而且这种抑制作用具有浓度依赖性,其中100 μmol/L浓度下细胞数量为对照组的60.85%;而200 μmol/L浓度下的细胞数量仅为对照组的45.30%。
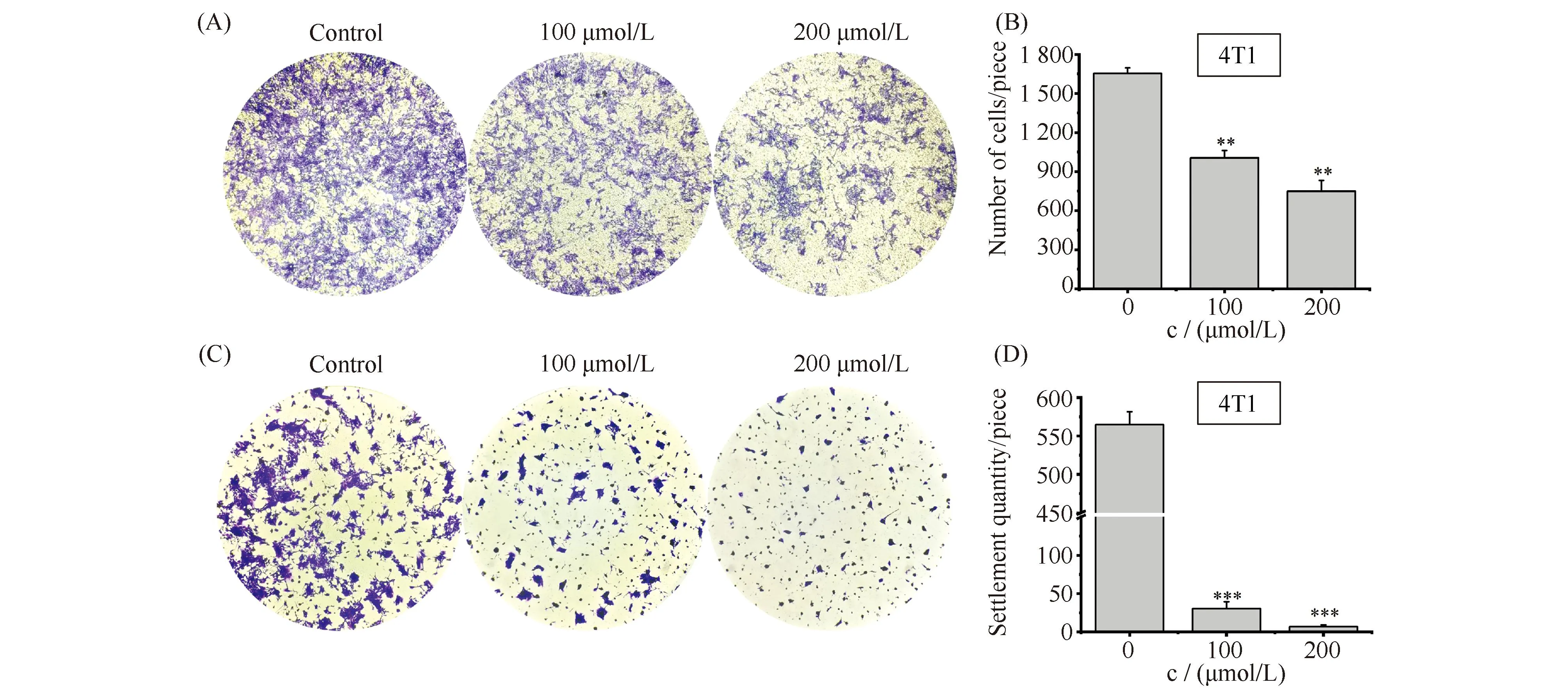
Fig.3 Anti-invasion and anti-clonogenic potency of ART (A,B) Transwell assays to determine the invasiveness of 4T1 cells after exposure to ART (100,200 μmol/L) for 24 hours. Invaded cells were fixed with 4% formaldehyde and stained with crystal violet and imaged using the EVOS®FL Imaging System. Representative bar graphs of the number of invaded cells with each treatment group, where untreated (control) cells served as an experimental control. (C, D) The colony formation assay was used to test the inhibition of ART. Upon treatment with ART (100, 200 μmol/L) for 24 hours. Colonies were fixed with 4% formaldehyde and stained with crystal violet and imaged using the EVOS®FL Imaging System. The number of colonies formed by each treatment group; untreated cells (control) were considered as our experimental controls. Data represented mean ± standard error (n=3).*P<0.05, **P<0.01, *** P<0.001. The P-values were calculated using an unpaired two-tailed Students’ t-test
此外,细胞集落形成实验作为细胞转移后增殖的主要标志之一,结果见Fig.3C,D。检测结果显示,各浓度ART处理均能使4T1细胞形成的集落明显减少,极显著抑制细胞集落形成。而且这种抑制作用同样具有浓度依赖性,其中100 μmol/L浓度下细胞数量为对照组的17.10%;而200 μmol/L浓度下的细胞数量更是仅为对照组的1.20%。
2.4 青蒿素促进乳腺癌4T1细胞活性氧的产生
当4T1细胞受到外界刺激时,线粒体膜电位受到刺激的同时影响呼吸链随之产生活性氧(reactive oxygen species,ROS),而ROS水平过量升高会引发线粒体自噬。因此,为了探讨氧化应激是否是导致4T1细胞早期凋亡的原因之一,本文利用活性氧探针进行检测,结果见Fig.4。结果显示,ART以浓度依赖的方式诱导4T1细胞ROS的产生,其中800 μmol/L的ART诱导ROS量为对照组的176.80%。结果提示,ART可能通过激发氧化应激促进肿瘤细胞的凋亡。
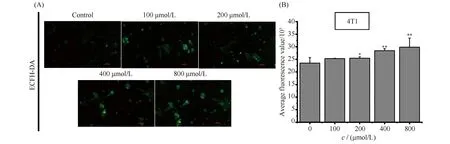
Fig.4 ART induces ROS in 4T1 cells (A, B) Intracellular ROS observation of 4T1 cells exposed to ART. ROS is represented by green fluorescence. Scale bar: 100 μm. Data are presented as mean ± SD. *P<0.05; **P < 0.01; significantly different from the control
2.5 青蒿素诱导乳腺癌4T1细胞线粒体膜电位丧失及周期阻滞
线粒体膜电位丧失是细胞早期凋亡的标志性事件之一,通常是细胞凋亡最早发生的事情。与正常细胞相比,肿瘤细胞线粒体膜电位通常呈超极化状态,本文利用JC-1染色法检测了4T1细胞膜电位的变化,结果见Fig.5A。结果显示,ART同样以浓度依赖的方式促进4T1乳腺癌细胞线粒体膜电位的丧失。倒置荧光显微镜能直观看到不同浓度ART处理4T1细胞红/绿荧光的比值明显变化。量化分析同样显示,各浓度ART都显著或极显著降低了4T1细胞线粒体膜电位。其中,800 μmol/L的ART促进线粒体膜电位丧失率为对照组的82.10%。
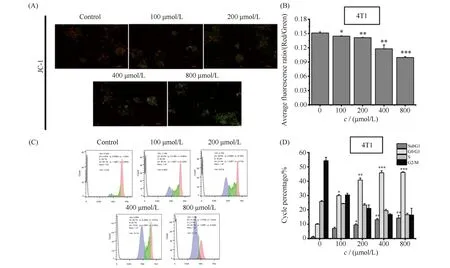
Fig.5 ART promoted the decrease of mitochondrial membrane potential (ΔΨ) and induced cell cycle arrest in the 4T1 cells (A,B) Cells were treated as described in the Materials and methods and then incubated with the membrane potential indicator, JC-1. Intracellular red and green fluorescence of JC-1 were determined by an inverted fluorescent microscope. The intracellular red and green fluorescence of JC-1 was measured using Flow Cytometry. Histogram showing the red/green fluorescence intensity ratio in differently treated cells (n=3). Treatment with ART decreased the mitochondrial membrane potential in 4T1 cell (*P<0.05, **P<0.01, ***P<0.001). (C) Representative results showed that ART induces cell cycle arrest in 4T1 cells. 4T1 cells were subjected to cell cycle analysis. (D) Quantitative results of the cell cycle phase of results in (C)
细胞凋亡包括早期凋亡和晚期凋亡,为进一步考察ART对4T1乳腺癌细胞晚期凋亡的影响效果,利用流式细胞术PI染色法检测4T1细胞周期分布情况。晚期凋亡细胞由于总DNA量降低,G0/G1期前细胞会出现DNA低染细胞群,即SubG1期。PI染色显示不同浓度ART处理的4T1细胞相较于对照组,其SubG1与G0/G1期均受到阻滞,尤其G1期周期阻滞明显具有浓度依赖趋势,结果见Fig.5C,D。检测结果显示,ART诱导4T1乳腺癌细胞SubG1期的出现,说明4T1细胞出现晚期凋亡。而G0/G1期阻滞则表示青蒿素通过引起4T1细胞周期阻滞进而引起细胞凋亡。因此,ART处理引起4T1细胞G0/G1期阻滞及SubG1期的出现,二者共同促进乳腺癌细胞的凋亡。
2.6 青蒿素诱导乳腺癌4T1细胞凋亡
最后利用V-FITC/PI染色法考察ART对4T1细胞凋亡作用的影响,结果见Fig.6。结果显示,不同浓度的ART均能显著诱导4T1细胞凋亡(Q2+Q3),且呈现剂量依赖模式。其中,400 μmol/L ART的细胞凋亡率约为31.51%,而800 μmol/L ART的细胞凋亡率约为39.14%。
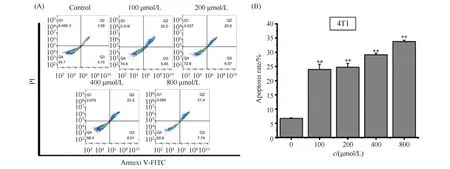
Fig.6 AV/PI detected the apoptotic cell percentage of 4T1 cells (A) ART significantly increased the apoptotic cell percentage of 4T1 cells compared with the control group (**P<0.01). The raw percentage of live, (early) apoptotic, (late) apoptotic/dead, and dead cells in each group are displayed. (B) Quantitatively apoptotic populations of 4T1 cells. The p-values were calculated using an unpaired two-tailed Students’ t-test
2.7 青蒿素下调4T1乳腺癌转移相关信号轴TIGIT-CD155的mRNA表达水平
T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains,TIGIT)免疫检查点正在成为单独抗癌治疗或与其他免疫阻断疗法联合使用的希望靶标[20]。因此,初步确定选择TIGIT作为ART的作用靶点进行探索。利用TIMER 2.0数据库验证TIGIT信号靶点在乳腺癌肿瘤组织及正常组织中的表达差异,结果正如Fig.7A所示,TIGIT在乳腺癌组织中高表达且与正常组织相比具有极显著差异。在确定TIGIT信号靶点之后,本文又利用STRING数据库进一步查找与TIGIT相关的主要结合蛋白质结合位点,分析结果见Fig.7B,CD155(PVR)与TIGIT的结合能力最强(综合得分为0.999),初步认为TIGIT/CD155信号轴为ART的潜在作用轴。
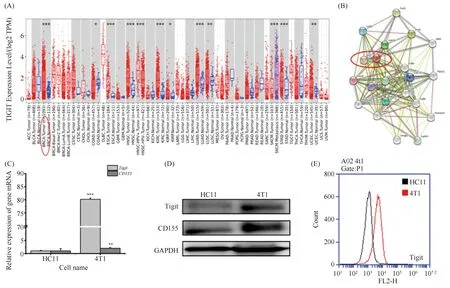
Fig.7 The TIGIT-CD155 signaling axis is aberrantly expressed in tumor cells (A) Expression analysis of TIGIT in tumor and normal tissues by TIMER 2.0 database analysis. (B) The interaction network of TIGIT and other target in Mus musculus constructed using STRING database. (C) RNA analysis was performed for Tigit/CD155 gene expression in 4T1 and HC11 cells. (D) The expression of Tigit/CD155 protein levels is analyzed by Western blot in 4T1 and HC11 cells. (E) Flow cytometry analysis of the expression of Tigit on the surface of 4T1 and HC11 cells. *P<0.05, **P<0.01, *** P<0.001. The p-values were calculated using an unpaired two-tailed Students’ t-test
另外,为进一步确定人源数据库是否可以应用于鼠源分析,本文对4T1细胞及HC11细胞的TIGIT/CD155信号轴的基因水平及蛋白质水平分别进行了验证,结果见Fig.7C,D。Tigit及CD155均在乳腺癌细胞中具有异常高表达的情况,其中qPCR显示,4T1细胞中CD155的表达率为HC11细胞的14.24倍,而Tigit表达率更是高达80.19倍。此外,利用流式对Tigit的表达再一次进行检测验证,结果见Fig.7E,4T1细胞的Tigit表达峰与HC11细胞的表达峰相比明显右移,可见其表达率显著高于HC11细胞。因此数据表明,基因水平、蛋白质及流式结果均与生物信息分析数据相呼应,Tigit在肿瘤细胞异常高表达。因此,下一步将检测ART对4T1细胞TIGIT-CD155信号轴的影响。
采用实时荧光定量PCR(qPCR)检测了ART处理对TIGIT/CD155信号轴基因表达的影响,结果正如Fig.8A,B所示。经过不同浓度ART处理后的4T1乳腺癌细胞Tigit的mRNA水平均极显著降低,而且降幅呈现浓度依赖性,其中800 μmol/L的ART处理其表达率仅为9.84%;而CD155的mRNA水平因ART处理下降幅度也呈现浓度依赖性,只是仅在中(400 μmol/L的表达率为92.28%)、高(800 μmol/L的表达率为90.02%)浓度处理后,才呈现出显著下降趋势。另外,蛋白质水平同样具有相同的作用效果,结果见Fig.8C。最后,为再进一步确定Tigit的表达情况,同样利用流式细胞术进行验证,结果见Fig.8D,经不同浓度的ART处理后的4T1细胞Tigit表达情况受到抑制,其同样具有浓度依赖的趋势。因此,上述结果提示,ART作用于TIGIT/CD155信号轴进而调控4T1乳腺癌细胞的转移及凋亡,但其中作用效果的特异性仍需要进一步实验验证。
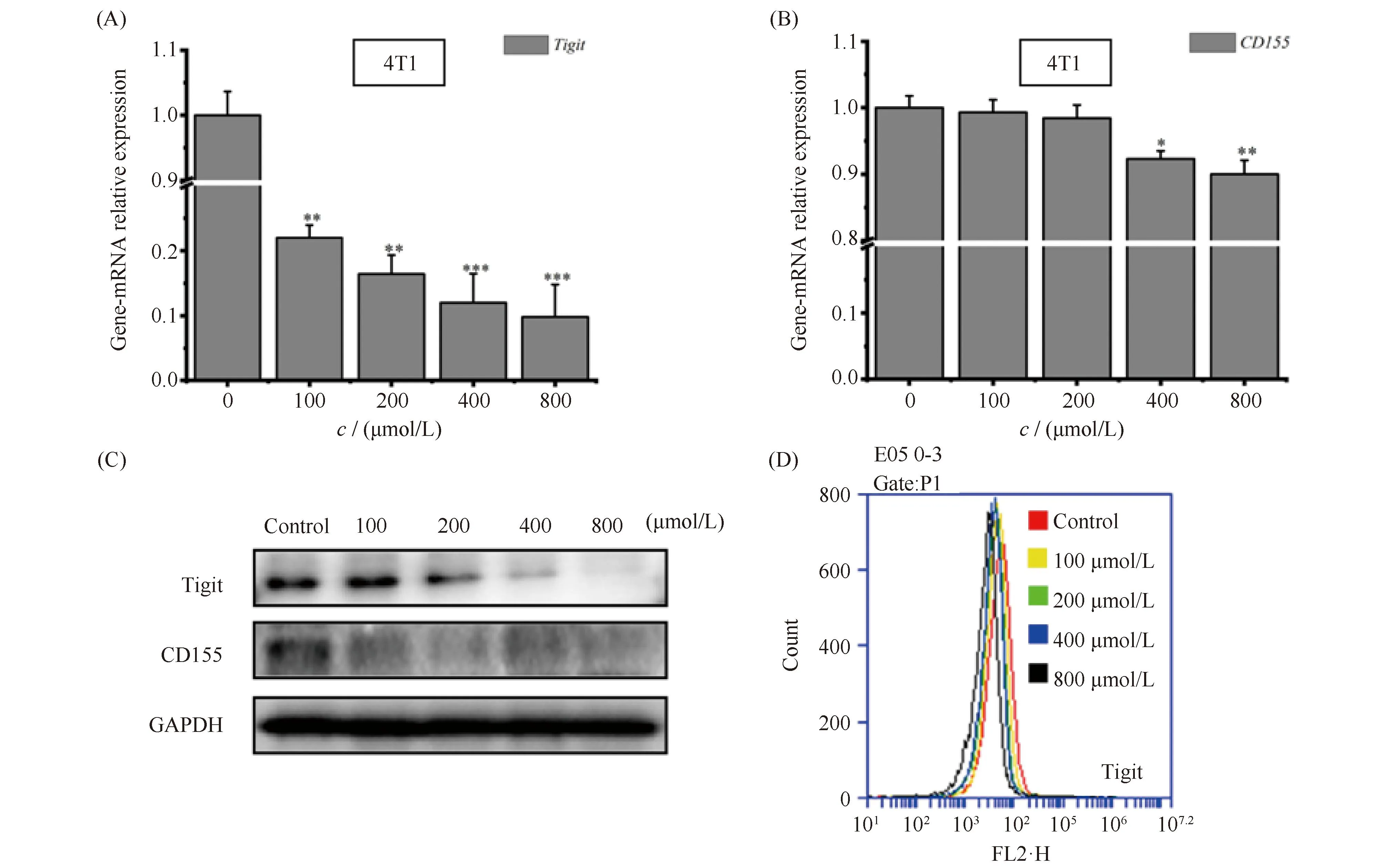
Fig.8 The effect of ART on the expression of Tigit-CD155, a signaling axis related to metastasis of 4T1 breast cancer cells (A,B) RNA analysis of Tigit and CD155 in 4T1 cells treated with ART (100, 200, 400, 800 μmol/L) for 24 hours. (C) Western blot analysis of Tigit and CD155 in 4T1 cells treated with ART (100, 200, 400, 800 μmol/L) for 24 hours. (D) Flow cytometry analysis of Tigit in 4T1 cells treated with ART (100, 200, 400, 800 μmol/L) for 24 hours. *P<0.05, **P<0.01, *** P<0.001. The p-values were calculated using an unpaired two-tailed Students’ t-test
3 讨论
乳腺癌作为高异质性肿瘤,具有高转移性和低T细胞免疫浸润的特点。因此,抑制肿瘤细胞转移并诱导肿瘤细胞凋亡是乳腺癌治疗的重要策略[21]。近年来研究发现,ART及其衍生物例如二氢青蒿素、青蒿琥酯等的抗肿瘤作用日益突出[22]。另外,青蒿素还应用于肺癌、肝癌和白血病等多种癌症治疗。然而,青蒿素的抗肿瘤作用机制复杂,涉及细胞周期阻滞、增加胞内氧化应激水平和诱导细胞凋亡等[23,24],尚待深入研究。研究发现,TIGIT作为免疫抑制靶点在免疫细胞表面异常高表达,且与CD155结合传递抑制肿瘤凋亡、促进肿瘤转移的负性调控作用[25]。Zhang等人研究报道,T、NK等免疫细胞表面TIGIT抑制性受体呈高表达状态,且TIGIT阻断可以增强抗肿瘤免疫应答,这可以作为现有免疫疗法的潜在补充。然而,TIGIT阻断促进肿瘤清除的作用机制仍未完全阐明,这提示ART能否直接作用于肿瘤细胞表面的TIGIT进而发挥抗肿瘤作用[26]。因此,靶向阻断TIGIT与CD155结合可能实现调控肿瘤细胞转移及凋亡的目标,能为恶性肿瘤的临床治疗提供新手段。
本研究旨在探讨ART对4T1乳腺癌细胞转移及凋亡的调控作用及分子机制。本文的研究结果显示,中、高浓度的ART对4T1乳腺癌细胞的增殖具有显著和极显著的抑制作用,而且这种作用呈现出ART浓度和处理时长依赖性,这与文献研究的结果[27]趋势一致。本文从能否抑制4T1细胞转移的角度考察了ART的抗肿瘤作用,发现ART可以显著抑制细胞迁移、侵袭以及集落形成,细胞水平上对这些生物学效应的研究一方面使我们进一步确认,ART作为治疗4T1恶性肿瘤转移的潜在价值,另一方面也为体内成瘤的动物实验提供数据支持。本研究就细胞凋亡的指标所作检测也表明,ART对4T1乳腺癌细胞的凋亡促进作用显著,且同样具有浓度依赖的特征。本文进一步利用生物信息学筛选出了ART作用靶点TIGIT/CD155轴,qPCR、WB以及流式结果均提示,ART对Tigit的表达水平具有浓度依赖的显著下调作用,亦可显著下调CD155的mRNA表达水平。
综上所述,ART体外调控4T1乳腺癌细胞转移及凋亡,其作用机制可能与TIGIT/CD155信号轴有关。研究结果为ART应用于乳腺癌转移的治疗策略提供一定的参考,对开发新的高效、特异和无毒的抗肿瘤药物具有借鉴意义。鉴于ART对乳腺癌转移和凋亡能力的影响,后续还会对其抑制肿瘤转移及促进肿瘤细胞凋亡的作用机制层面,以及TIGIT/CD155信号轴展开进一步的深入探究,进而揭示ART的具体作用机制,如Fig.9所示。
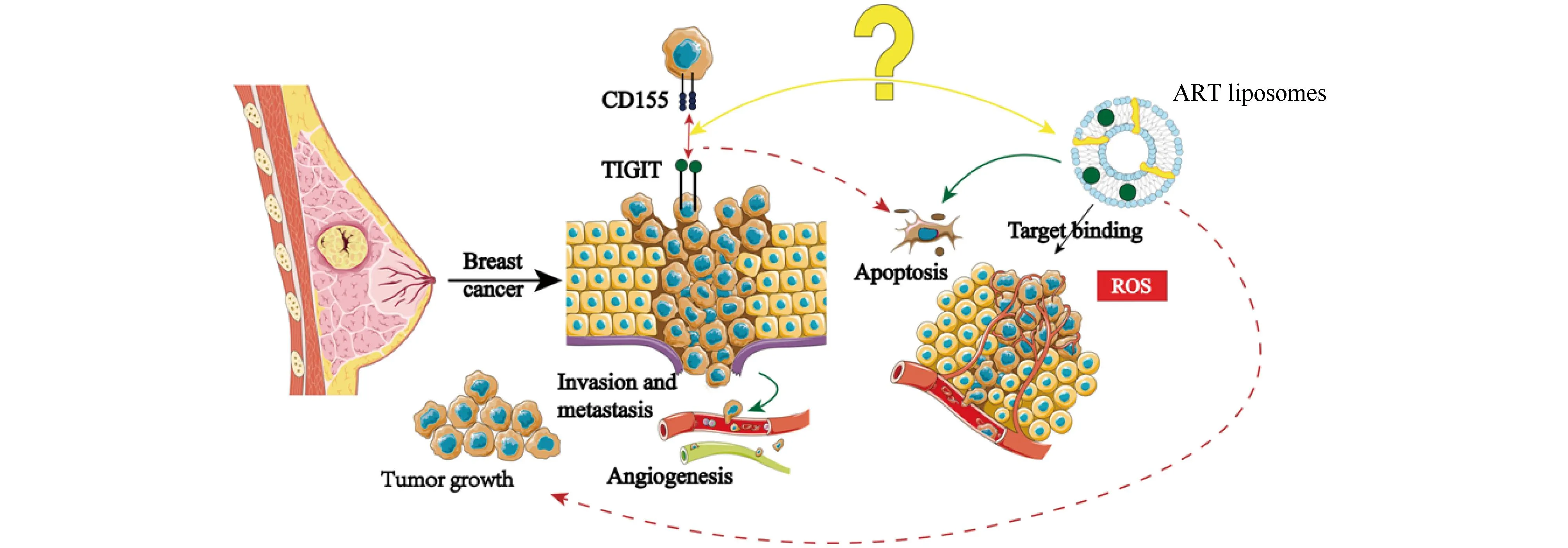
Fig.9 Potential mechanism of action of ART in suppressing breast cancer TIGIT and CD155 are widely expressed in tumors and closely related to metastasis. Therefore, TIGIT can be used as a potential molecular target or prognostic marker for the treatment of breast cancer. In recent years, the anti-tumor effect of ART has become more prominent, and our study has confirmed that ART can inhibit the invasion and metastasis of 4T1 cells. However, the interaction between artemisinin nanoparticles and immune checkpoint TIGIT is not clear. Therefore, we propose possible antitumor mechanism that ART can block the TIGIT-CD155 signal axis to inhibit breast cancer metastasis
——青蒿素

