超声波辅助紫米花青素提取及抗氧化活性研究
宋雪耐,王 燕,吴卫国
(湖南农业大学食品科学技术学院,湖南长沙 410125)
花青素是世界上被广泛使用的水溶性天然植物色素,存在于植物的不同部位,是植物表现出不同色彩的因素[1]。花青素属于类黄酮类酚类化合物[2],其结构是特征性极强的碳骨架结构C6-C3-C6[3-4]。目前,花青素提取方法主要有水溶性提取、超声临界萃取、微波辅助提取、超高压提取、超声波辅助提取[4-8]。超声波辅助技术是利用超声频率增加植物的水合作用促使该植物细胞壁孔的扩大,引起细胞壁破裂,同时物质分子运动速度和频率通过超声频率被升高,使溶剂穿透力增强,从而提高目标成分进入溶剂的速率,使提取时间缩短[9-11]。有研究表明,花青素具有抗氧化[12-13]、抗菌、降血糖等作用[14-15]。Callcott Esther T 等人[16-17]研究表明,食用紫米可以提高机体抗氧化能力。
紫米是一个稀有水稻品种,因为其米粒很细,种皮为紫色,因此被叫作紫米。紫米含有大量的蛋白质、赖氨酸、核黄素等营养物质,与普通大米相比,紫米中的花青素含量丰富[18]。贺江等人[19]检测出市售紫米中含有6 种花青素。赵珊等人[20]通过超高效液相色谱法对紫米中含有花青素进行含量测定。目前,国内外学者对于黑米[21]、黑玉米[22]等谷物中存在的花青素开展了大量研究,而对于紫米中花青素的提取及抗氧化活性研究报道较少。
因此,以紫米为原料,利用超声波辅助法进行紫米花青素提取,研究6 个单因素对花青素含量的影响,在此基础上利用PB 试验和爬坡试验及响应面优化超声波确定提取紫米花青素的最佳工艺;通过对DPPH 自由基、ABTS+自由基及羟基自由基的清除能力研究紫米花青素的抗氧化活性,为后续从紫米中提取花青素生产产品和紫米花青素纯化及结构鉴定分析提供理论基础。
1 材料与方法
1.1 材料与试剂
紫米,购自湖南常德桃园县;无水乙醇、无水乙酸钠、盐酸、氯化钾,均为分析纯,国药集团化学有限公司提供。
1.2 仪器与设备
DHG-9240A 型电热恒温鼓风干燥箱,上海飞越实验仪器有限公司产品;KM-600DV 型超声波清洗机,昆山美美超声仪器有限公司产品;PHS-3E 型pH计,上海仪电科学仪器股份有限公司产品;LD5-2A 型离心机,上海珂淮仪器有限公司产品;2500Y 型多功能粉碎机,永康市铂欧五金制品有限公司产品。
1.3 试验方法
1.3.1 紫米粉末的制备
将紫米通过粉碎机粉碎,过60 目筛,存放于4 ℃的冰箱中。
1.3.2 紫米花青素提取
精确称取2.000 g 紫米粉于棕色锥形瓶中,根据料液比加入酸性乙醇充分混合、摇匀,在一定温度下,采用超声辅助法提取花青素,提取完成后以转速5 000 r/min 离心15 min,取上层清液。
1.3.3 缓冲溶液的制备
(1)pH 值1.0 的缓冲溶液。称取1.86 g 氯化钾,用超纯水溶解,在氯化钾完全溶解后,用pH 计测定其pH 值,用HCl 溶液调至pH 值为1.00±0.05。
(2)pH 值4.5 的缓冲溶液。称取54.43 g 醋酸钠,用超纯水溶解,在醋酸钠完全溶解后,用pH 计测定其pH 值,用HCl 溶液调至pH 值为4.50±0.05[23]。
1.3.4 最大吸收波长的确定
分别吸取2 mL 紫米花青素上清液置于10 mL 棕色容量瓶中,其中一个棕色容量瓶中用pH 值1.0 缓冲溶液稀释5 倍;另一个棕色容量瓶中用pH 值4.5缓冲液稀释5 倍,摇匀,静置80 min 后,于波长400~800 nm 处使用紫外-可见分光光度计对该样品进行扫描[24],确定其紫米花青素的最大吸收波长。
1.3.5 紫米花青素含量的测定
采用pH 示差法[25]进行紫米花青素含量测定,吸取1 mL 紫米花青素上清液置于10 mL 棕色容量瓶中,然后向棕色容量瓶中分别加入9 mL pH 值1.0 缓冲液和pH 值4.5 缓冲液,摇匀,平衡静置80 min[26],空白对照选择超纯水,上清液与缓冲液平衡完成后,于最大波长和波长700 nm 下测定吸光度,计算出花青素含量,每个样品做3 次重复试验。紫米花青素含量按以下公式计算。
式中:A——(AmaxpH 值1.0-A700nmpH 值1.0)-(AmaxpH 值4.5-A700nmpH 值4.5);
V——提取液总体积,mL;
DF——稀释倍数;
M——相对分子质量,为449.2 g/mol;
ε——消光系数,为26 900 L/(mol·cm);
m——紫米粉的质量,g。
1.3.6 超声波辅助法提取紫米花青素单因素试验
(1)乙醇体积分数对花青素提取量的影响。按照1.3.2 的提取方法,以1∶10 的料液比,加入pH 值为2 的提取剂,用超声功率300 W 的超声波于40 ℃条件下超声提取30 min,以确定不同乙醇体积分数(50%,60%,70%,80%,90%)对紫米花青素提取量的影响。
(2)超声温度对花青素提取量的影响。选用最优的乙醇体积分数,按照1.3.2 的提取方法,根据1∶10 的料液比,加入pH 值为2,体积分数为70%的乙醇溶液,用超声功率300 W的超声波提取30 min,以确定不同超声温度(20,30,40,50 ℃)对紫米花青素提取量的影响。
(3)pH 值对花青素提取量的影响。选用最优的乙醇体积分数、超声温度,按照1.3.2 的提取方法,以1∶10 的料液比,加入体积分数为70%的乙醇溶液,用超声功率300 W 于40 ℃条件下提取30 min,以确定不同pH 值(1,2,3,4,5)对紫米花青素提取量的影响。
(4)超声时间对花青素提取量的影响。选用最优的乙醇体积分数、超声温度、pH 值,按照1.3.2的提取方法,以1∶10 的料液比,加入pH 值为2,体积分数为70%的乙醇溶液,用超声功率300 W 于40 ℃条件下提取,以确定不同超声时间(10,20,30,40,50 min)对紫米花青素提取量的影响。
(5)超声功率对花青素提取量的影响。选用最优的乙醇体积分数、超声温度、pH 值、超声时间,按照1.3.2 的提取方法,以1∶10 的料液比,加入pH值为2,体积分数为70%的乙醇溶液,于40 ℃条件下超声提取20 min,以确定不同超声功率(180,240,300,360,420 W)对紫米花青素提取量的影响。
(6)料液比对花青素提取量的影响。选用最优的乙醇体积分数、超声温度、pH 值、超声时间、超声功率,按照1.3.2 的提取方法,根据料液比加入pH 值为2,体积分数为70%的乙醇溶液,用超声功率300 W 于40 ℃下超声提取20 min,以确定不同料液比(1∶5,1∶10,1∶15,1∶20,1∶25(g∶mL))对紫米花青素提取量的影响。
1.3.7 Plackett-Burman(PB)试验设计
PB 试验是指使用较少的试验次数,在多个因素中迅速地找出对试验样品有明显影响的因素[27]。根据上述试验结果选择出各因素的最佳区间进行PB 试验,试验以花青素含量作为评价指标。
PB 试验因素与水平设计见表1。

表1 PB 试验因素与水平设计
1.3.8 最陡爬坡试验
由上述PB 试验获得试验结果,选取影响因素显著的3 个因素进行最陡爬坡试验,通过最陡爬坡试验结果可知最佳条件区间,同时把最佳区间作为响应面中心点[29]。
1.3.9 响应面试验设计
根据PB 试验结果分析可知,对紫米花青素提取量最显著的3 个因素分别是乙醇体积分数(A)、超声时间(C)、超声功率(E);根据最陡爬坡试验结果可得出响应面的中心点,进而在此基础上设计响应面试验[29]。
响应面试验水平与因素见表2。

表2 响应面试验水平与因素
1.4 紫米花青素抗氧化活性
1.4.1 清除DPPH·能力的测定
参照周理红[30]的方法,稍作修改。分别取不同质量浓度样品溶液2.0~5.0 mL 的离心管,加入70 μmol/L DPPH 工作液2.0 mL,剧烈摇动后,避光反应30 mim,以维C 为对照。以乙醇溶液调零,于波长517 nm 处测定吸光度。每组试验重复3 次。
式中:A
0——空白对照的吸光度;
A1——样品组的吸光度;
A2——本底的吸光度。
1.4.2 ABTS+自由基测定
参考Huang Wu-yang 等人[31]的方法并加以修改。分别取不同浓度样品溶液0.3~5.0 mL 的离心管,加入7 mmoL/L ABTS 工作液2.70 mL,剧烈摇动后,避光反应10 mim,以维C 为对照。以乙醇溶液调零,于波长734 nm 处测定吸光度。每组试验重复3 次。
式中:A0——空白对照的吸光度;
A1——样品组的吸光度;
A2——本底的吸光度。
1.4.3 羟基自由基的测定
采用水杨酸法,分别取不同质量浓度样品溶液1.0~10.0 mL 的离心管中,依次加入浓度为0.9 mmol/L的FESO 溶液1.0 mL、9 mmol/L 的水杨酸溶液、8.8 mmol/L H2O2溶液,剧烈摇匀后,避光反应10 min,以维C 为对照。以乙醇调零,于波长510 nm 处测定吸光度。每组试验重复3 次。
式中:A0——空白对照的吸光度;
A1——样品组的吸光度;
A2——本底的吸光度。
1.5 数据处理
采用Excel 2019,SPSS 26.0,Origin 2021,Design Expert 10 完成。
2 结果与分析
2.1 最大吸收波长的确定
紫米花青素紫外-可见吸收光谱图见图1。
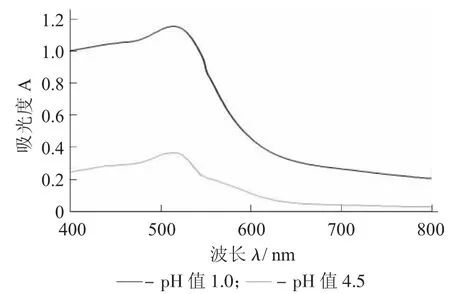
图1 紫米花青素紫外-可见吸收光谱图
由图1 可知,紫米花青素在pH 值1.0 缓冲溶液下的吸光度和在pH 值4.5 缓冲溶液下的吸光度最大差值是在波长515 nm处。因此,最大吸收波长为515 nm。
2.2 单因素试验结果分析
2.2.1 乙醇体积分数对花青素提取量的影响
乙醇体积分数对花青素提取量的影响见图2。

图2 乙醇体积分数对花青素提取量的影响
由图2 可知,紫米花青素提取量在乙醇体积分数小于70%时,随着乙醇体积分数的增大而增大,当乙醇体积分数为50%~70%时,提取剂的渗透能力会随着乙醇体积分数的升高而增强,有助于花青素可溶性成分溶解。然而,当乙醇体积分数大于70%时,由于花青素在较低的极性条件下很难溶出。所以,随着乙醇体积分数的增加,提取量降低。由此可见,当乙醇体积分数为70%时,花青素提取量达到最大值28.393 mg/100 g。因此,确定最佳体积分数为70%。
2.2.2 超声温度对花青素提取量的影响
超声温度对花青素提取量的影响见图3。
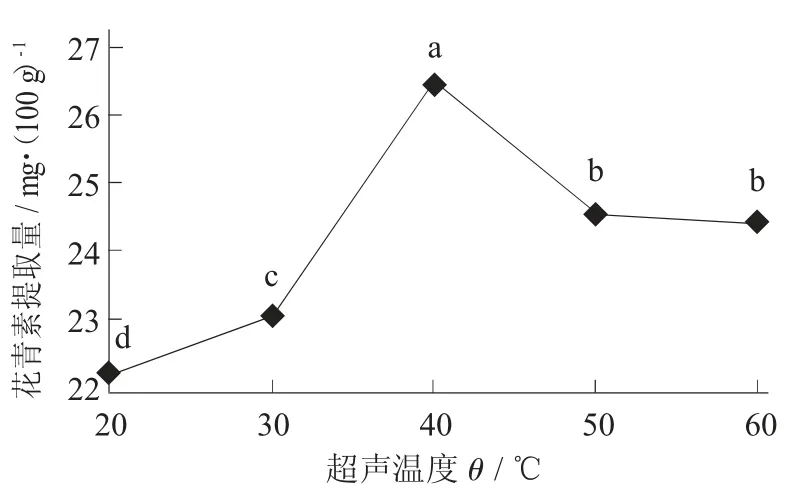
图3 超声温度对花青素提取量的影响
由图3 可知,随着超声温度的升高,紫米花青素提取量先上升然后降低,在40 ℃时达到最大值26.523 mg/100 g。随着超声温度升高,花青素的溶解度和扩散系数也会增加,因此花青素的提取量上升;由于花青素在高温的情况下容易发生氧化反应,使花青素的提取量降低。因此,选择40 ℃作为最佳超声温度。
2.2.3 pH 值对花青素提取量的影响
pH 值对花青素提取量的影响见图4。
由图4 可知,随着pH 值的增加,花青素含量先上升后下降,在pH 值为2 时,含量达到最高点25.382 mg/100 g。花青素很不稳定,在pH 值过高或过低的条件下都容易降低其稳定性,从而影响花青素的提取量[32]。因此,选择pH 值2 为最佳提取条件。
2.2.4 超声时间对花青素提取量的影响
超声时间对花青素提取量的影响见图5。
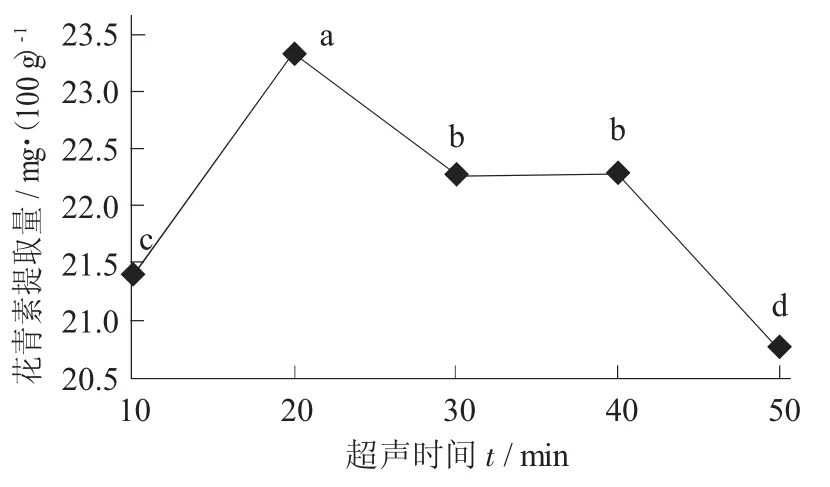
图5 超声时间对花青素提取量的影响
由图5 可知,花青素含量随超声时间延长先上升后下降,在20 min 时达到最大值23.351 mg/100 g。刚提取时花青素基本都存在于紫米中,而提取剂中基本不存在花青素,从而加速花青素溶出。花青素性质不稳定、容易氧化,随着超声时间的延长,提取出来的花青素会因接触空气导致氧化,从而降低花青素含量。因此,选择20 min 为最佳超声时间。
2.2.5 超声功率对花青素提取量的影响
超声功率对紫米花青素影响见图6。
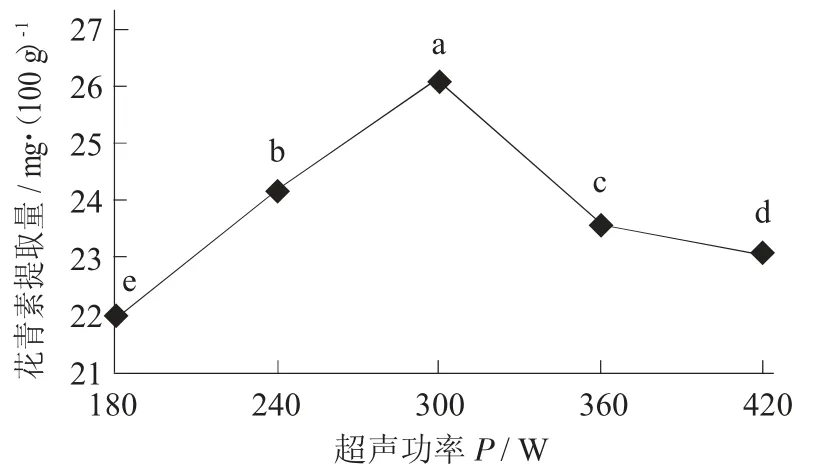
图6 超声功率对紫米花青素影响
由图6 可知,随着超声功率的增大,花青素含量先升高后降低,超声功率为300 W 时,达到最大值26.106 mg/100 g。超声功率越大,越能提高传质效率,使花青素提取量升高,但是达到一定值后,如果再增加超声功率,则会破坏花青素的结构,使花青素的提取量下降。因此,选择超声功率300 W为最佳提取条件。
2.2.6 料液比对花青素提取量的影响
料液比对花青素提取量的影响见图7。

图7 料液比对花青素提取量的影响
由图7 可知,随着料液比的增大,花青素提取量先升高后降低,在料液比为1∶10 时,达到最大值26.434 mg/100 g。在料液比过小时,提取剂和紫米粉不能充分接触,细胞内外浓度差过低,从而影响溶液传质推动力,造成花青素提取量较低;随着料液比增加,提取剂与紫米粉接触面增加,有利于花青素溶出,使花青素提取量增加。因此,选择料液比1∶10 为最佳提取条件。
2.3 PB 试验及结果
在单因素试验后,采用PB 试验考查各个因素对紫米花青素影响显著性,从而筛选出3 个影响最大因素进行进一步优化。
PB 试验设计与结果见表3,PB 试验设计效应分析见表4。
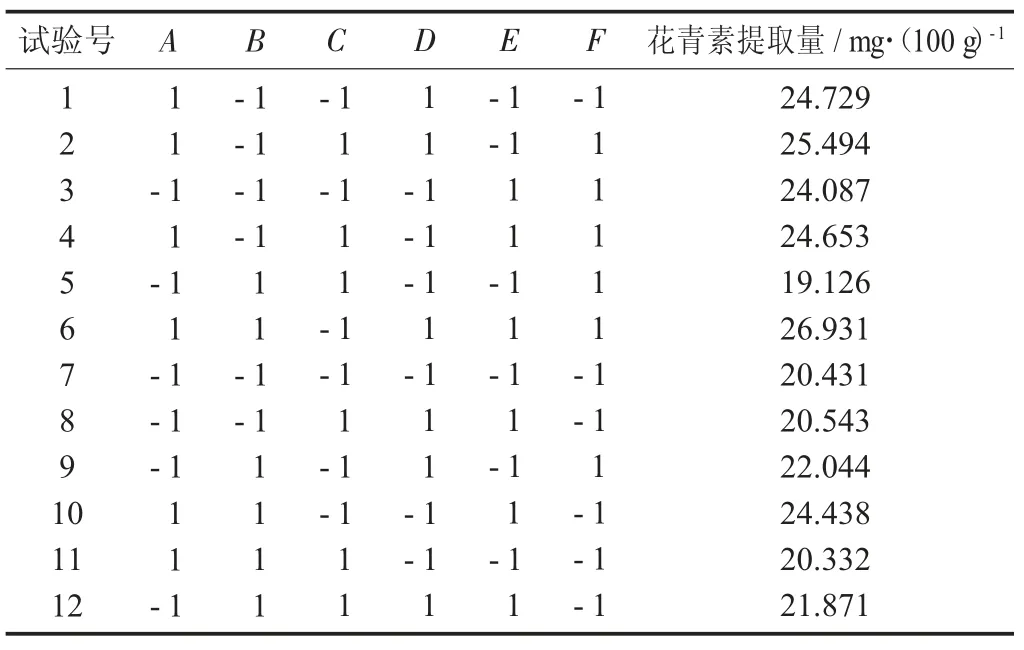
表3 PB 试验设计与结果

表4 PB 试验设计效应分析
由表4 可知,该模型的p 值是0.016 2<0.050 0,为显著水平,说明该模型具有统计学意义。由试验中各个因素的p 值可看出,以上6 个因素对紫米花青素提取量影响大小依次为乙醇体积分数、超声时间、超声功率、料液比、pH 值、超声温度。根据参数估计可知,乙醇体积分数、pH 值、料液比和超声功率对紫米花青素提取量为正向影响;超声温度和超声时间为负向影响。响应面试验设计至少需要3 个因素[34],又根据6 个因素影响大小结果分析,最后选择乙醇体积分数、超声功率和超声时间为试验条件进行最陡爬坡试验。
2.4 最陡爬坡试验结果
由PB 试验可看出,乙醇体积分数和超声功率对紫米花青素的提取量是正向影响,而超声时间属于负向影响。因此,增大乙醇体积分数和超声功率,降低超声时间,有助于提高花青素的提取量,爬坡方向和合理的步长根据以上3 个因素的正负效应来确定,从而迅速地得出最优的提取区域。
最陡爬坡试验与结果见表5。

表5 最陡爬坡试验与结果
由表5 可知,第2 个试验组的花青素提取量是最高的,因此将试验组2 进行响应面的中心试验。
2.5 响应面试验结果
Box-behnken 试验设计及结果见表6,响应面方差分析见表7。
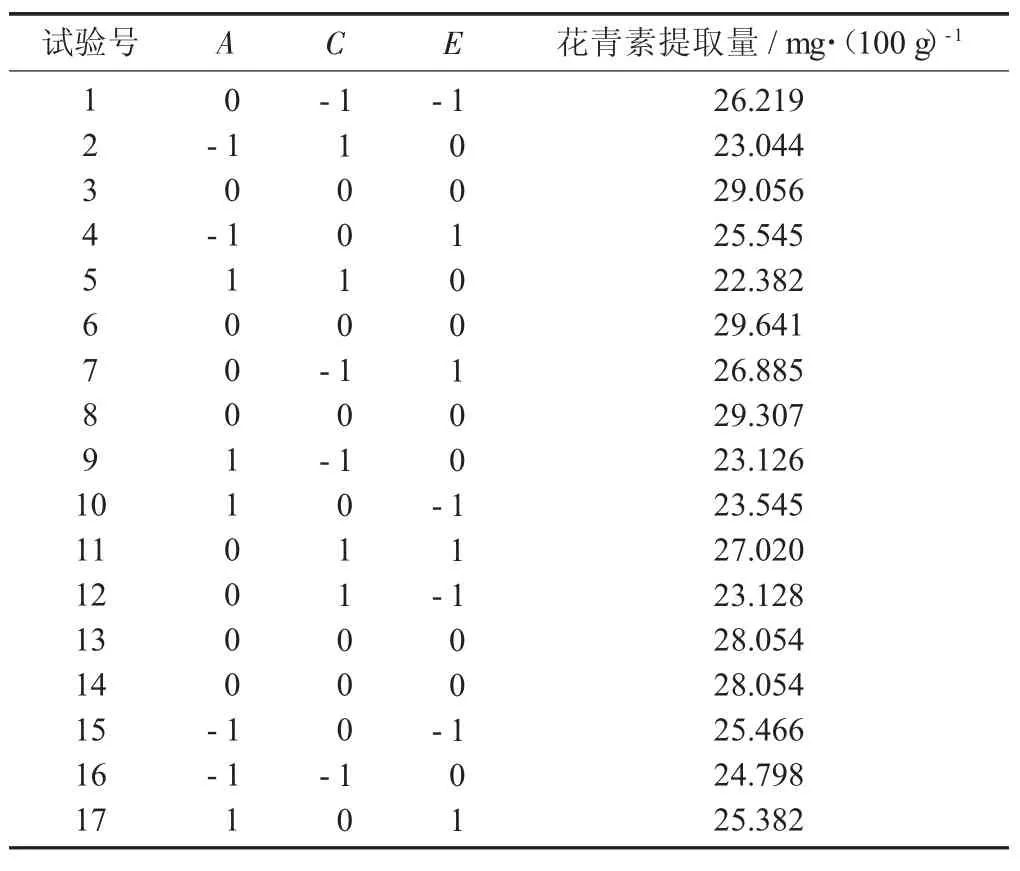
表6 Box-behnken 试验设计及结果

表7 响应面方差分析
通过数据分析获得相关方程为:
由表7 可知,模型p 为0.000 2<0.010 0,为显著水平;失拟项p 为0.666 7>0.050 0,失拟项为不显著水平。其中,R2为0.966 3,表明该模型具有较好的拟合效果;R2adj=0.923 0,表明所建立的模型对紫米花青素含量的测定结果有较好的解释能力。
2.6 响应面交互作用分析及优化
利用Design Expert 软件对试验数据进行统计分析,绘制各因素交互作用影响紫米花青素提取量高低的响应面3D 谱图和等高线图,从而进一步对不同变量之间的相互作用进行探究,并确定花青素提取最佳工艺[34]。各个因素和2 个因素之间对花青素提取量的高低可通过响应面3D 谱图和等高线图反映出来[35]。响应面3D 谱图颜色越深、坡度越高、倾斜角度越大,说明2 个因素间交互作用越明显[36-37]。如果2 个因素有明显的交互作用,其等高线图呈椭圆形,如果这2 个因素之间没有交互作用,其形状呈圆形[38]。
乙醇体积分数与超声时间相互作用对花青素提取量的影响见图8,超声时间与超声功率相互作用对紫米花青素提取量的影响见图9,超声功率与乙醇体积分数相互作用对紫米花青素提取量的影响见图10。
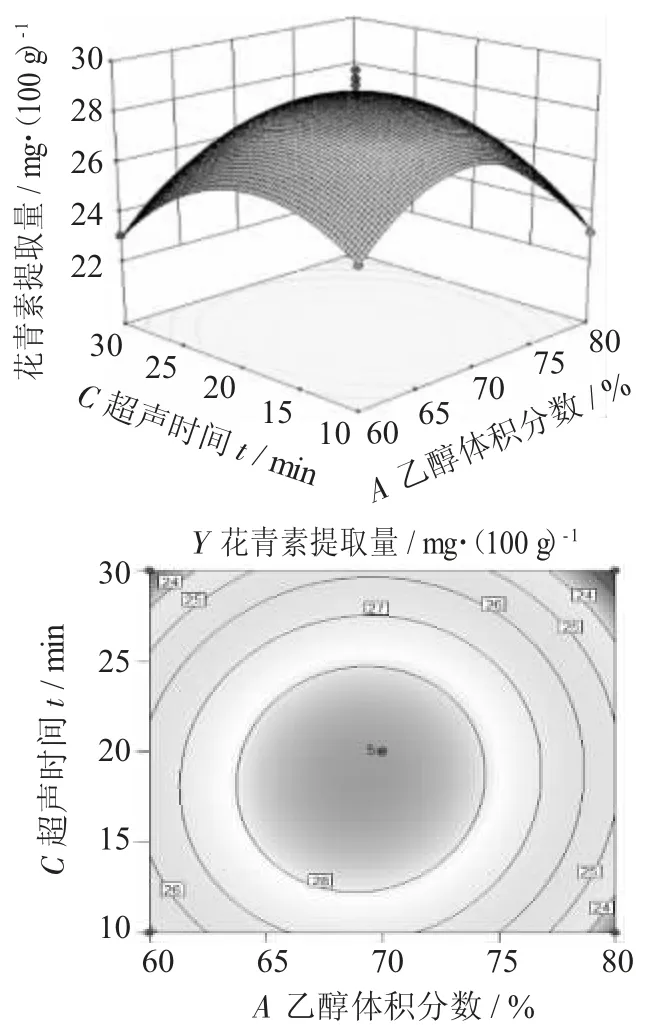
图8 乙醇体积分数与超声时间相互作用对花青素提取量的影响

图10 超声功率与乙醇体积分数相互作用对紫米花青素提取量的影响
由图8 可知,乙醇体积分数和超声时间2 个因素之间的等高线是圆形,说明这2 个因素明显没有交互作用;超声时间和乙醇体积分数的三维响应图坡度较陡,说明超声时间和乙醇体积分数对紫米花青素含量影响较大。保持超声时间不变,随着乙醇体积分数的增加,紫米花青素提取量也随之增大,达到峰值后逐渐降低。保持乙醇体积分数不变,随着超声时间增大,花青素提取量快速增加到最大值后逐渐下降。
由图9 可知,超声时间和超声功率2 个因素的等高线是椭圆形,表明这2 个因素存在明显交互作用。超声功率的三维响应图坡度较平缓,说明超声功率对紫米花青素含量影响较小,超声时间的三维响应图坡度较陡,说明超声时间对紫米花青素含量影响较大。保持超声时间不变,随着超声功率的增大,花青素提取量也缓慢升高达到最高点后逐渐下降;保持超声功率不变,随着超声时间延长,花青素含量先快速增加后逐渐下降。
由图10 可知,超声功率与乙醇体积分数2 个因素的等高线为近椭圆形,说明这2 个因素交互作用不明显;超声功率的三维响应图坡度较平缓,说明超声功率对紫米花青素含量影响较小,乙醇体积分数的三维相应图坡度较陡,说明乙醇体积分数对紫米花青素含量影响较大。超声功率保持不变,随着乙醇体积增大,紫米花青素含量先升高后降低;同理,乙醇体积保持不变,随着超声功率的增加,花青素含量先升高后降低。
通过Design Expert 软件设计模型分析可知,紫米花青素提取含量最优工艺参数为乙醇体积分数69.486%,超声时间19.451 min,超声功率332.748 W,花青素含量为29.076 mg/100 g。为了更加准确地验证模型的可靠性,从试验的实际性出发,调整了提取工艺参数,使其提取剂为体积分数为70%的乙醇溶液,超声时间19 min,超声功率330 W。在此条件下,进行验证并与传统水提法进行对比,试验重复3 次,得出紫米花青素的提取量为29.045 mg/100 g,该值与响应面得出的预测值29.076 mg/100 g 相近。由此表明,该模型对于紫米花青素工艺提取优化来说具有一定的参考价值。
2.7 紫米花青素抗氧化活性
紫米花青素抗氧化活性及IC50评价结果见图11。

图11 紫米花青素抗氧化活性及IC50 评价结果
紫米提取物中对DPPH、ABTS+及羟基自由基清除率都随着质量浓度的增加而升高,与维C 变化趋势相同。其中,当紫米花青素质量浓度为0.45 mg/mL时,清除率都达到90%以上。通过计算可知,在相同条件下,DPPH 自由基的IC50为0.247 mg/mL,维C 的IC50为0.260 mg/mL;ABTS+自由基的IC50为0.245 mg/mL,维C的IC50为0.198 mg/mL;羟基自由基的IC50为0.188 mg/mL,维C 的IC50为0.224 mg/mL;通过IC50可看出,DPPH 自由基和羟基自由基的清除能力均大于维C 标准物,紫米提取花青素作为粗提物,已经展现出较强的抗氧化能力。
3 结论
紫米花青素是一种安全、无毒、保健和药理学价值极高的水溶性天然植物色素,在食品、医药、化妆品等市场应用前景广阔。以紫米为试验材料,进行单因素试验、PB 试验和最陡爬坡试验,最后采用响应面试验优化超声波辅助法来确定紫米花青素提取的最佳工艺和探究其抗氧化能力。结果表明,各因素影响大小依次为乙醇体积分数>超声时间>超声功率>pH 值>料液比>超声温度;最佳提取工艺为1∶10 的料液比,加入pH 值为2,体积分数为70%的乙醇,用超声功率330 W 的超声波在40 ℃下超声提取19 min。紫米花青素的实际提取量为29.045 mg/100 g。该值与响应面软件模型得出的理论值29.076 mg/100 g 相近,为之后紫米花青素的提取提供理论基础。抗氧化试验结果表明,在质量浓度为0.45 mg/mL 时,清除率都达到了90%以上,表明紫米花青素具有较强的抗氧化能力,可替代化学抗氧化剂作为一种天然紫色色素在食品添加剂行业开发利用。

