铁皮石斛叶发酵液对酒精性肝炎小鼠模型的影响及其作用机制
周兴念, 刘渝洪, 秦玉洁, 张 权, 程明亮, 李 宏
1 贵州医科大学附属医院感染科, 贵阳 550001
2 贵州医科大学临床医学院, 贵阳 550001
酒精性肝炎是常见的肝脏疾病之一,因长期大量饮酒导致,初期通常表现为肝脏中脂质蓄积并伴随持续的慢性肝损伤和炎症,进而可发展至酒精性脂肪性肝炎、肝纤维化和肝硬化,3%~10%可能进展为肝细胞癌[1],至今尚无较好的治疗药物与手段。细胞焦亡是一种促炎形式的程序性细胞死亡,包括由Caspase-1介导的经典焦亡通路和Caspase-11 介导的非经典焦亡通路,最终激活Gasdermin D 蛋白(GSDMD),使其裂解为22 kD C 端(GSDMD-C)和31 kD N 端(GSDMD-N)片段。被释放的GSDMD-N 端结构域会在细胞膜的表面聚集,形成孔道,引起膜完整性丧失、胞浆膨胀和细胞内容物的释放[2],导致细胞释放大量促炎性因子,如IL-6、IL-18、IL-1β 等,进而扩大机体强烈的炎症反应[3]。近年有研究[4]显示细胞焦亡与酒精性肝炎的发生发展密切相关,干预细胞焦亡可能是治疗酒精性肝炎的有效途径之一。
铁皮石斛属兰科石斛属多年附生草本植物,其活性成分包括多糖类、生物碱、黄酮类、芪类化合物等多种化学组分[5],具有抗炎、抗氧化、增强机体免疫力等作用[6-7]。铁皮石斛叶于2018 年6 月被纳入“地方特色食品管理”。研究[8]表明,铁皮石斛多糖可减少炎症因子的产生,从而减轻酒精所诱导的急性肝损伤,但铁皮石斛叶发酵液对酒精性肝炎的保护作用及机制尚未见报道。因此,本研究通过建立酒精性肝炎小鼠模型,探讨铁皮石斛叶发酵液对酒精性肝炎的干预作用及机制。
1 材料与方法
1.1 药物 铁皮石斛叶发酵液购自贵州同威生物科技有限公司(批号:18-220201);威门石斛水购自贵州同威生物科技有限公司(批号:20211009)。水飞蓟宾(Silybin)购自天津天士力圣特制药有限公司(批号:H20040299)。
1.2 动物 70只雄性C57BL/6J小鼠,SPF级,体质量20~25 g,6~8 周龄,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号与使用许可证号均为SYXK(黔)2023-0002。所有小鼠均饲养于贵州医科大学实验动物中心。
1.3 试剂 Lieber-DeCarli 酒精液体饲料购自南通特洛菲饲料科技有限公司;Trizol 试剂(美国Omega Bio-Tek,批号:R6834-01);SYBR Green Realtime PCR Premix 试剂(日本TaKaRa,批号:RR047A);R&D Systems 试剂盒(上海优宁维生物科技有限公司,批号:LXSAMSM-06);RIPA组织/细胞裂解液、BCA试剂盒、DAPI(北京索莱宝生物科技有限公司,批号:R0010、PC0020、C0085);ECL超敏发光试剂盒(大连美仑生物技术有限公司,批号:MA0186-1);NLRP3、Caspase-1、Caspase-11、GSDMD、IL-18、IL-1β 一抗(美国Abcam,批号:ab263899、ab138483、ab180673、ab219800、ab191860、ab283818);山羊抗兔IgG H&L(Alexa Fluor®647,批号:ab150079)。
1.4 仪器 实时荧光定量PCR(美国伯乐公司,型号:CFX96Toch);电泳仪(北京六一生物科技有限公司,型号:DYY-7C);电泳槽、转模仪(北京东方瑞利,型号:2037443753、1002808065);一体式化学发光成像(上海勤翔,型号:Chemiscope)。
1.5 Lieber-DeCarli模型制备与给药 70只雄性C57BL/6J小鼠采用随机数字法分为正常组(N组),模型组(M组),液体饲料对照组(CON组),水飞蓟宾组(SIL组)(0.250 mL/10 g),铁皮石斛叶发酵液低(DEN-L 组)(0.125 mL/10 g)、中(DEN-M组)(0.250 mL/10 g)、高(DEN-H组)(0.375 mL/10 g)剂量组,共7 组,每组10 只。正常组食用普通固体饲料,液体饲料对照组喂养液体对照饲料8 周,建立非酒精性肝炎模型;模型组、水飞蓟宾组及铁皮石斛叶发酵液低、中、高剂量组小鼠喂养酒精液体饲料8周,建立酒精性肝炎模型(表1)。造模期间,铁皮石斛叶发酵液低、中、高剂量组小鼠饮用威门石斛水,其余各组小鼠饮用纯净水;正常组、模型组、液体饲料对照组每日给予生理盐水灌胃,水飞蓟宾组给予水飞蓟宾0.25 mL/10 g,铁皮石斛叶发酵液低、中、高剂量组分别给予0.125 mL/10 g、0.250 mL/10 g、0.375 mL/10 g 铁皮石斛叶发酵液灌胃,1 次/d。第8 周末,各组小鼠腹腔注射水合氯醛(0.3 mL/100 g)麻醉,眼球取血,脱颈处死,取肝组织样本进行后续实验。

表1 Lieber-DeCarli液体饲料配方Table 1 Lieber-DeCarli liquid feed formula
1.6 肝组织病理学观察 在肝右叶同一位置留取组织,一部分置入4%中性甲醛缓冲液中固定,用于HE 病理检测;另一部分肝组织OCT 包埋制作冰冻切片油红O染色。
1.7 Luminex检测技术 取各组小鼠血清上清液50 μL,按照R&D Systems试剂盒说明书进行R&D Luminex磁珠实验,检测小鼠血清中IL-6、IL-1β、TNF-α及CCL2水平。
1.8 血清生化指标检测 各组小鼠眼球取血后,采用低温离心方法收集血清样本,利用全自动生化仪检测小鼠血清内AST、ALT水平。
1.9 实时荧光定量PCR 实验 Trizol 法裂解肝组织,提取总RNA并检测其浓度和纯度。按照逆转录试剂盒操作说明书对RNA进行逆转录,合成扩增前cDNA。以cDNA为模板,采用SYBR Green依次按照95 ℃、30 s,95 ℃、15 s,60 ℃、30 s,40 个循环反应条件下进行扩增。各检测指标引物信息见表2。结果分析方法为相对定量法,计算方法为2-△△CT。

表2 实时荧光定量PCR引物Table 2 Real-time quantitative PCR primers
1.10 Western Blot 实验 称取各组肝组织20 mg,经PBS缓冲液冲洗2 遍,RIPA 细胞裂解液冰上裂解,提取总蛋白。依照每孔40 μg将蛋白样品上样至SDS-PAGE内进行电泳。电泳完成后将PVDF膜铺于凝胶条带上,置于转膜槽中300 mA 恒流转膜2 h,5%脱脂奶粉中室温封闭2 h。将膜与小鼠NLRP3、Caspase-1、Caspase-11、GSDMD、IL-18、IL-1β抗体孵育,4 ℃过夜,TBST洗涤3次,每次10 min。二抗室温孵育2 h,TBST 洗涤3 次,每次10 min。ECL 化学发光试剂盒对蛋白条带进行曝光,使用Image J软件对蛋白条带灰度值进行分析,计算目标蛋白与内参蛋白灰度值比值作为该蛋白表达量。
1.11 免疫荧光实验 蜡片烘烤2 h,二甲苯洗涤2 次,每次20 min;无水乙醇10 min 1 次,95%乙醇10 min 1 次,85%乙醇10 min 1 次,75%乙醇10 min 1 次,ddH2O 5 min 1 次;Tris-EDTA 抗原修复;免疫组化笔画圈封闭60 min;一抗GSDMD 4 ℃过夜。PBS 洗涤3 次,每次5 min,荧光二抗避光室温孵育50 min,PBS 洗涤3 次,每次5 min;DAPI 染核,避光10 min,PBS 洗涤3 次,每次5 min;封片后显微镜下观察。
1.12 统计学方法 采用Graphpad 8.3.0 软件进行统计学分析。计量资料以±s表示,Levene 检验判断方差齐性,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 铁皮石斛叶发酵液对酒精性肝炎小鼠血清ALT、AST 的影响 与正常组相比,模型组ALT、AST 显著升高(P值均<0.001);与模型组相比,水飞蓟宾组和铁皮石斛叶发酵液高剂量组ALT 和AST 均明显下降(P值均<0.01)(图1)。
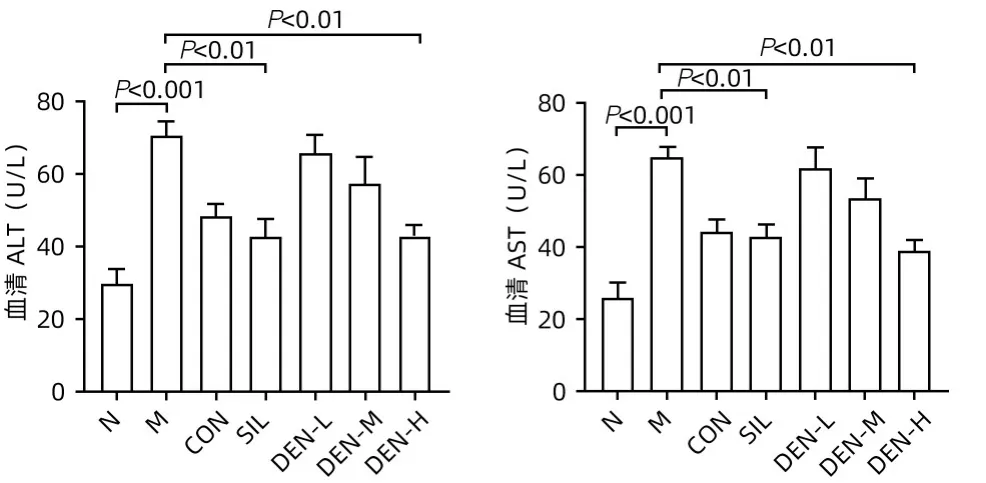
图1 各组小鼠血清AST、ALT的表达水平Figure 1 Expression levels of AST and ALT in serum of mice in each group
2.2 铁皮石斛叶发酵液对酒精性肝炎小鼠血清IL-6、IL-1β、TNF-α及CCL2的影响 与正常组比较,模型组小鼠血清IL-6、IL-1β、TNF-α 及CCL2 显著升高(P值均<0.01);与模型组比较,水飞蓟宾组和铁皮石斛叶发酵液高剂量组小鼠血清炎症因子水平降低,差异均有统计学意义(P值均<0.05)(图2)。

图2 各组小鼠血清IL-6、IL-1β、TNF-α及CCL2的表达水平Figure 2 Expression levels of IL-6, IL-1β, TNF-α and CCL2 in serum of mice in each group
2.3 铁皮石斛叶发酵液对酒精性肝炎小鼠肝脏病理组织学的影响 HE 染色结果显示,正常组小鼠肝细胞大小一致,排列整齐,肝小叶结构完整,未见病变;液体饲料对照组肝小叶结构清晰,肝窦正常,少量炎性细胞浸润;模型组和铁皮石斛叶发酵液低剂量组肝细胞气球样变性,肝索排列紊乱,大量中性粒细胞浸润及少量细胞坏死;铁皮石斛叶发酵液中剂量组肝小叶结构稍有破坏;水飞蓟宾组和铁皮石斛叶发酵液高剂量组小鼠肝组织结构损伤较轻,大部分肝小叶结构完整(图3)。
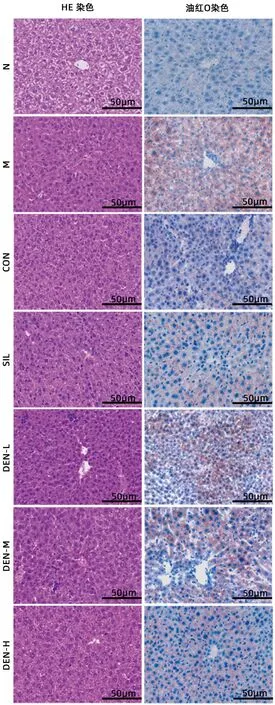
图3 各组小鼠肝组织油红O染色及HE染色(×200)Figure 3 Oil red staining and HE staining of liver tissues of mice in each group (×200)
油红O 染色结果显示,正常组肝细胞内几乎未见脂滴,无脂肪变性;液体饲料对照组可见少量散在脂滴;模型组和铁皮石斛叶发酵液低剂量组油红O 染色明显,大量脂滴聚集且相互融合;铁皮石斛叶发酵液中剂量组少量脂滴聚集;水飞蓟宾组和铁皮石斛叶发酵液高剂量组脂肪变性明显减轻,多以小脂滴散在存在(图3)。
2.4 铁皮石斛叶发酵液对酒精性肝炎小鼠肝组织中NLRP3、GSDMD、GSDMD-N、IL-18 和IL-1β 蛋白表达及IL-18 和IL-1β mRNA 水平的影响 Western Blot 结果显示,模型组小鼠肝组织中NLRP3、GSDMD、GSDMD-N、IL-18 和IL-1β 蛋白表达水平较正常组均显著升高(P值均<0.01);与模型组相比,水飞蓟宾组和铁皮石斛叶发酵液高剂量组NLRP3、GSDMD、GSDMD-N、IL-18 和IL-1β蛋白表达均明显降低(P值均<0.05)(图4)。实时荧光定量PCR 结果显示,与正常组相比,模型组肝组织IL-18和IL-1β mRNA表达水平均显著升高(P值均<0.01);铁皮石斛叶发酵液高剂量组肝组织IL-18 和IL-1β mRNA 表达水平明显低于模型组(P值均<0.01)(图5)。肝组织免疫荧光结果见图6、7,与正常组比较,模型组胞质中GSDMD 阳性染色面积比显著增加(P<0.001);铁皮石斛叶发酵液高剂量组细胞质中GSDMD 阳性染色程度较模型组明显减弱(P<0.001)。

图4 各组小鼠肝组织中NLRP3、GSDMD-FL、GSDMD-N、IL-18和IL-1β蛋白表达水平Figure 4 The expression levels of NLRP3, GSDMD-FL, GSDMD-N,IL-18 and IL-1β in liver tissue of mice in each group
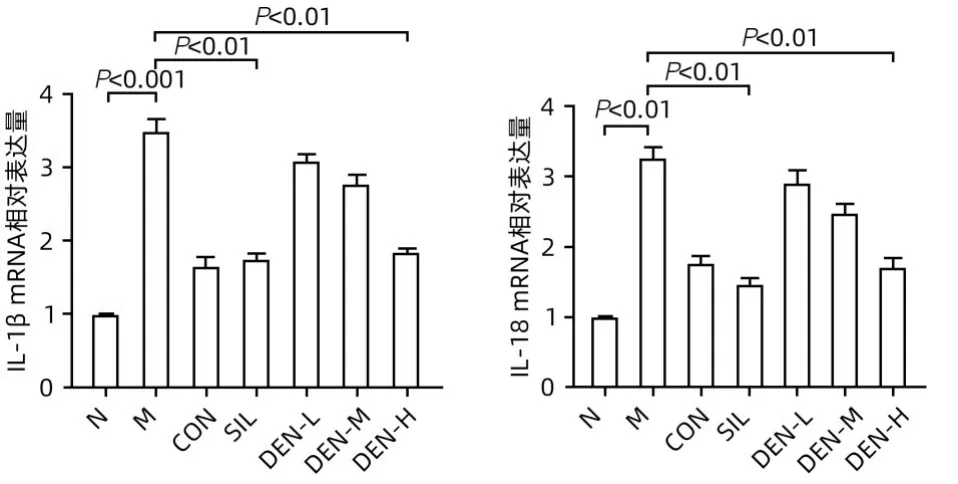
图5 各组小鼠肝组织中IL-18和IL-1β mRNA表达水平Figure 5 The mRNA expression levels of IL-18 and IL-1β in liver tissues of mice in each group

图6 各组小鼠肝组织中GSDMD的表达(免疫荧光染色,×100)Figure 6 Expression of GSDMD in liver tissues of mice in each group (immunofluorescence staining, ×100)
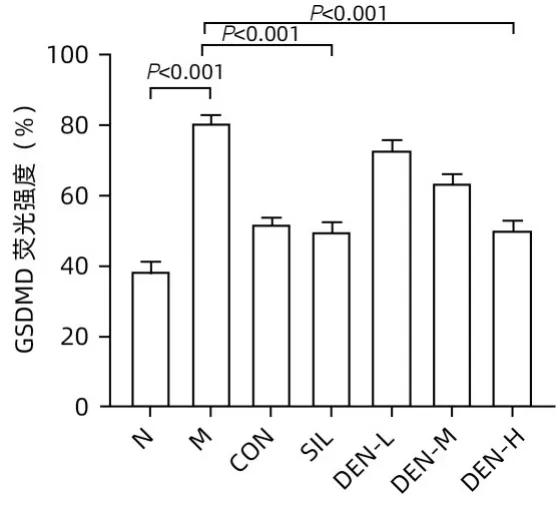
图7 各组小鼠肝组织中GSDMD的荧光强度比较Figure 7 Fluorescence intensity of GSDMD in liver tissue of mice in each group
2.5 铁皮石斛叶发酵液对酒精性肝炎小鼠肝组织中Caspase-1 和Caspase-11 表达的影响 与正常组相比,模型组肝组织中Caspase-1 和Caspase-11 蛋白表达水平均显著升高(P值均<0.05);与模型组相比,铁皮石斛叶发酵液高剂量组Caspase-1 和Caspase-11 蛋白表达水平均明显降低(P值均<0.05),其中Caspase-1 蛋白相对表达量为1.757,较模型组下降26.6%,而Caspase-11 蛋白相对表达量为0.455,较模型组下降70.3%;Caspase-11 较Caspase-1下降幅度更大(图8)。

图8 各组小鼠肝组织中Caspase-1和Caspase-11蛋白表达水平Figure 8 Expression levels of Caspase-1 and Caspase-11 proteins in liver tissues of mice in each group
3 讨论
酒精性肝炎是酒精(乙醇)相关性肝病的急性临床表现[9],全球超过50%的肝脏疾病负担与过度饮酒有关[10],严重危害人类健康。乙醇的毒性代谢物,特别是乙醛,会对肝细胞造成直接的氧化损伤,并通过形成蛋白质或DNA 加合物而造成间接损伤。线粒体功能障碍及脂质过氧化干扰碳水化合物和脂类代谢导致肝细胞脂肪变性。长期大量饮酒可造成肠道菌群失调、肠黏膜屏障受损及肠壁通透性的增加,大量的内毒素进入门静脉系统导致肠源性内毒素血症[11]。而内毒素血症是激活焦亡经典与非经典通路的最初信号。细胞焦亡是一种由Gesdermin 家族介导的促炎性程序性死亡方式。焦亡细胞中Gesdermin 家族蛋白被激活,使细胞质膜穿孔,细胞发生渗漏,释放炎症因子促进肝细胞死亡、脂肪变性、炎症及纤维化。细胞焦亡主要有依赖Caspase-1的经典通路与依赖Caspase-4/5/11 的非经典通路。酒精性肝炎时,肠道来源的脂多糖通过膜外泡内吞入巨噬细胞,其直接结合Caspase-4/5/11 激活GSDMD,破坏细胞膜的完整性,导致肝细胞裂解死亡并释放大量的IL-1β 等炎症介质[12]。Khanova等[13]发现Caspase-11(鼠)/4(人)、IL-18、IL-1β和CCL2等炎性细胞因子及炎性趋化因子的表达水平在酒精性肝炎中显著升高;当Caspase-11 缺陷时可以抑制GSDMD 蛋白的激活,减轻肝脏炎症反应。Heo 等[14]发现乙醇通过使TXNIP 过表达促进细胞焦亡,而miR-148a 可抑制TXNIP 表达以改善乙醇诱导的肝细胞NLRP3 炎症小体激活和细胞焦亡,减轻酒精性肝炎。通过调控焦亡通路中的炎症因子水平可能是未来酒精性肝炎治疗的靶点之一。
目前临床上应用的护肝药物种类繁多,但并无针对酒精性肝炎的特效药物。铁皮石斛是我国传统中药材,富含多糖、生物碱、氨基酸、酚类等多种药理学活性成分,具有抗肿瘤、抗炎、抗氧化以及解酒护肝等作用。石斛花提取物能降低酒精性肝损伤小鼠血清AST 和ALT水平,减轻肝细胞变性和脂滴积聚[15]。袁慧琦等[16]研究发现铁皮石斛通过上调Bcl-2 蛋白抑制肝细胞凋亡,减轻小鼠酒精性肝炎。铁皮石斛多糖可降低IL-1β、IL-6和TNF-α 等炎症因子的产生,从而减轻酒精所诱导的急性肝损伤[8]。但铁皮石斛叶发酵液对酒精性肝炎的干预效果及机制目前尚无相关研究报道。
本研究采用经典的Lieber-DeCarli 液体饲料饲养小鼠8周,成功建立酒精性肝炎模型。与模型组相比,铁皮石斛叶发酵液高剂量组小鼠肝组织HE 染色及油红O 染色显示小鼠肝细胞脂肪变性及气球样变范围减少,炎症细胞浸润减轻;肝组织焦亡相关蛋白NLRP3、Caspase-1、Caspase-11、GSDMD、GSDMD-N 及炎症因子IL-1β、IL-18表达均降低(P值均<0.05),其中介导非经典焦亡通路的Caspase-11蛋白表达下降幅度较Caspase-1更大。
综上,本研究表明铁皮石斛叶发酵液可减轻小鼠酒精性肝炎,其机制可能与抑制细胞焦亡通路,尤其是抑制Caspase-11 介导的非经典焦亡通路表达,从而减少TNF-α、IL-1β、IL-18 和CCL2 等炎性细胞因子、趋化因子的释放,减轻肝细胞炎症反应及脂肪变性有关。铁皮石斛叶发酵液可作为防治酒精性肝炎的安全有效药食同源的新方法。
伦理学声明:本研究方案于2021 年12 月24 日经由贵州医科大学实验动物伦理委员会审批,批号:SYXK(黔)2018-0001,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:周兴念负责课题设计,撰写文章;刘渝洪负责资料分析;秦玉洁、程明亮、张权参与修改论文;李宏负责拟定写作思路,指导撰写文章并最后定稿。

