基于TCGA数据库分析铁死亡代谢和lncRNA在结直肠癌中的表达及临床意义
潘 楠,唐桂艳,吕 楠,马太原
(吉林大学第一医院 结直肠肛门外科,吉林 长春130021)
结直肠癌是全世界范围内最为常见的消化道恶性肿瘤。近年来,结直肠癌发病率和死亡率均表现为逐年升高的趋势,严重威胁人类的身心健康,因为结直肠癌患者的早期临床症状较隐匿,多无明显症状,晚期则出现严重的症状,如贫血和体重减轻,多数患者自己察觉并至医院专业诊断时已至中晚期,到目前为止根治性的手术仍然是治疗结直肠癌的首选方案,但术后的高复发率、高转移率和低生存率等问题一直没有很好的解决,结直肠癌患者的预后仍然很差,因此寻找新的诊断和治疗方法是目前的首要任务[1-3]。2012年,Dixon等将由铁依赖脂质过氧化物累积导致细胞死亡方式命名为“铁死亡”[4]。铁死亡是程序性细胞死亡的形式之一,它不同于细胞凋亡、自噬,有其独特的形态学和生物代谢方面的变化,其特征在于铁依赖性的脂质过氧化物(LOS)积累使氧化还原反应平衡被破坏,最终导致细胞死亡[5]。已与研究发现铁死亡代谢与各种人类疾病和肿瘤发生均密切相关[6-7]。近年来发现核苷酸长度大于200nt的非编码RNA(LncRNA)与各种癌症相关的过程(例如增殖,侵袭,转移和代谢)都起着新作用,目前已发现多种LncRNA在不同肿瘤组织的表达具有显著差异性,在肿瘤发生发展过程中,LncRNA参与调控多种生物功能而发挥重要的作用,例如乳腺癌,消化道肿瘤,呼吸系统肿瘤和泌尿系统肿瘤[8-10]。为探索可靠的铁死亡代谢相关基因和lncRNA对于结直肠癌预后评估的意义,本研究下载分析TCGA数据库中结直肠癌患者的高通量测序数据和临床数据,分析铁死亡代谢和lncRNA在结直肠癌中的表达及临床意义,为结直肠癌患者新的诊断、治疗和预后提供新的建议。
1 材料与方法
1.1 数据下载与处理
通过TCGA数据(https://portal.gdc.cancer.gov/repository)下载结直肠癌患者mRNA表达谱数据和临床数据,该数据集包括 385例患者肿瘤组织和39例正常组织的的测序信息(表1),并利用R语言(R 3.6.3,https://www.r-project.org/)对数据进行提取和标准化处理。由于TCGA数据库是公开获取资源,因此本研究免于伦理委员会的批准。

表1 本研究使用的肝癌患者的基本特征
1.2 相关基因的提取与处理
以(cor>0.6和P<0.05)为筛选标准,检索获得与结直肠癌中铁死亡代谢相关的219个基因信息,检索获得了与结直肠癌相关的1346个lncRNA基因信息,筛选差异表达的基因(DEGs),DEGs的筛选通过GEO2R[11]在线工具识别,FDR(false discovery rate)表示错误发现率,它是通过p value进行校正得到的,是DEGs筛选的关键指标。logFC<0的DEGs被认为是下调基因,而logFC>0的DEGs被认为是上调基因,对筛选出的DEGs并进行GO[12]聚类分析(图1a)和KEGG[13]富集分析(图1b),初步判断DEGs的主要功能和参与的代谢途径。
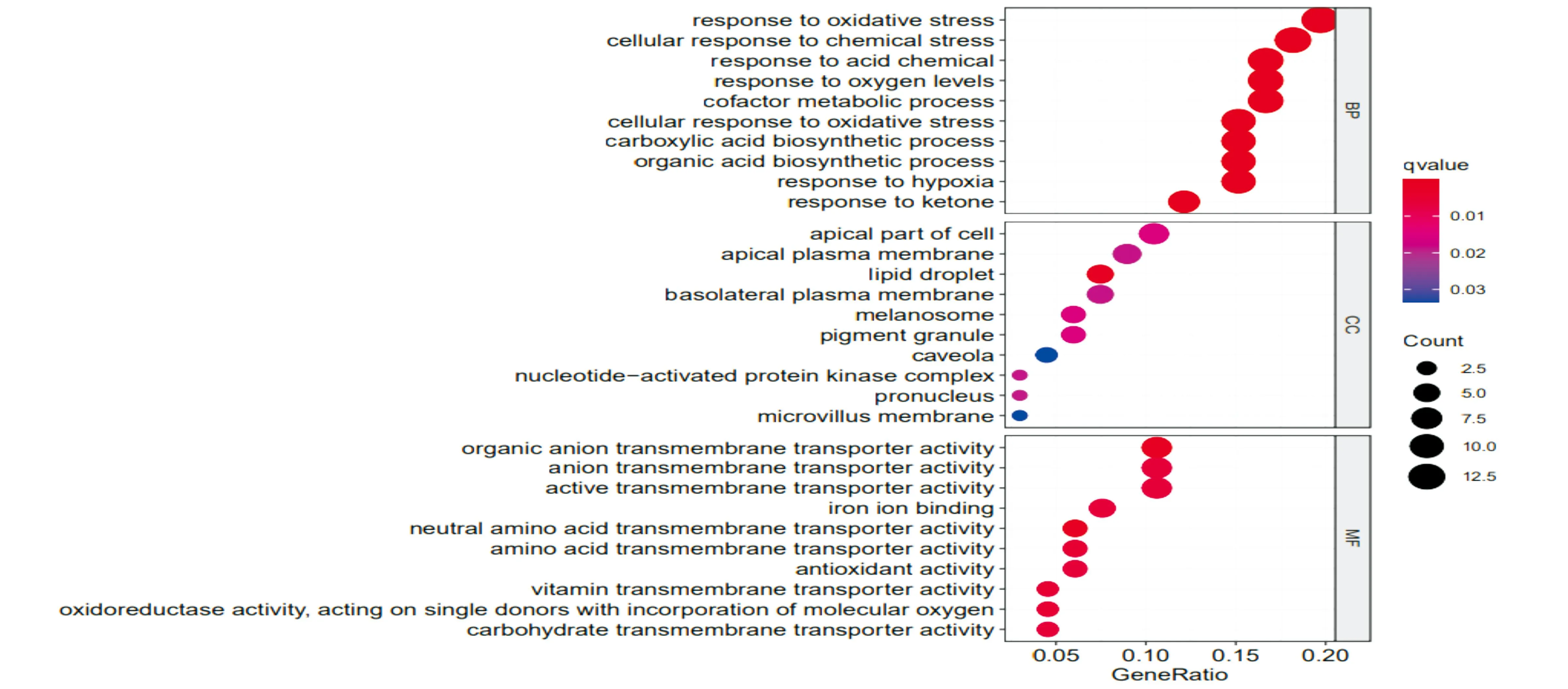
图1a 铁死亡代谢相关DEGs的GO分析
1.3 lncRNA预后风险评分模型构建
LASSO回归分析再次筛选基因。对筛选到的目标基因在正常和肿瘤组织中的差异进行表达量的分析,利用Kaplan-Meier(K-M)生存分析评估目标基因对生存率的影响。为了进一步分析目标基因与不同临床病理特征的关系,选取年龄、性别、病理分期等临床信息均采用单因素和多因素Cox回归对预后模型进行分析。使用GSEA中的Hallmarker探究目标基因可能作用的机制。
2 结果
2.1 结直肠癌关键lncRNA基因的确定
通过GEO2R在线工具识别筛选肝癌代谢相关差异表达的lncRNA,结果发现共有582个DEGs,其中上调表达的有531个DEGs,下调表达的有51个DEGs。进一步通过单因素Cox回归对筛选得到的肝癌代谢相关的差异表达的lncRNA基因进行分析(P<0.05),共筛选获得AC107308.1等36个lncRNA基因,图2对这36个差异表达的lncRNA基因进行单因素回归分析,其中AC104819.3和AL137782.1的风险数值均小于1,分别为0.154和0.497。
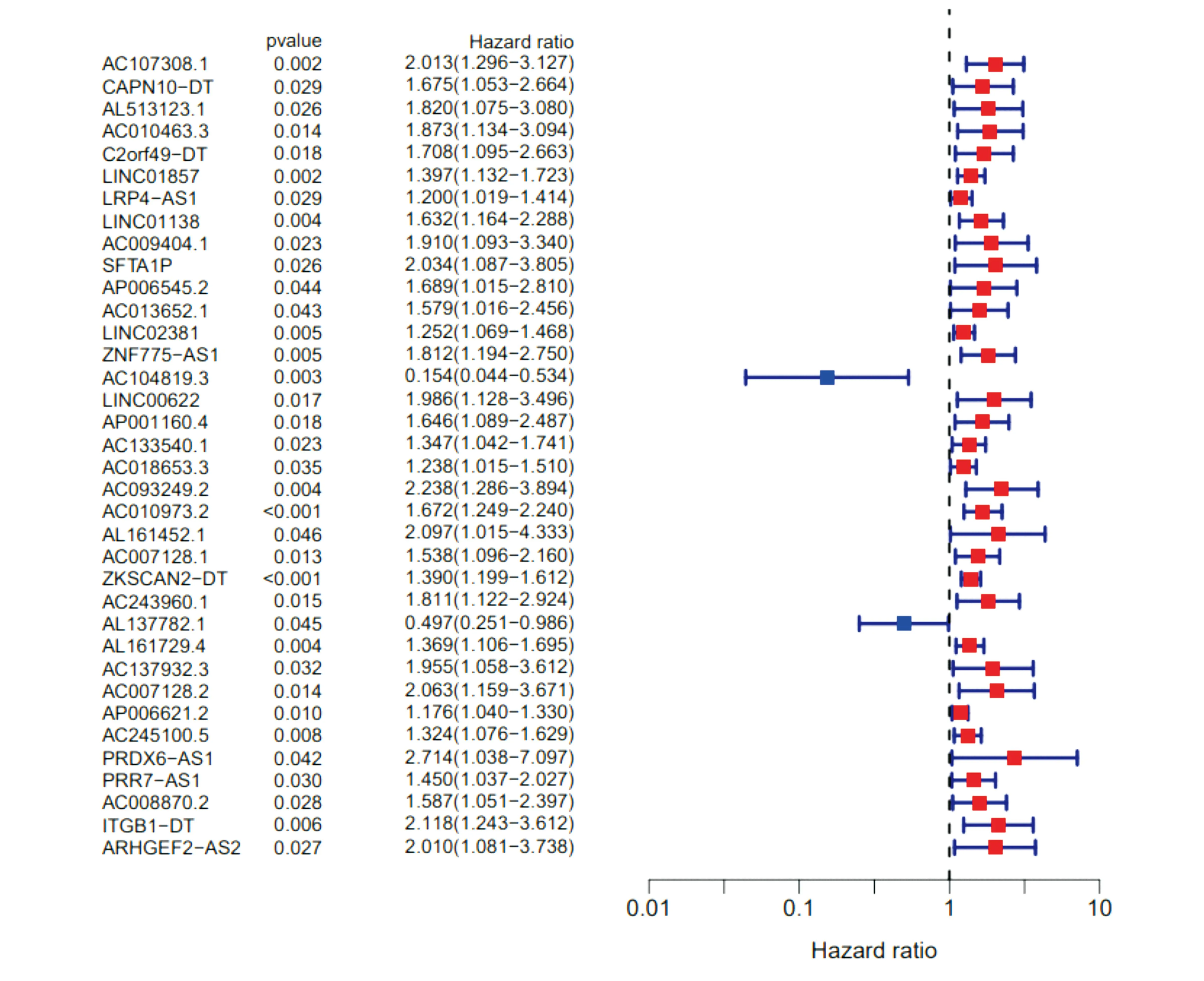
图2 单因素Cox回归分析筛选结直肠癌中的lncRNA相关基因
并以LINC01857等12个lncRNA基因构建结直肠癌患者预后风险多因素Cox回归分析(图3),根据每个基因的表达值,热图分析表明这些lncRNA基因的高表达都与肝癌的不良预后相关,其中AC104819.3和AL137782.1的表达量较低,与单因素Cox回归分析结果一致。根据风险模型,可得到所有结直肠癌患者的风险值,并将所有患者风险值的中位值设为阈值,根据此阈值将患者区分为高风险组和低分险组,用Kaplan-Meier法绘制生存曲线(图4),现有的生存分析表明,高、低风险组的生存相比较,差异显著,具有统计学意义(P<0.001),随着时间的慢慢延长,生存率也是在逐渐的降低,低风险组的死亡病例数要低于高风险组,但是总体生存率较短的患者要高于高风险组,最后高、低风险组持平。通过时间依赖性ROC曲线评估风险评分的预测性能,曲线下面积(AUC)在1年时为0.777,在2年时为0.752,在3年时为0.758,整体呈现一个下降趋势,但在2年和3年的时候趋于平稳(图5)。结果显示,LINC01857等9个lncRNA基因构建的风险模型中高低风险组患者的预后存在统计学差异。
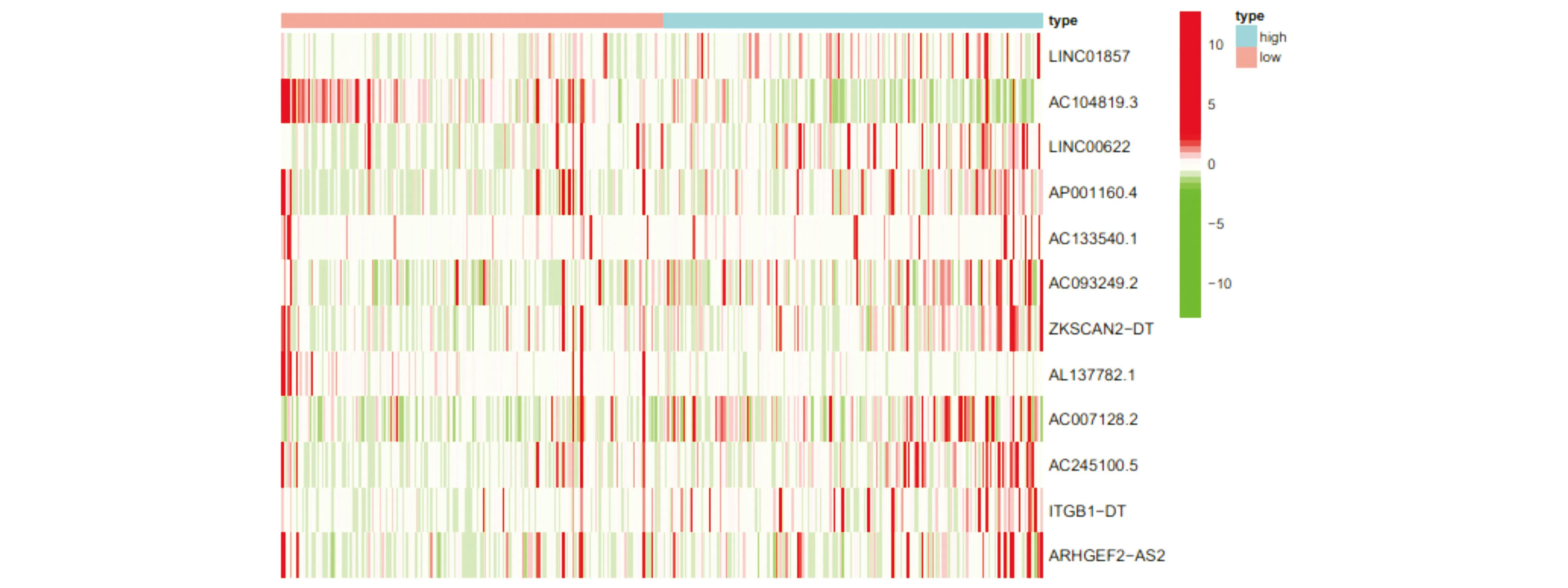
图3 多因素Cox回归及热图分析筛选结直肠癌中的lncRNA相关基因
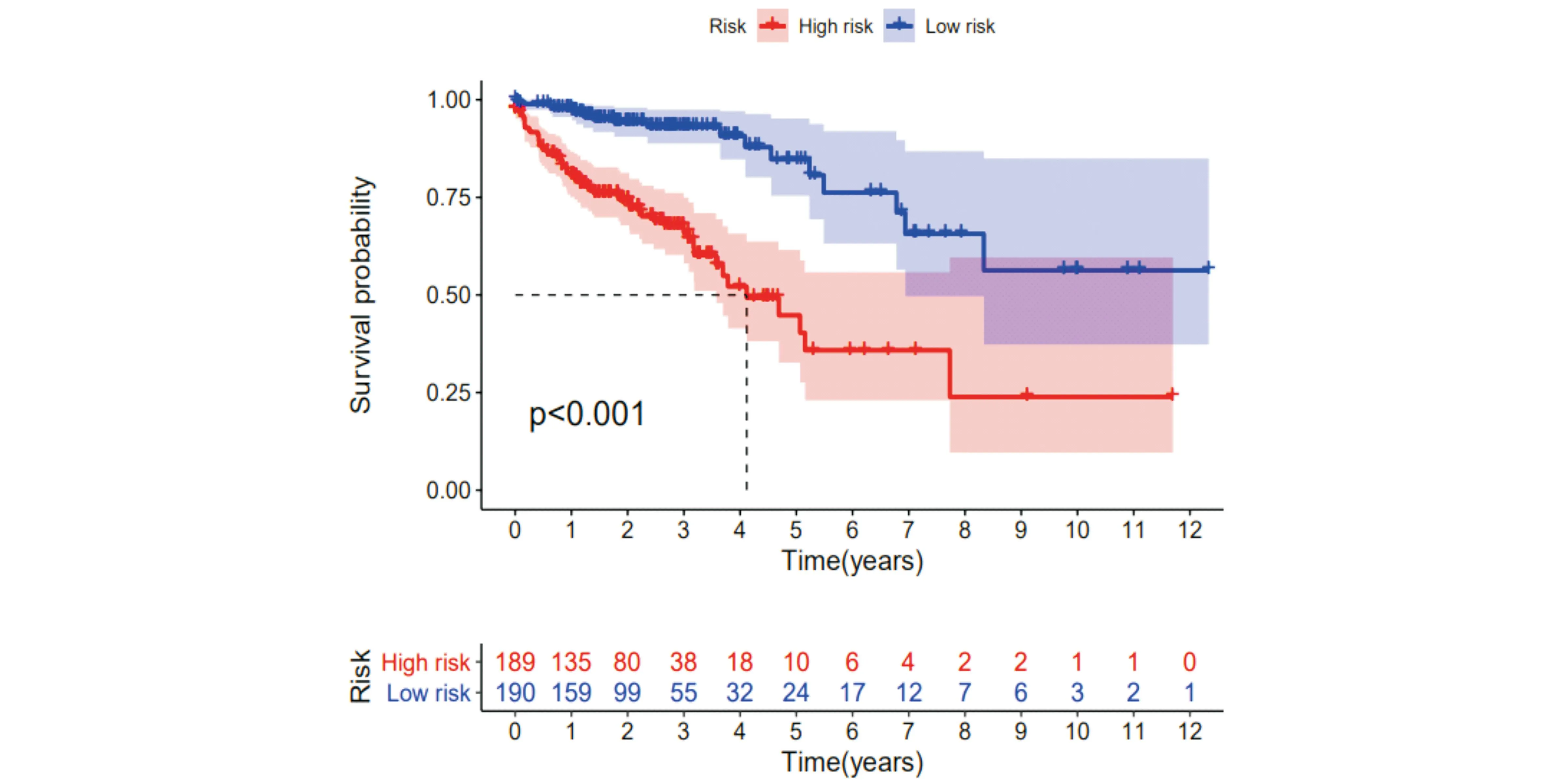
图4 高低风险组的生存曲线分析
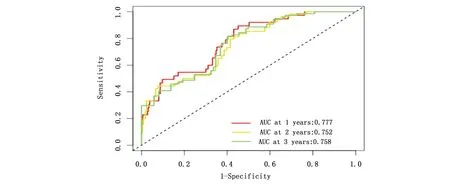
图5 ROC曲线分析图
2.2 结直肠癌关键lncRNA基因的风险评分模型的独立预后价值
评估预后风险评分模型能否成为独立预后预测因子,在单因素Cox回归分析中发现发现分期(stage)与结直肠癌患者的预后风险显著相关(P<0.001)(图4),在多因素Cox回归分析中发现,年龄和分期(stage)与结直肠癌患者的预后风险显著相关(P<0.001)(图 4),单因素Cox分析中HR值(风险评分)为1.099,95%的置信区间范围为从1.075到1.123(图6a),多因素Cox回归分析中HR值(风险评分)为1.097,95%的置信区间范围为从1.072到1.123(图6b),因此,风险评分应该能够成为评估结直肠癌患者的独立预后因素。
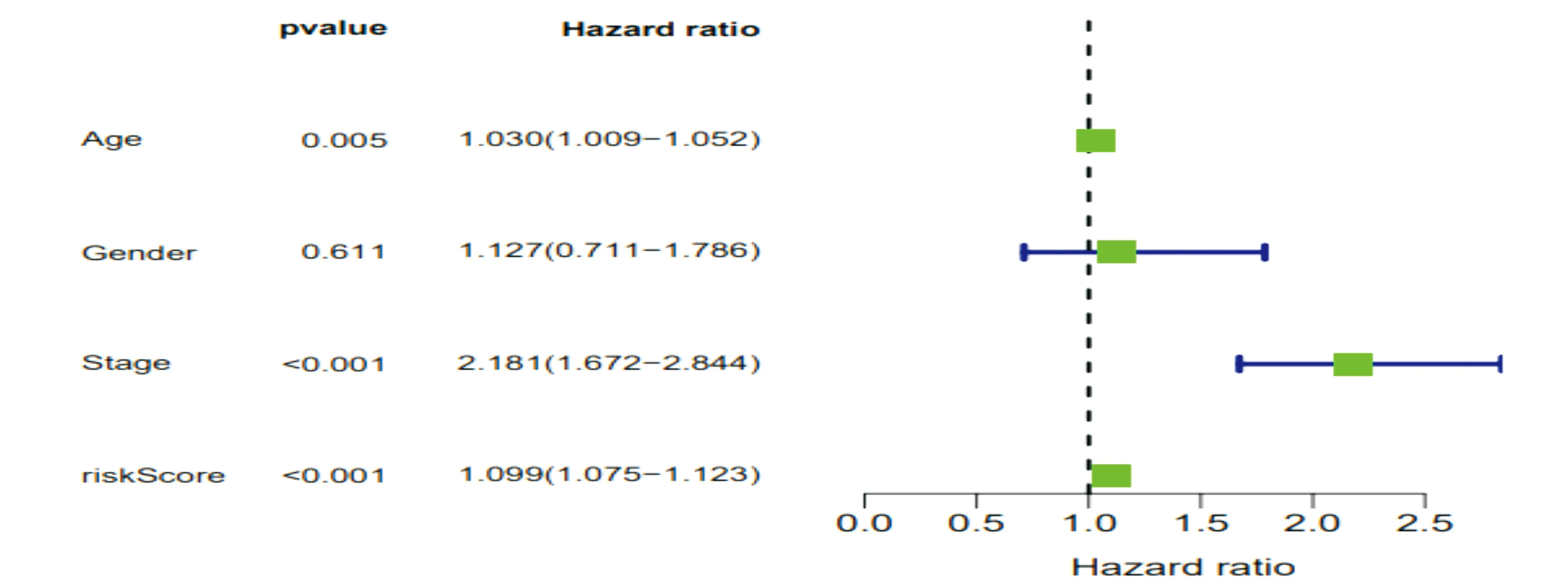
(a) 单因素独立预后分析森林图
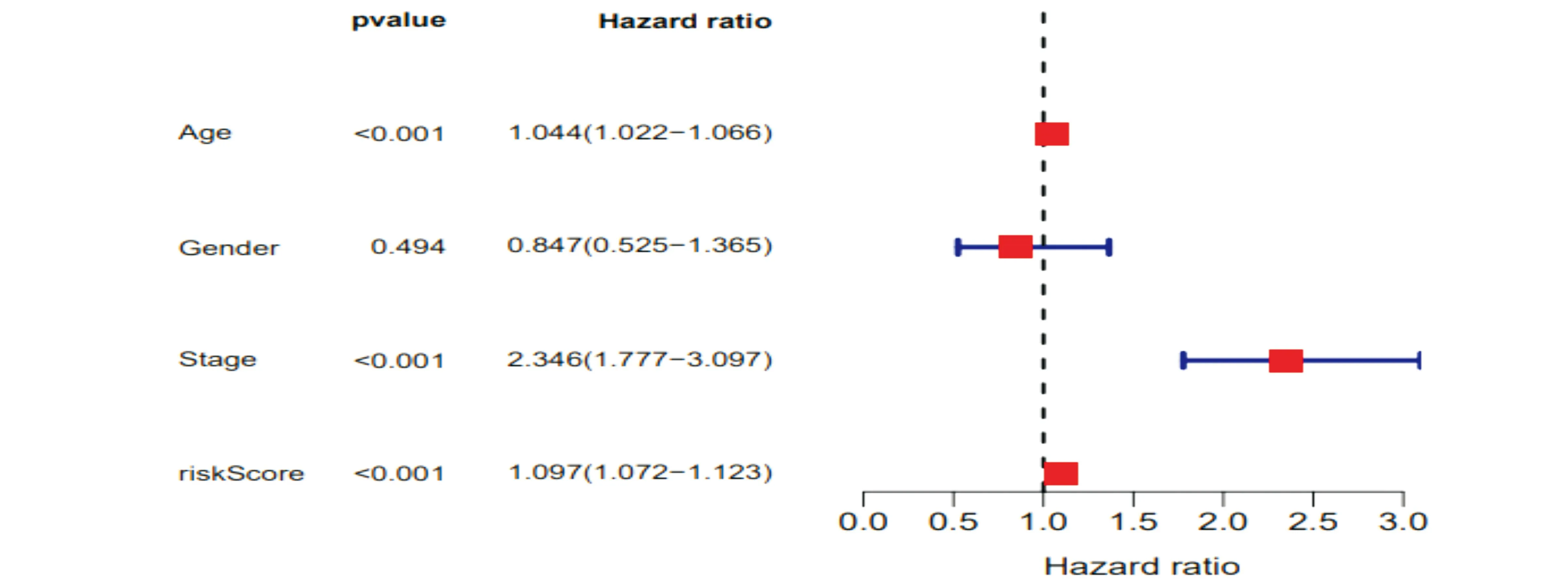
(b) 多因素独立预后分析森林图
进一步使用GSEA中的Hallmarker探究12个lncRNA基因可能的作用机制,在高风险组,这些lncRNA基因在肥厚性心肌病(Hypertrophic Cardiomyopathy,HCM)信号通路中显著富集(图7a);在低风险组,这些lncRNA基因在柠檬酸循环(Citrate cycle)信号通路中显著富集(图7b)。
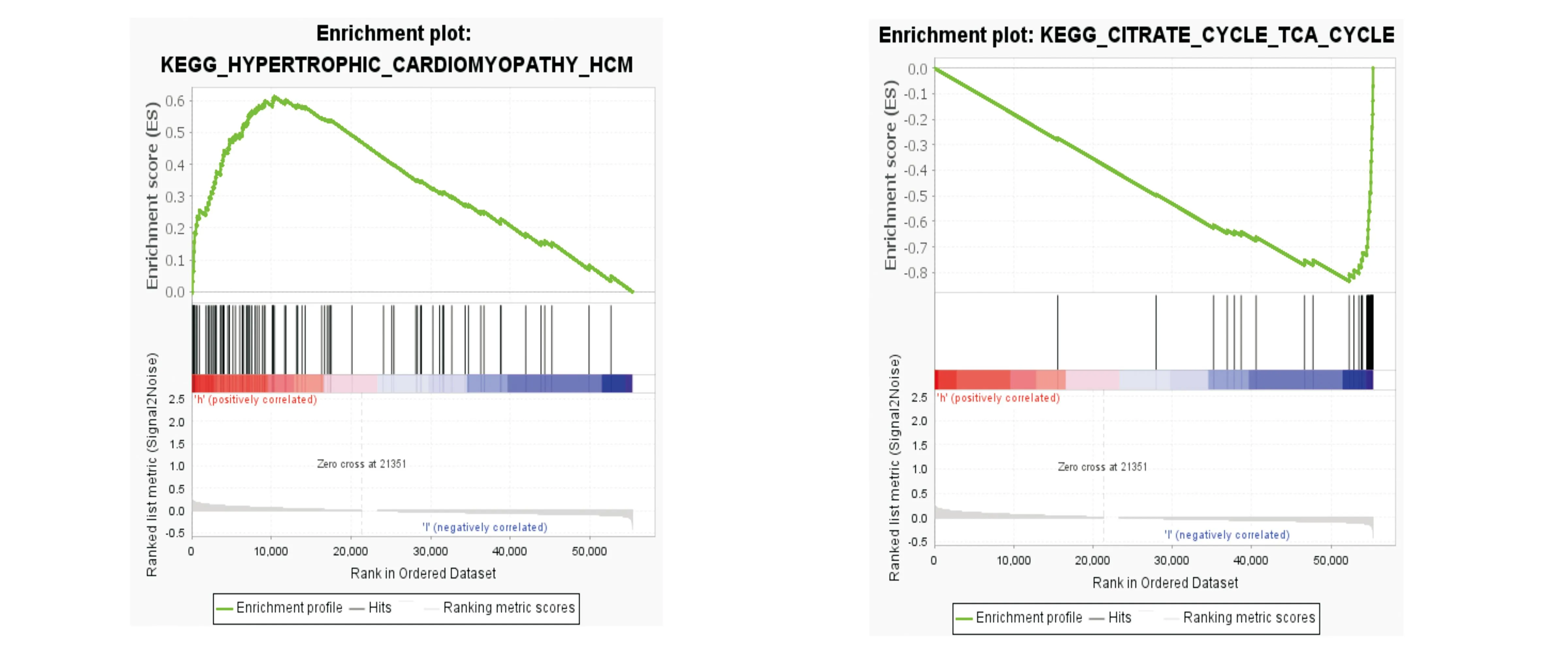
(a) lncRNA基因高风险组的作用机制预测图 (b) lncRNA基因低风险组的作用机制预测图
2.3 结直肠癌铁死亡代谢和lncRNA基因的关系网络互作
利用STRING数据库生成12个lncRNA基因(绿色)与铁死亡代谢基因(红色)的蛋白网络互作图(图8),发现lncRNA基因中AL137783.1和AP001160.4起关键的调控作用,与铁死亡代谢的大多数DEGs密切相关,但LINC01857比较特殊,仅与铁死亡代谢CDO1密切相关。总之肝癌中的铁死亡代谢和lncRNA基因两者的关系密切。
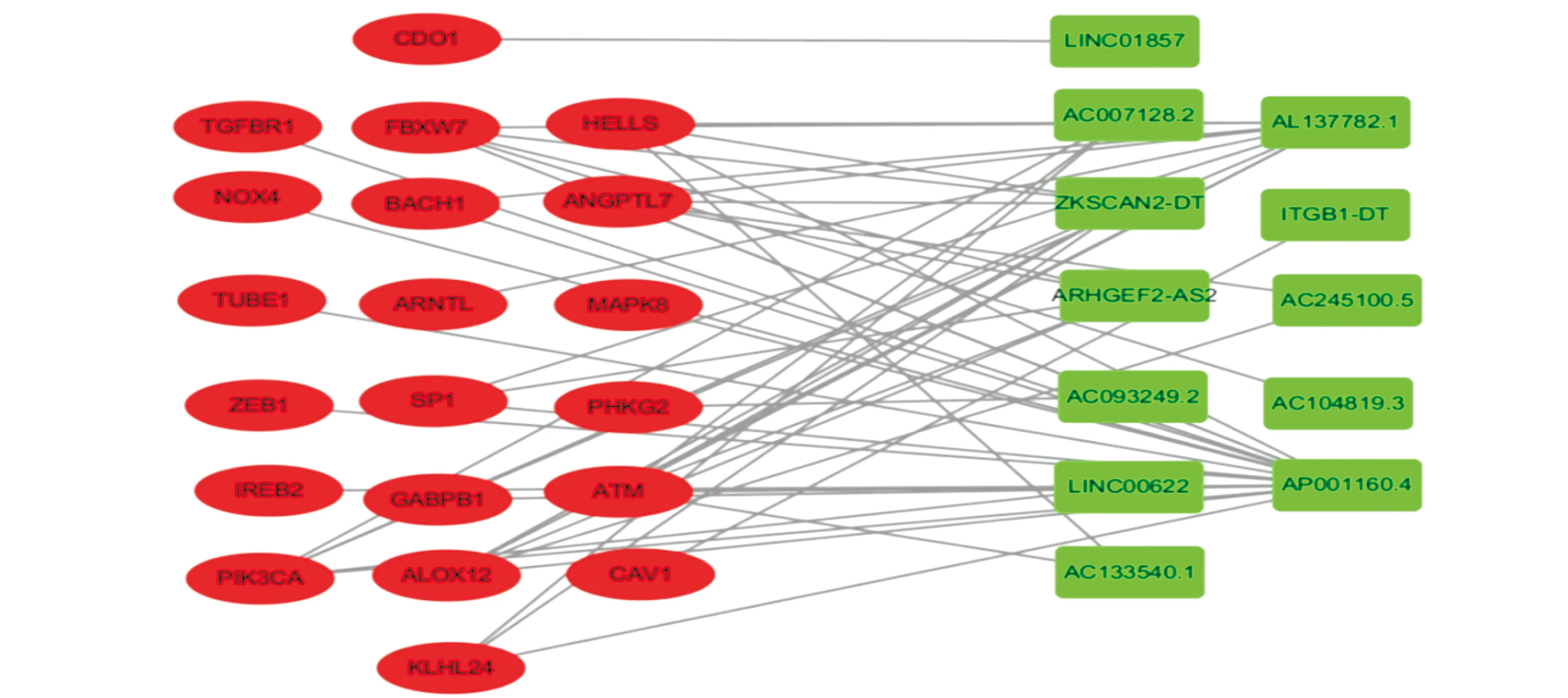
图8 铁死亡代谢和lncRNA基因的关系网络互作图
3 讨论
目前已有关于结直肠癌预后基因筛查的文献,但本研究使用分析方法不同,本研究中,通过生物信息学方法对TCGA数据库中结直肠癌的mRNA表达谱数据和临床数据进行筛选整合分析,共鉴定筛选到结直肠癌铁死亡代谢相关68个的DEGs,其中上调表达的有42个DEGs,下调表达的有26个DEGs,GO分析发现这些DEGs主要参与氧化应激反应等生物过程,参与黑色素体等细胞组分的构建,参与阴离子跨膜转运蛋白活性、铁离子结合、抗氧化活性、和氨基酸跨膜转运蛋白活性等分子功能,KEGG的分析结果与GO分析结果一致,DEGs主要富集到癌症中的MicroRNA、铁死亡、谷胱甘肽代谢、丙氨酸、天冬氨酸和谷氨酸代谢等氨基酸代谢途径。
进一步通过生物信息学分析与结直肠癌患者预后相关的lncRNA基因,根据单因素CoX回归分析初步确定了36个lncRNA基因,进一步利用多因素CoX回归分析确定了12个关键的lncRNA基因。进一步使用GSEA中的Hallmarker探究12个lncRNA基因可能的作用机制,发现在高风险组,这些lncRNA基因在肥厚性心肌病信号通路中显著富集;在低风险组,这些lncRNA基因在柠檬酸循环信号通路中显著富集;因此推断结直肠癌与肥厚性心肌病的发病机理有一定的相似之处。
在结直肠癌铁死亡代谢和lncRNA基因的关系网络互作分析中发现lncRNA基因中AL137783.1和AP001160.4起关键的调控作用,其中AL137783.1和AP001160.4均是核糖体蛋白的lncRNA基因,但关于AL137783.1和AP001160.4参与癌症的预后不良的调控未见报道,可以作为结直肠癌患者新的诊断、治疗和预后提供新的核心lncRNA基因。已有研究发现lncRNA基因LINC01857在乳腺癌中表达水平升高,并可能发挥类癌基因作用[15];LINC01857在胰腺癌中表达水平升高,并可能作为诊断胰腺癌的潜在生物标志物[16];LINC01857通过调节miR-1281/TRIM65轴促进神经胶质瘤的生长、迁移和侵袭[17];LINC01857通过调节miR-200b促进胃癌的发展[18];干扰LINC01857表达可降低宫颈癌细胞增殖、迁移及侵袭能力[19];研究发现血清中半胱氨酸双加氧酶-1(CDO1)基因启动子甲基化与多种肿瘤的发生密切相关,特别是肝癌、肺癌、胶质瘤和胆囊癌等[20-24]。本研究发现结直肠癌中LINC01857基因和铁死亡代谢CDO1基因互作,且与结直肠癌的预后密切相关,可以作为诊断结直肠癌的潜在生物标志物。

