肝脏、直肠早期同时性多原发癌1例
付渤钧,张赟鑫,王少妍,张海山
(吉林大学中日联谊医院 胃肠外科,吉林 长春130033)
多原发癌( multiple primary cancer,MPC)是指同时或先后在患者体内发生两种或两种以上的多原发性恶性肿瘤[1],根据诊断时间的差异,将MPC分为同时性MPC与异时性MPC,其中同时性MPC极为少见[2]。MPC的发病机制及病因复杂,给MPC的诊断及治疗带来很大困难[3]。吉林大学中日联谊医院近期诊治了1例典型的肝脏并直肠早期同时性MPC病例,现报道如下。
1 临床资料
患者男,58岁,因“体检发现直肠肿物4 d”入院。肠镜示:直肠下段离肛缘4 cm处见一个菜花样肿物,大小约1.5 cm×1.5 cm。肠镜病理:(直肠)腺癌。患者自述既往身体状况良好,无基础疾病,否认乙肝/丙肝病史、肝硬化、脂肪肝及烟酒史。体格检查:肝脾未触及,直肠指诊:患者处膝胸位,肛周皮肤色泽未见异常,肛门口紧张度尚可,进指约距肛门4 cm触及一个菜花样肿物,大小约1 cm×2 cm,表面不规则,活动度差,触之易出血,退出后指套可见染血。实验室检查示AFP 42.7 ng/mL,TBIL 31.5 μmol/L,DBIL 5.67 μmol/L,IBIL 25.85 μmol/L,其余肿瘤标志物及血化验指标(CA125、CA199、CEA等)结果均处于正常范围内。全腹增强CT结果示:①肝右前叶下段占位,考虑原发性肝细胞肝癌可能性大。②直肠下段占位,不除外恶性,请结合镜检及MR检查(图1)。普美显结果示:肝右叶前下段占位,考虑原发性肝癌可能性大(图2)。结合临床诊断及术前辅助检查,诊断为“直肠恶性肿瘤、肝占位”。经肝胆胰外科会诊后于静吸复合麻醉下行腹腔镜下直肠癌根治术+肝肿物切除术,会诊医生结合术中情况表示不除外转移瘤的可能。术后病理示:①(直肠肿物)中分化腺癌(大小1.6 cm×1.0 cm×0.7 cm) PTNM:T2N0Mx,免疫组化:Her-2(3+),Ki-67(70%+),MLH1(+),MSH2(+),MSH6(+),P53(80%+),PMS2(+)。②(肝肿物)中分化肝细胞癌(大小2 cm×1.7 cm×1.3 cm) 可见微血管癌栓(<5个) MVI:M1,免疫组化:AFP(+),Arginase-1(+),CD10(散在+),CD34(血管+),CK7(+),GPC-3(+),GS(+),HSP70(+),Hepatocyte(+),Ki-67(50%+)(图3、4)。术后5周入肝胆胰外科行经导管肝动脉栓塞术,静点替雷利珠单抗抗肿瘤综合治疗。术后约3个半月复查CT示肝术后,肝内多发转移性病变(图5)。行超声引导下肝穿刺活检术,穿刺病理回报:穿刺肝组织见少许分化差的癌。遂行经皮肝固有动脉栓塞术,术后口服仑伐替尼,随访5个月,患者继续口服药物治疗,体重下降10 kg。

图1 患者术前查腹部增强CT可见肝占位(箭头所示处)图2 患者术前普美显动脉期可见强化及肝胆期瘤周不光整(箭头所示处)
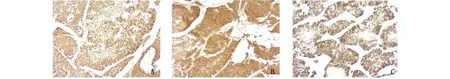
图4 患者术后肝肿物免疫组化(×40倍)A:AFP(+);B:Arginase-1(+);C:Hepatocyte(+)

图5 患者术后约3个半月复查腹部增强CT见肝内多发转移性病变(箭头所示处)
2 讨论
MPC基于单个原发瘤确诊时间点上的不同而进行分类,同时确诊或间隔小于6个月的被称为同时性MPC,超过6个月的为异时性 MPC[4]。MPC的好发部位与肿瘤发生、分布情况以及患者生存环境有关。临床上以同一器官居多,其次为同一系统器官或成对器官,不同组织来源的器官占比相对较少。在日本,多原发癌好发于消化系统、泌尿生殖系统、呼吸系统。在我国,MPC以消化系统最为多见,其次为头颈部、肺部、乳腺和甲状腺。各地区首发癌与次发癌的常见部位不同,我国首发癌以结直肠癌的发生率最高,乳腺癌其次;次发癌则以肺癌的发生率最高,结直肠癌次之[5]。异时性多原发癌常见于初发肿瘤后的1~3年,与肿瘤的复发或转移时间相似[3]。因此,临床医生不仅要掌握肿瘤复发转移的规律和部位,也要加强对MPC的认识,让患者得到更精确的诊断和治疗。
MPC的发病机制尚不明确[3]。从基因角度来看,有报道称先天性肿瘤易感人群中有5%~10%的肿瘤发生率[6]。如与抑癌基因BRCA1和BRCA2的突变有关遗传性乳腺卵巢肿瘤综合征(HBOC),以及和错配修复基因MSH2、MSH6、MLH1、PMS1和PMS2的突变有关遗传性非息肉性结直肠肿瘤综合征(HNPCC,又称Lynch综合征),这些患者容易发生MPC[7-8]。与之相似类型的疾病还有BRCA1相关蛋白(BAP1)变异相关肿瘤综合征、遗传性弥漫性胃癌综合征(上皮细胞钙黏蛋白变异)、Li-Fraumeni综合征[肿瘤蛋白P53(TP53)变异]等[5]。KOTNIS等[9]对吸烟与MPC的关系进行了一系列的研究,结果发现,吸烟以及TP53、人类X射线交叉互补修复基因(XRCC1)、微粒体环氧化物水解酶(MEH)基因的多态性是与烟草相关的多原发癌发生的主要风险因素。所以,对于有肿瘤家族史或肿瘤呈多发、早发的病人,通过基因检测,可以更好地识别出 MPC的高风险人群,从而实现早期诊断和治疗。
此外,MPC的发生还可能与患者的免疫水平下降、生活习惯(如吸烟与饮食习惯等)、病原体感染以及个体内分泌因素有关[10-12]。人体的免疫系统可以通过多种方式来抑制肿瘤细胞的生长,或是将其消灭,提高机体免疫系统的功能可以极大的减少肿瘤的发生和进展;相反浆细胞骨髓瘤病人对 MPC的易感性也因其人群免疫功能异常而相应增高[13]。此外,外源性致癌因子对 MPC的远期影响也是导致 MPC发病的重要原因。吸烟与呼吸、泌尿和消化道肿瘤有关。吸烟者发生 MPC的危险性较高,特别是首发癌出现后没有戒烟的病人[14]。很多癌症都和不健康的饮食习惯有关。如果长期高盐高脂饮食,则会增加胃癌、食管癌、大肠癌等疾病的发生,并且患 MPC的几率也会更高。有研究表明[15],胃黏膜相关淋巴瘤在胃癌病人中的发病率相比于比其它肿瘤明显较高,这可能是因幽门螺杆菌(HP)感染而造成的。人乳头瘤病毒(HPV)除了会增加子宫颈癌和阴茎癌的发病率,还会导致食管癌和鼻咽癌的发生[16]。这提示 MPC病人应尽可能降低病原体等外来致癌因子的蓄积。此外,因机体免疫力下降及致癌因子积累,MPC发病率一般随年龄增加而增加,但首发癌发病年龄较轻者,其远期 MPC发生率相对更高。女性的生殖系统和乳房都是雌激素的靶器官,是多原发肿瘤易出现部位[3]。有学者提出[17],胰岛素作为一种促进肿瘤细胞增殖的生长因子,在人体内存在突变或肿瘤细胞时,其致癌风险将因胰岛素而增大[18]。
在首发肿瘤治疗后5年内出现 MPC的几率最高,以前3年为著。术后的常规复查与定期随访对于发现肿瘤的复发与转移以及发现 MPC具有重要意义[19]。对有 MPC危险因素的肿瘤病人,在术后的2年内,每半年做1次PET-CT或全身CT检查,以后每年检查1次[20]。MPC多见于泌尿生殖系统、消化系统、呼吸系统以及头颈部,在后续的随访中需特别留意。若发现可疑病变,需要及时进行活检,如果确诊为MPC,则应在综合考虑后尽可能予以手术彻底切除。
MPC尤其需要与原发肿瘤合并转移灶相鉴别。如结直肠癌肝转移在临床中较为常见,约20%~25%的结直肠癌病人在确诊时已发生肝转移,而在手术后仍有约50%的结直肠癌病人发生异时性肝转移[21-22]。所以在诊断上,由于肝转移是直肠癌最常见的转移瘤类型,且两种脏器同时发生原发性肿瘤的几率过低,故临床医生在接诊直肠癌伴有肝占位的患者时,常根据临床经验考虑该肝占位为直肠癌转移性肿瘤,而不会优先考虑其为直肠癌合并原发性肝癌的MPC情况,从而增加了误诊的可能性,但结合患者的病史、影像学、实验室检查等信息有助于肝脏原发肿瘤与转移灶的鉴别,对患者的治疗有一定的指导意义。
肝细胞肝癌(hepatocellular carcinoma,HCC)的常见危险因素包括乙型病毒肝炎/丙型病毒肝炎感染、过度饮酒、非酒精性脂肪肝等[23]。常规肝细胞肝癌CT、MRI扫描表现为肝内多发或单发的结节、肿块,典型肝细胞肝癌动态增强扫描病灶呈快进快出表现,而转移瘤的“牛眼征”及环形强化较为多见。对于原发性肝癌诊断价值较高的普美显(gadolinium-ethoxybenzyl diethylenetriamine pentaaceticacid,Gd-EOB-DTPA)最大优势在于其肝胆期的特异性影像表现,肝胆期瘤周低信号指的是在肝胆期肿瘤外周出现楔形、火焰状或片状的低信号区。因此,在肝胆期行普美显增强磁共振(EOB-MRI)能够清晰的显示病灶边界,大大提高了对病灶的显示以及诊断能力。而且HCC 的大体分型与肿瘤的生物学行为、肿瘤微环境、病理及预后均有相关性,非结节型 HCC较结节型HCC更容易形成肝内转移和门静脉癌栓。有研究发现,合并微血管侵犯(microvascular invasion,MVI)的HCC在 EOB-MRI 肝胆期出现瘤周低信号有可能提示更差的病理学分级,肿瘤的大体分型(非结节型)、肿瘤边缘不光滑和肝胆期瘤周低信号是MVI的独立预测因素[24-25]。因此CT和MRI等影像学检查不仅能够帮助对MPC进行诊断,而且可以帮助判断患者的临床病理特征,以指导治疗。结合本例患者,术前发现患者直肠癌伴肝占位,且患者否认曾有乙肝/丙肝、肝硬化、脂肪肝病史及烟酒史等原发肝癌的危险因素,临床医生易依靠经验将此肝占位诊断为肝转移瘤。此患者经过腹部增强CT、肝脏普美显、及消化系统肿瘤标志物筛查后,结合影像检查符合肝细胞肝癌典型的强化方式,可见肿瘤边缘不光滑而未见肝转移瘤典型的“牛眼征”表现,同时患者AFP升高、CEA正常,该患者影像学资料及实验室检查均支持原发肝癌的诊断,因此该患者术前考虑为直肠癌合并原发性肝癌可能性大,这与术后病理结果相符(图3-4),而且病理报告可见HCC存在MVI(图3C),这也与普美显可见肿瘤边缘不光滑相符(该征象提示肝肿物可能存在MVI)(图2-3),因此该患者确诊为少见的直肠、肝脏同时性MPC。
就本例而言,该患者在结合术前情况考虑直肠癌合并HCC后,行直肠癌根治术及肝肿物切除术,患者术后病理示直肠肿物及肝肿物都处于早期癌阶段,并于术后根据病理结果行经导管肝动脉栓塞术及静点替雷利珠单抗的抗肿瘤综合治疗。因此从分期角度,该患者的预后理论上相对较好,但患者仍在术后3个月发生大面积肝转移(图3、4),这与后者MPC预后差的观点相符。这也提示MPC与单发癌在治疗上可能仍有区别。该例患者从肠癌角度不存在高危因素,预后相对较好,然而从肝癌角度,虽然分期较早,但存在MVI,是肝癌复发的危险因素之一。
随着新一代分子测序方法的开展,明确多原发癌的特征性基因表达,可以针对其特有的分子靶点进行更明确的靶向治疗。

