食管入口巨大纤维血管性息肉1例
林珈羽,王吉喆
(1.吉林大学中日联谊医院 耳鼻咽喉头颈外科,吉林 长春130033;2.大连医科大学附属第二医院 耳鼻咽喉科,辽宁 大连116000)
纤维血管性息肉是一种罕见的食管良性肿瘤,因其早期无明显症状而难以发现,症状出现时息肉往往已经很大,息肉反流误吸可能导致死亡。本文报道了1例食管入口巨大纤维血管性息肉合并声带息肉的病例,旨在提高临床医生对该疾病诊断与鉴别诊断的认知,以期减少对此类疾病的漏诊。
1 临床资料
患者,女,53 岁,因吞咽困难、声嘶2个月入院,恶心、呕吐动作时,有时口内吐出长条样肿物,可通过吞咽动作还纳,伴反流、咽干,无疼痛、呼吸困难。查体:口内可见长条形肿物,吞咽后消失。电子喉镜:左侧声带前中1/3交界处可见息肉样新生物。上消化道内镜及肺部CT未见明显异常。遂行支撑喉镜内镜下高频电刀食管肿物切除术、支撑喉镜下声带息肉摘除术。
术中用支撑喉镜挑起会厌,暴露声带,黏膜钳将息肉摘除,调整支撑喉镜位置,显露环后区及食管入口,见肿物呈长条形,长约10 cm,直径约最宽处约2 cm,表面光滑。肿物根蒂部位于食管入口下方约1.5 cm的左侧壁(图1),用高频电刀在蒂部最狭窄、约距离管壁1 cm处切断蒂部,完整摘除肿物。肿物摘除后,探查肿物无残留,食管壁无穿透,创面无明显渗血,留置鼻饲管。术后病理:(食管入口肿物)鳞状上皮下见炎细胞浸润,纤维、脂肪及脉管组织增生,表面溃疡形成,考虑为纤维血管性息肉(Fibrovascular Polyp,FVP)(图2)。免疫组化:CK阳性,Vimentin阳性,Ki67 5%+,抗平滑肌抗体(SMA)部分阳性。术后给予鼻饲饮食,抗生素预防感染,术后1周出院,出院前复查电子喉镜:右侧披裂活动良好,左侧披裂活动略减弱,双侧梨状窝清洁,环后黏膜光滑。术区愈合良好。术后1周拔出胃管,经口进食顺畅无呛咳,随访至今肿物无复发。
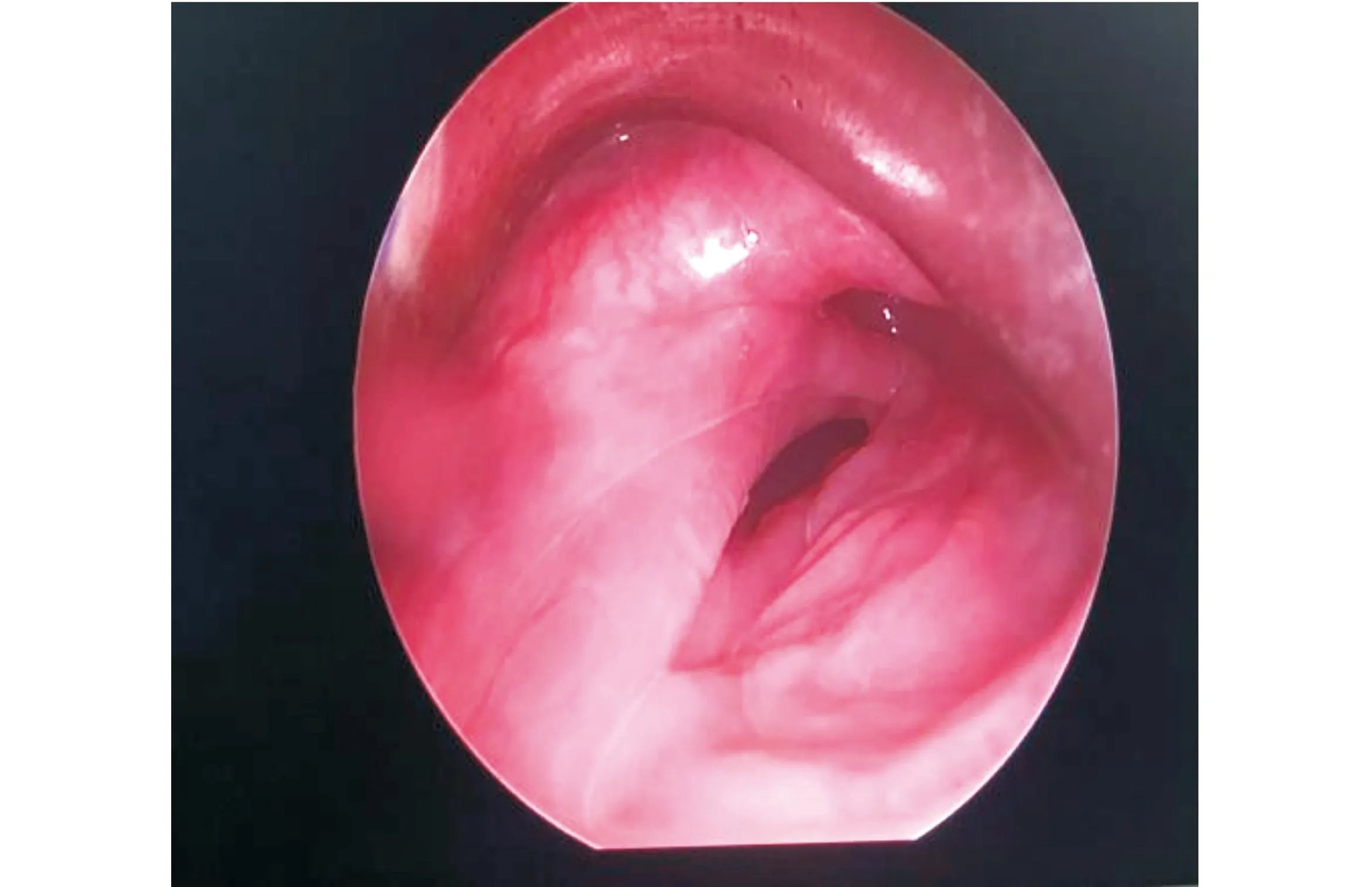
图1 术中内镜下肿物图像(蒂部位于食管入口下方约1.5 cm的左侧壁)
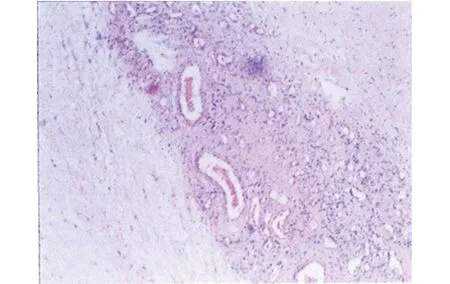
图2 术后病理切片见[鳞状上皮下见炎细胞浸润,纤维,脂肪及脉管组织增生(HE,X40)]
2 讨论
FVP是一种罕见的发生在颈段食管的良性肿瘤。据50年来进行的近20000例尸检分析,仅发现90例食管良性肿瘤,并且源于颈段食管的良性肿瘤尤为少见[1]。FVP占食管良性肿瘤比例仅为0.03%[2],多见于老年男性。关于食管FVP的文献报道较少,自1969年以来,美国仅登记了16例FVP病例[3]。约85%的息肉位于食管上1/3,靠近食管上括约肌[4]。SALAMOON等[3]认为其根蒂多位于环咽肌与食管入口间的 Laimer 三角,由于此处缺乏肌肉纤维的支撑,小的黏膜或黏膜下肿瘤可通过蠕动延伸到食管腔内,通过悬吊式生长成为带蒂的息肉[5-6]。对于症状不典型的病人,诊断可能存在困难。本例FVP体积较大,并且无法在内镜下看到其根蒂部,且患者伴有吞咽困难症状,易误诊为恶性肿瘤。耳鼻喉科医生对此认识不足,容易导致漏诊。
大多数患者因早期无明显症状而难以发现。根据文献报道,吞咽困难(87%)是最常见的症状,其次是咳嗽、呼吸急促等呼吸系统症状(25%),病人咳嗽、恶心、呕吐动作后肿块脱垂至口中为其特征性症状,约占12%。此外,还可出现反酸、胸痛、呕吐、腹痛、黑便等症状。肿物脱垂至声门可引起气道阻塞导致晕厥,危及生命。黏膜溃疡可表现为贫血[7]。
上消化道内镜检查为其常见的检查方法,可更为直观的描述病变位置、大小,但是本例病人检查时并未视及息肉。考虑由于FVP与食管并行,其表面覆盖正常黏膜,且肿块远端无法视及而导致漏诊。研究表明上消化道内镜检查遗漏了25%的实体壁内肿瘤和腔内肿瘤[5]。X 线钡剂检查可显示病变形态及位置,表现为光滑、可移动的充盈缺损[8]。但是对病变根蒂部显示不佳。当息肉与食管壁相贴时,给人一种正常钡餐吞咽的假象。POSTLETHWAIT[9]通过研究发现22%的钡剂检查未能确定息肉的存在。并且对于肾功能不全的病人钡剂会增加病人肾功能的损害。超声内镜检查是利用内镜与超声技术结合的新型检查技术。不但可以内镜下观察消化道表面黏膜,还能与超声深部探测相结合,根据回声的高低判断脂肪组织、纤维组织和血管组织的比例[10]。镜下还能通过活检明确肿物性质,提高了疾病诊断准确率。CT和MRI则可显示纤维血管性息肉的腔内性质和病变的组织成分。ZEVALLOS等[11]认为CT的不同的衰减值可以显示息肉中脂肪和纤维血管组织的含量。本例病人术前胸部CT平扫未发现肿物,考虑为肿物位于食管入口处,未在胸部CT扫描层面内。
在组织学上,FVP由纤维性、血管性和脂肪性组织组成,伴有血管网,覆盖正常的鳞状上皮,下有疏松或致密的纤维组织、脂肪瘤和血管成分。大体观下肿瘤多数有蒂,为粉红色团块状,息肉的尖端溃烂会导致出血。本例肿物免疫组化 Vimentin阳性,说明肿瘤细胞具有与纤维组织细胞同源性,与文献报道一致[12]。FVP恶变率极低,国外学者报道了其脂肪成分可恶变成脂肪肉瘤[13],鳞状上皮可恶变为鳞状细胞癌[14],小的息肉可恶变为腺癌的病例[15]。
FVP应与以下疾病相鉴别:1)胃肠间质瘤。多发生于胃肠道黏膜下,瘤细胞一般长梭形,细胞丰富,核端可见空泡,细胞质红染,呈束状或交织排列,其诊断主要依靠免疫组化检测,CD117和DOG1阳性率均大于90%,二者具有高度一致性[16]。2)癌肉瘤。镜下瘤体以梭形肉瘤细胞为主要成分,而瘤体表面或蒂的基底部分布少量鳞癌、腺癌或未分化癌细胞。Vimentin、SMA、Desmin、CK、EMA呈阳性表达[17]。3)平滑肌瘤。发生于食管的肌瘤一般较小,瘤细胞杆状核,两端钝圆,细胞质丰富嗜酸,呈束状交织、席纹状排列。免疫组化 SMA、Desmin 和 Calponin 阳性[18]。4)炎性肌纤维母细胞瘤。好发于儿童和青少年,大体结节状或分叶状,镜下有增生的梭形纤维母细胞或肌纤维母细胞呈束状或漩涡状排列,间质伴有大量淋巴细胞、浆细胞、嗜酸性粒细胞浸润。免疫组化表达 Vimentin、SMA、Desmin 和 ALK,不表达 CD34[19]。5)食管神经鞘瘤。病理上主要有A区和B区组成,此为其特征性表现。A区细胞紧密排列成栅状结构,呈束状交叉成漩涡结构,或洋葱皮样结构。B区细胞呈星芒状,排列疏松而零乱[20]。
手术切除是FVP的最佳治疗方法。根据根蒂部的起源、大小、血管分布以及肿块的大小选择术式。包括上消化内镜下肿物切除术和经口、经颈或经胸入路的食管切开术和肿瘤切除术。直径小于2 cm且根蒂部较细的息肉可通过内镜结扎和电凝切除。长度大于8 cm或血管丰富的息肉应通过颈部入路切除。当息肉太大而不能通过口咽取出时,建议通过胃造口术取出。对于复发的病例及多发的息肉可考虑经胸行食管切开术[7]。但是外科手术创伤大、风险高、并发症多、费用高,治疗时间较长。国内有研究认为硬质食管镜、支撑喉镜或上消化内镜可用于病变体积较小且根蒂部较窄的病例[21-22]。随着内镜技术的进步,国外学者报道了内镜下切除长度大于10 cm息肉的病例。但消化内镜下仍存在一定的弊端。如视野受限,不易止血。有关支撑喉镜或者食管镜下切除食管肿物的报道较少。张鸿彬等[23]报道了1例经口支撑喉镜下应用低温等离子射频消融食管入口巨大息肉病例。和支撑喉镜相比,硬质食管镜可以在食管内形成钢性管道,但是操作长度较长,管腔空间有限,难以置入长度合适的硬质内镜,操作时视野和角度不清,支撑喉镜视野则优于食管镜。支撑喉镜长度一般18 cm,加上喉镜扩张作用,配合硬质视频内镜及监视器,基本能满足食管上段肿物切除的需要[24]。在本文报道的病例中,尽管息肉体积较大,仍在支撑喉镜下内镜下通过高频电刀完整的切除了息肉,与传统手术相比,缩短了手术时间及住院时间,使患者更快的恢复正常饮食。若术中出现大出血,还可更改手术入路方式。本例患者术后左侧披裂活动减弱,考虑为支撑喉镜为硬质性材料,术中压迫环杓后肌和环杓侧肌时间过长所致。因此,在临床上遇到此类患者时,尽量缩短手术时间,降低手术的术后并发症。
本例患者因“声嘶”就诊,拟行手术治疗,且行胃镜及胸部CT均未发现异常。仔细询问病史才发现患者前期有咽部异物感,且症状不明显,患者为未重视,直到恶心、呕吐动作时,口内吐出长条样肿物时才被发现,未发生较为危险的并发症。此病极易造成漏诊,分析其原因如下:1)FVP较小时症状不明显。考虑为肿物沿食管腔悬吊式生长不影响吞咽和食物通过。咳嗽时因胸腹腔内压力增大气流外涌促使部分瘤体逆行涌至咽腔,瘤体回缩复位后症状消失。2)FVP缺乏典型的形态特征。因大多数病变被正常的鳞状上皮覆盖,易被误认为正常组织,内镜医师检查时可能只注意到没有黏膜异常的较小的食管腔,从而导致漏诊。3)下咽和近端食管的钡餐 X线检查可勾勒出占位性肿块的轮廓,在一定程度上弥补了内镜的不足,但若巨大的FVP被压在食管壁上,会造成一种正常吞钡的假象导致漏诊。
综上所述,FVP是罕见的食管良性肿瘤。早期症状不明显,仔细询问病史可诊断,口内出现长条样肿物应高度怀疑此病,并行MRI 检查,其次内镜医师在检查时应仔细辨别。发现后应尽早手术切除,内窥镜手术是传统手术的微创替代方法,可以使患者尽快的恢复到正常生活。

