间充质干细胞膜包载5-氨基酮戊酸介导的光热作用抑制皮脂分泌
赵天奇,于 然,王余海,朱明姬
(吉林大学中日联谊医院 皮肤科,吉林 长春130033)
寻常痤疮是一种累及毛囊皮脂腺单位的炎症性疾病,针对皮脂腺的选择性光热作用是目前该疾病的研究热点。5-氨基酮戊酸(ALA)介导的光动力疗法(ALA-PDT)能有效治疗痤疮[1],ALA是强光敏剂原叶啉IX(PpIX)的前体,可富集于增殖旺盛的细胞内,生成大量PpIX,介导能量从光转移到分子氧,进而产生活性氧。这些活性氧具有非常短的寿命和扩散半径,迅速引发细胞毒性作用,造成细胞损伤,从而发挥作用[2]。但是ALA的亲水性限制其在组织和细胞膜间的通透性,可影响其介导的光动力治疗效果。本课题组前期研究发现脐带来源的间充质干细胞膜可包载小分子药物和金银纳米颗粒等,既能提高药物的治疗效果,又能减少药物的副作用[3,4]。本文拟探讨脐带来源的间充质干细胞膜包载5-氨基酮戊酸(ALA@STCM)介导的光热作用对金黄地鼠皮脂腺斑和皮脂分泌的影响。
1 材料与方法
1.1 细胞培养
(1)细胞复苏:取出在液氮中冻存的细胞,放入提前预热(37℃)的水浴锅中,不断摇晃冻存管使细胞在1 min内解冻。随后,用酒精消毒冻存管外壁,使用移液枪吸取细胞冻存液并转移至离心管中,离心(1 000 rpm,3 min)并弃上清,加入1 ml含10%胎牛血清(FBS)的DMEM培养基重悬细胞。
(2)细胞培养:使用含有10% FBS和100 IU/mL青链霉素的DMEM培养基培养人皮脂腺细胞系(SZ95,来自德国 Prof.Christos C.Zouboulis实验室),并置于37℃、含有5%CO2的恒温箱中培养[5]。使用含有10% FBS和100 IU/mL青链霉素的DMEM培养基培养脐带来源的间充质干细胞(MSC),并置于37℃、含有5%CO2的恒温箱中培养[3]。
(3)细胞冻存:使用倒置显微镜观察细胞生长形态,取生长良好、细胞汇合度达到70%~80%的细胞冻存。冻存步骤如下:使用PBS清洗细胞两次,加入约2 ml含EDTA的0.25%胰酶消化细胞。消化完全后,加入2 ml含10%FBS培养基终止消化,离心(1 000 rpm,3 min)并弃上清,加入1 ml冻存液(10% DMSO+90% FBS)重悬细胞,并转移至冻存管中。将冻存管置于细胞程序降温盒后,存放于-80℃冰箱过夜后液氮保存。
1.2 间充质干细胞膜微粒的制备
根据Gao等人的方法制备MSC膜微粒[6]。将培养好的MSC用胰蛋白酶进行消化,随后进行离心(1 000 r/min,3 min)并收集细胞。使用PBS(4℃,10 mM,pH=7.4)彻底清洗收集的细胞,并使用经高压过的去离子水重悬细胞,使其胀破。将上述混合物置于冰浴中孵育15 min,随后进行离心(3 000 r/min,10 min)。取上清液进一步离心(13 000 r/min,30 min)后取沉淀得到MSC膜,重悬后保存在-80℃冰箱中待用。
1.3 ALA@STCM的制备
取出约4×106个MSC制作的MSC膜,室温放置备用。将MSC膜溶液(0.3 mL,0.5 mg/mL)添加至ALA溶液(0.5 mL,0.2 mg/mL)中,并在水浴超声下处理30 min。随后,将混合溶液进行离心(10 000 r/min,5 min),沉淀即为制备好的ALA@STCM,将其重悬并保存备用。待其融化后使用。
1.4 ALA和ALA@STCM的CCK-8细胞毒性实验
使用含有10%FBS的DMEM培养基将ALA和ALA@STCM分别稀释至0 mM、0.02 mM、0.1 mM、0.25 mM、0.5 mM和1 mM备用。将SZ95细胞按照1×104/孔的密度接种至96孔板中培养24 h。随后,将不同浓度的ALA和ALA@STCM分别加入对应孔中继续孵育24 h。孵育后向每孔中加入10 μL CCK-8试剂,使用酶标仪测定每个孔中在450 nm处的吸光度数值。
1.5 实验动物分组和痤疮丙酸杆菌感染动物模型的建立
本研究以金黄地鼠背部的皮脂腺斑(金黄地鼠购于辽宁长生生物技术股份有限公司,体重80~120 g,雄性)为研究对象。实验动物分组如下:(A)空白组;(B)接种痤疮丙酸杆菌(P.acnes);(C)接种痤疮丙酸杆菌(P.acnes)+浓度为5%的ALA;(D)接种痤疮丙酸杆菌(P.acnes)+浓度为5%的ALA@STCM。上述实验动物在处理后均给予红光照射20 min。
对金黄地鼠(购于辽宁长生生物技术股份有限公司)进行脱毛处理,按照上述的实验动物分组于背部皮脂腺斑处皮下注射P.acnes(25 μL/100 g体重)构建痤疮丙酸杆菌感染动物模型。
1.6 组织学分析
对实验动物给予1.5所述处理后,在治疗后第10、20、30天于每组分别随机处死3只金黄地鼠,取材于双侧皮脂腺斑。将取下的组织用福尔马林溶液进行固定,采用苏木精-伊红(H&E)染色和油红O(ORO)染色,通过显微镜进行组织学分析。
1.7 统计学分析
本研究的实验数据以平均SD表示,图表使用Graph Pad Prism制作,采用方差分析(ANOVA)或t检验进行统计分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 ALA和ALA@STCM的CCK-8细胞毒性分析
如图1所示,随着ALA和ALA@STCM溶液浓度的升高,SZ95细胞的存活率有所减低,并且当浓度为0.02 mM时,可明显抑制SZ95细胞的存活率。在相同浓度条件下,ALA@STCM溶液对于SZ95细胞活力的抑制作用低于ALA溶液,但差异无明显的统计学意义。结果表明,使用MSC膜包载ALA未明显增加细胞毒性,证明了MSC膜作为载药工具的安全性。

图1 ALA和ALA@STCM的CCK-8细胞毒性分析
制备浓度分别为0 mM、0.02 mM、0.1 mM、0.25 mM、0.5 mM和1 mM的ALA和ALA@STCM溶液。将不同浓度的药物溶液与SZ95细胞共同孵育24小时,采用CCK-8试剂检测细胞活力,实验数据显示为均值±SD。
2.2 ALA和ALA@STCM介导的光热作用对于P.acnes感染的金黄地鼠皮脂腺斑和皮脂分泌的影响
图2为空白组、模型组(接种P.acnes)、ALA组(接种P.acnes+ALA)和ALA@STCM组(接种P.acnes+ALA@STCM)于第10、20、30天时金黄地鼠背部皮脂腺斑情况,可观察到模型组小鼠背部皮脂腺斑处出现肿胀,皮损表面粗糙。随着时间的延长,ALA组和ALA@STCM组的小鼠背部皮脂腺斑的肿胀情况较前改善、皮脂腺斑面积较前减小,但ALA@STCM组的改善程度优于ALA组。

图2 金黄地鼠背部皮脂腺斑情况
图3为空白组、模型组、ALA组和ALA@STCM组于第10、20、30天时金黄地鼠背部皮脂腺斑H&E染色(40×)结果,可以观察到给予光照后第10天ALA组和ALA@STCM组的金黄地鼠皮脂腺开始缩小,第20天和第30天时皮脂腺缩小程度更加明显,并且ALA@STCM组的皮脂腺缩小程度显著优于ALA组。
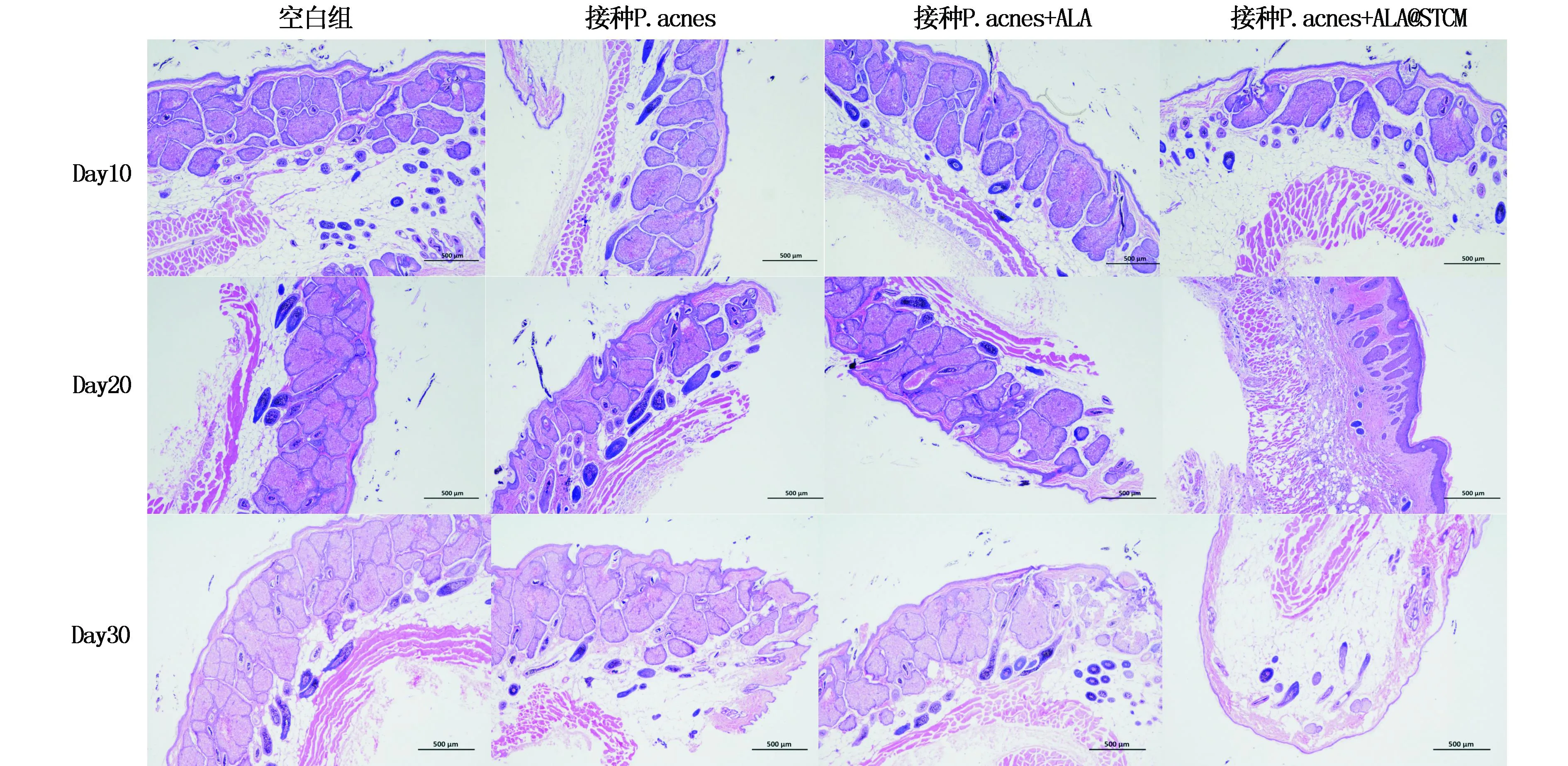
图3 金黄地鼠背部皮脂腺斑H&E染色(40×)
图4为空白组、模型组、ALA组和ALA@STCM组于光照后第10、20、30天时金黄地鼠背部皮脂腺斑ORO染色(40×)结果,可以观察到ALA组和ALA@STCM组给予光照后明显抑制金黄地鼠皮脂腺斑皮脂分泌,并且ALA@STCM组的抑制皮脂分泌的程度较ALA组更为显著。

图4 金黄地鼠背部皮脂腺斑ORO染色(40×)
3 讨论
以甘油三酯(TGs)、角鲨烯和蜡酯为主要成分的皮脂分泌增加在促进痤疮发生发展的过程中至关重要[7]。皮脂分泌的增加以及成分的改变不仅可诱导痤疮皮损的形成,还会导致炎症的产生等[8]。ALA所介导的光动力疗法(ALA-PDT)可抑制皮脂分泌和缩小皮脂腺的大小[9-12]。ALA-PDT抑制皮脂分泌具体机制可能是通过AMPK/SREBP-1途径抑制原代脂质分泌[11]。此外,ALA-PDT可以通过mTOR信号通路体外抑制SZ95细胞生长,从而减少脂质生成[12]。但是,5-ALA的亲水性限制其在组织和细胞膜间的通透性,影响光动力疗法的治疗效果。
MSCs具有向潜在炎症和病变附近的高度迁移的先天靶向能力[13-14],因此MSC膜包被纳米颗粒或药物是一种具有选择性、靶向特性的有效递送方法[15],有望成为未来新的载药工具。研究表明,MSC膜包载异维A酸具体提高异维A酸的透皮吸收效率、控制异维A酸的释放、减小药物的刺激性等特点,为痤疮的的经皮给药提供了新的选择[4]。
本研究探讨了新型的ALA给药方式,利用脐带来源的间充质干细胞(UC-MSCs)膜包载ALA进行体内、体外研究。首先,我们对比了不同浓度下ALA和ALA@STCM对于SZ95细胞存活率的影响,发现了MSC膜包载ALA未明显增加细胞毒性,上述结果提示着MSC膜的应用具有安全性。随后,我们构建了金黄地鼠痤疮动物模型,通过组织学分析(H&E、ORO染色),发现了ALA@STCM组金黄地鼠缩小皮脂腺斑和抑制皮脂分泌作用显著优于ALA组,上述结果提示着MSC膜包被的药物递送系统提高了ALA的效能。
本研究的结果为开发新的痤疮药物给药工具提供了线索,但仍存在局限性,本文只探讨了5-ALA@STCM的毒性和抑制皮脂分泌的能力,尚有许多值得研究的方向,如:5-ALA@STCM对于毛囊微生物、皮脂腺炎症的影响等,未来仍需研究其长期有效性和安全性。
总之,间充质干细胞膜包载5-ALA介导的光热作用抑制金黄地鼠皮脂腺斑的皮脂分泌以及缩小皮脂腺斑的作用显著优于5-ALA组,值得未来进一步研究与探索。

